本年度第19回年会におけるポスター賞受賞者の方にコラムを寄稿いただきましたので、掲載致します(演題番号順)。
日本蛋白質科学会 役員会
1P-006 石坂 優人(北海道大学)

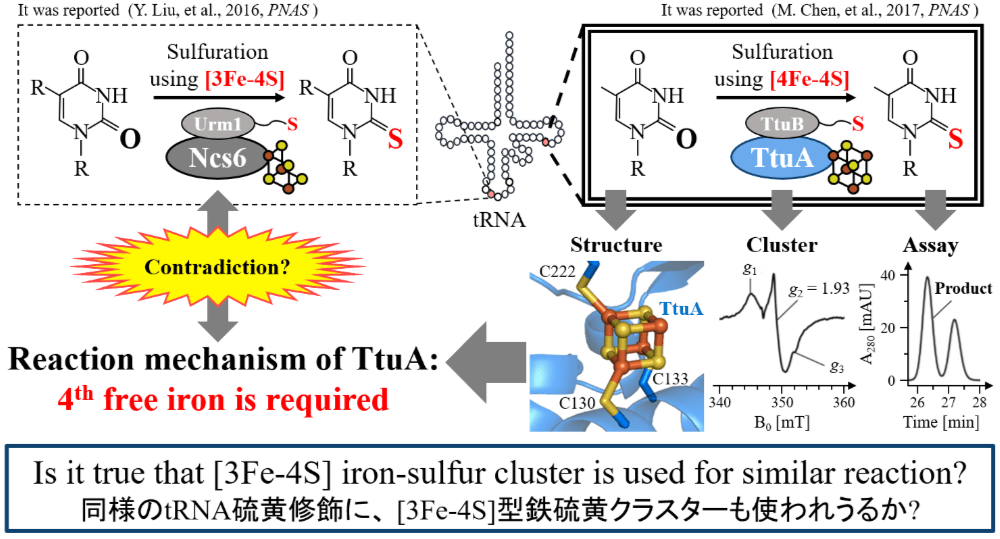
このたびはポスター賞を受賞することができ、大変光栄に思います。今回は「tRNA 硫黄修飾酵素の活性と鉄硫黄クラスター構造の関連性」について発表しました。
鉄硫黄クラスターは酸素に触れると崩壊する補因子であり、呼吸や光合成だけではなく、蛋白質の生合成を担う tRNA の成熟化にも関与します。特に、鉄硫黄クラスターを用いた tRNA 成熟化の一種である硫黄修飾が破綻すると、tRNA の熱安定性や翻訳の正確性などが低下することが知られています。そこで本研究では、4つの鉄原子を持つ [4Fe-4S] 型鉄硫黄クラスターを利用する tRNA 硫黄修飾酵素 TtuA に着目し、鉄硫黄クラスターの役割を解明することを目的としています。
私達は以前、TtuA が4番目の鉄を用いて TtuB の硫黄を受け取る機構を提唱しました。一方、TtuA ホモログで真核生物由来の Ncs6 は4番目の鉄がない [3Fe-4S] 型クラスターを用いるという報告もあり、同様の tRNA 硫黄修飾反応に異なる鉄硫黄クラスターが利用されうるかを理解する必要があります。そこで本研究は、人工的に作成した [3Fe-4S] 型 TtuA の安定性を電子スピン共鳴法(ESR)で解析し、TtuA 変異体の活性測定で判明した重要残基が Ncs6 にも保存されていることを明らかにしました。さらに、TtuA と Ncs6 が利用する鉄硫黄クラスターのタイプについて議論しました。
最後にこの場をお借りして、共同研究者の堀谷正樹先生、田中良和先生、当研究室の姚閔先生、研究費を支援して下さった本学の「新渡戸スクール」に心より感謝申し上げます。
1P-068 廣田 梨絵子(東京大学)

この度はポスター賞という思いも寄らない賞を頂き、驚きつつも大変光栄に存じます。
脂質は体内で脂質膜形成やエネルギー源となる他、脂肪酸とその代謝物はホルモンとしての働きも持ち、生体内での情報伝達に重要な役割を担っています。脂質分子をリガンド受容する GPCR は創薬のターゲットとしても注目されています。近年、脂質分子をリガンド受容する GPCR の構造が多く解かれるようになってきたものの、そのリガンド結合メカニズムは未解明のものが多く、さらなる研究が必要とされています。
私は脂質受容 GPCR の中でも、タンパク質側面に脂質二重膜に対して開いた溝を持つリゾフォスファチジン酸受容体 LPA6 に注目し、分子動力学(MD)シミュレーションによってその特徴的な構造がリガンド結合にどのように関わるかの解明を目指しました。この溝は LPA6 以外にも複数の脂質受容 GPCR で確認されており、脂質分子との結合に関わりがあることが示唆されています。また本研究では Markov State Model 法という複数の MD シミュレーションのデータから長時間のシミュレーションを再構成する手法を採用し、リガンド非結合状態から結合状態に至るまでの連続した構造変化の観察に成功しました。
最後にありましたが、本研究を行うにあたりご指導を賜りました濡木教授をはじめ関係者の方々、ならびに審査員の先生方をはじめとする学会関係者の皆様にこの場を借りて厚く御礼を申し上げます。
1P-134 平山 千尋(東北大学)

この度はポスター賞を頂くことができ、大変光栄に思っています。
「シャペロン」をご存じでしょうか。語源はフランス語とされており、元来、社交界デビューする若い女性をサポートする付添人のことを指すそうです。華やかな時代に思い馳せると個人的にはとてもわくわくします。この縁の下の力持ちである「シャペロン」がタンパク質の世界でどのように働いているのか、それを私は研究しています。
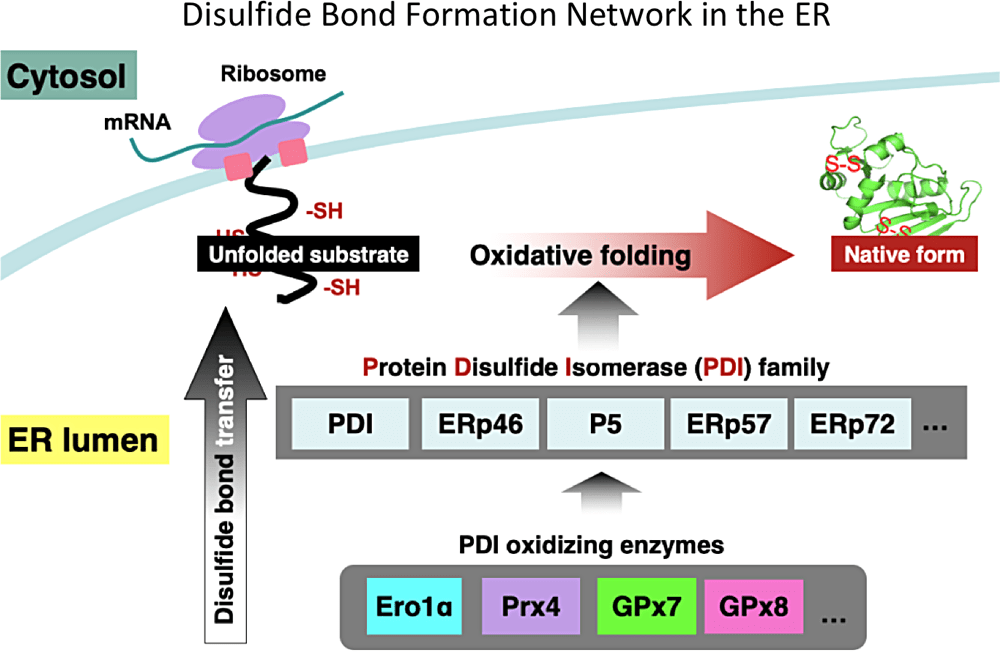
具体的には分子シャペロンの一種である「Protein Disulfide Isomerase(PDI)ファミリー酵素」の作用機序解析を行っています。この PDI ファミリー酵素は哺乳動物の小胞体内に存在し、基質にジスルフィド結合を導入することで正しいフォールディングを促すことが明らかになりつつあります。しかし、新生ポリペプチド鎖(新生鎖)の合成プロセスのどの段階でどのような作用機序のもと PDI ファミリー酵素が触媒しているかは未解明です。現在、自身が開発した新生鎖へのジスルフィド結合導入モニタリングアッセイと高速原子間力顕微鏡を用いて上述の問題を解明しようとしています。今後は、さらに研究を発展させ、細胞生物学的手法にも着手する予定で、分子レベル~細胞レベルでの生命現象の解明を目指したいと考えています。
最後になりましたが、指導教員である稲葉教授をはじめとする稲葉研究室の皆様、共同研究先である兵庫県立大学の今高教授、町田助教、熊本大学の小椋教授、大阪大学の野井助教に、この場をお借りして厚く御礼申し上げます。今回頂いた賞を励みに、今後の研究に取り組んでいきたいと思います。
1P-147 Elza Firdiani Sofia(東北大学)

I am really glad that I could receive a poster award during the Annual Meeting of Protein Science Society Japan 2019.
My current research focuses on disulfide bond formation network in the ER, catalyzed by PDI family members and their oxidases. GPx7 and GPx8 are recently identified as ER-resident glutathione peroxidase that are capable of coupling their peroxidase activity with PDI oxidation. In this project, we aim to elucidate the molecular mechanisms of GPx7/8-catalyzed PDI oxidation driven by H2O2 as well as their physiological importance.
Right now, I am finishing my master’s and I will have my defense in early August, then I will work on the remaining tasks in order to complete the current project.
I would like to thank all members of Inaba Laboratory at Tohoku University for their kind help, especially Prof. Kenji Inaba, Dr. Masaki Okumura, Dr. Shingo Kanemura, and Dr. Hiroshi Kadokura for their guidance and teaching.
1P-191 金田 生穂(東京大学)

この度は第19回日本蛋白質科学会年会におきましてポスター賞に選出いただき、まことにありがとうございました。津本浩平先生を始めとしてご指導いただいております津本研究室の皆様、共同研究者の九州大学 Jose Caaveiro 先生、そして学会関係者の皆様に深く感謝申し上げます。
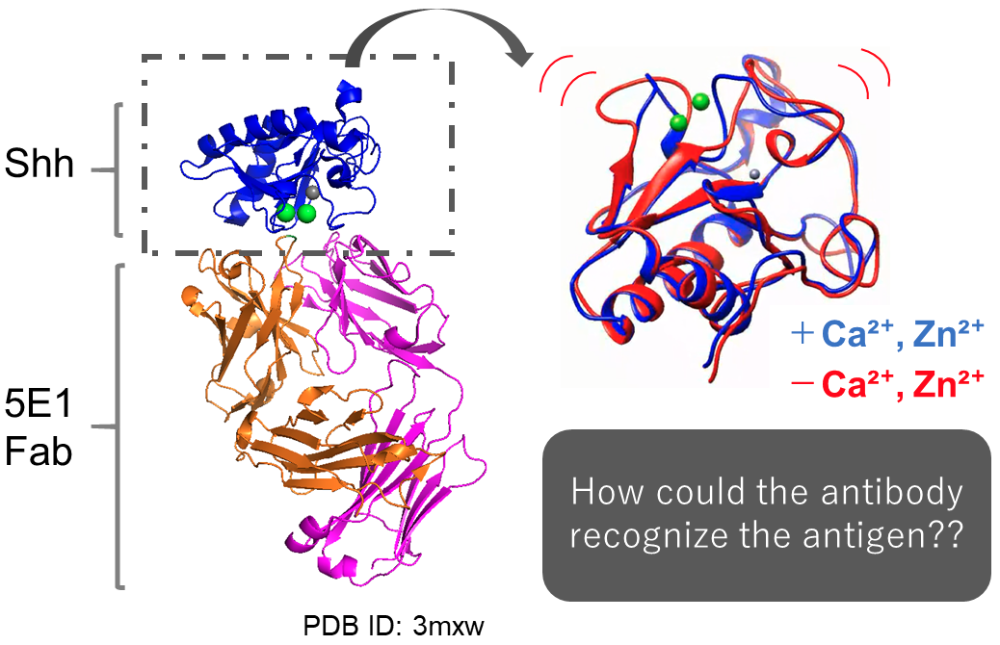
ポスター発表では、抗体の抗原認識に関わる物理化学的、動力学的な解析について報告いたしました。一般的に抗体は抗原を非常に厳密に認識するため、構造的なゆらぎを生じる抗原に対しては抗体を取得しにくいことが知られております。そこで、本研究では柔軟性の高い抗原に対する抗体設計の指針を見出すことを目的として、金属イオンの有無で柔軟性の変わりうるモデル抗原 Shh に対する抗体の結合機構を解析しました。その結果、金属イオンによって抗原の柔軟性が変わりうること、さらにその抗原の柔軟性の変化に応じて抗体が認識を変えている可能性を強く示唆する結果を得ることができました。
今後もさらなる解析を重ね、より詳細な機構を明らかにしたいと考えております。本研究の議論を深める場をいただきましたこと、重ねて御礼申し上げます。
2P-005 杉山 葵(北海道大学)

この度は、第19回日本蛋白質科学会ポスター賞という名誉ある賞を頂くことができ、大変嬉しく思っております。学会関係者の皆様にこの場をお借りして御礼申し上げます。
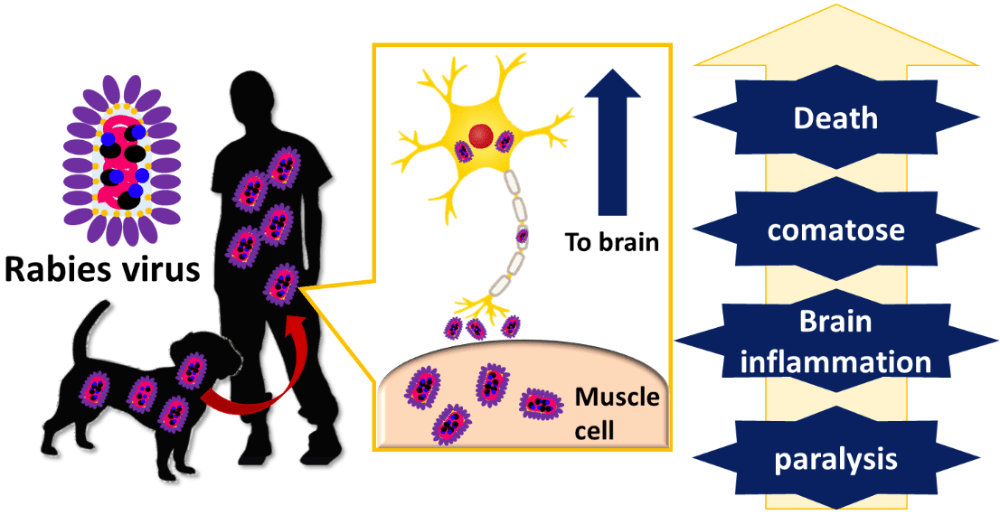
ポスター発表では、狂犬病ウイルス(RABV)が宿主の免疫経路を阻害する機構について報告させて頂きました。RABV は、人獣共通感染症である狂犬病を引き起こします。発症後の治療法は確立されておらず、発症すればほぼ100%が死に至ります。そのため、死者はすべての大陸に渡り、年間55,000人にのぼります。RABV が宿主に感染できる要因の一つに、宿主の免疫経路を不活化し、自らの増殖に有利な環境へと誘導する「免疫逃避機構」を持っていることが挙げられます。この機構の標的となるのが、宿主の免疫経路を担う STAT 分子です。RABV は自身のウイルス蛋白質を用いて、STAT 分子を不活化することが知られています。しかし、ウイルス蛋白質と STAT 分子の詳細な結合様式は明らかになっておらず、STAT 分子をウイルス蛋白質が認識、不活化する機構は不明です。そこで私は、両者の相互作用解析を行い、結合部位を絞り込むことができました。今後はより詳細な解析を行うことで、両者の相互作用の必要最小領域を絞り込みたいと考えております。
最後に、いつもご指導頂いている尾瀬先生、姚先生、于先生に心より感謝致します。今後も面白い発見を発表できるよう、日々精進して参りたいと思います。
2P-014 塩澤 亜希(横浜市立大学)

この度は第19回日本蛋白質科学会にてポスター賞をいただき、大変光栄に思います。まずはこの場をお借りして、学会関係者の皆様、日頃からご指導いただいている禾晃和准教授、また構造生物学研究室の皆様に厚く御礼申し上げます。
今回の研究では、悪玉コレステロールという名前でも有名なLDL(low-density lipoprotein: 低密度リポタンパク質)を細胞内へ取り込む LDL 受容体(LDLR)と、そのホモログであるApoER2について取り上げました。先行研究から、LDLR については pH 依存的に構造変化してリガンドとの結合と解離を制御していると考えられていましたが、詳細なメカニズムやこの仕組みが LDLR ファミリー内で保存されているかは十分には検証されていませんでした。そこで私は、ゲルろ過カラムで分画しながら X 線小角散乱測定を行う SEC-SAXS を用いて、生体内での環境を模した溶液条件で分子構造の変化を解析することにしました。また、構造変化の調節の仕組みをより詳細に解析するために、表面プラズモン共鳴を用いた相互作用解析などにも取り組みました。発表当日は、X 線小角散乱など、構造解析の専門家の方々からたくさんのご指摘をいただきました。ディスカッションを行う中で、研究を進める上での新たなヒントも数多く得ることができ、とても有意義な機会となりました。今回の受賞を励みに、日々の研究活動に勤しんでいく所存です。
2P-109 小林 和弘(東京大学)
この度はポスター賞という形で私の研究を評価していただき大変光栄です。この場をお借りして、審査員の先生がたをはじめとした学会関係者の皆様に御礼申し上げます。
私は Cryo 電子顕微鏡を用いてタンパク質相互作用を原子分解能で明らかにする事で、GPCR のシグナル伝達機構を解明したいと思っています。Cryo 電子顕微鏡は革新的な技術である一方で、非常に高額であり世界でも GPCR の単粒子構造解析が可能な研究室は限られています。
私は当研究室における Cryo 電子顕微鏡を用いた構造解析の立ち上げ実験に携わってきました。非常に精製度の高く状態の良いサンプルでも、きつい orientation bias が存在すると単粒子構造解析では構造決定が出来ません。私は試行錯誤の果てに、新しいタンパク質をデザインする事で orientation bias を解消、高分解能での単粒子構造解析に成功しました。構造解析の結果、ターゲット受容体のリガンド及び G タンパク質との相互作用を明らかにするだけでなく、GPCR の持つダイナミクスの解明に重要な知見が得られました。この長い試行錯誤の中で発見した最適条件は再現性もよく、後続の構造解析の助けとなっていると自負しています。
今回の発表では多くの機能解析の専門家とも意見交換ができ、今後の実験に期待が膨らみました。今後は Cryo 電子顕微鏡以外の様々な手法も取り入れながら、GPCR のシグナル伝達機構解明に向けて研究を進めていきます。
最後となりますが、私の研究を指導して下さっている濡木教授、西澤助教、志甫谷特別研究員をはじめとした濡木研究室の方々、及び共同研究者の方々に心から御礼申し上げます。
2P-111 坂本 眞伍(東京大学)

この度は第19回日本蛋白質科学会にて、ポスター賞を頂き誠に嬉しく思います。関係者の皆様、指導して頂いた先生方に、心より感謝申し上げます。
生体サンプル中の酵素活性は病態の状態を反映して変化することが知られており、これらを高感度に測定することは疾患の診断に有用です。近年、超高感度な酵素活性測定技術として、マルチウェルチャンバー型のマイクロデバイスが開発されました。この技術では、微小なウェルに酵素を封入し、蛍光プローブと反応させることで、酵素1分子によって生じる蛍光性化合物であっても十分に検出可能なシグナルを得ることができるため、従来の測定系からの大幅な高感度化が期待できます。しかし、各ウェルに封入される酵素は確率論的に決定されるため、類似の活性をもつ酵素(アイソザイムなど)に関しては、ウェル中の酵素を同定することが困難でした。
私は、酵素に対し異なる基質認識部位と異なる波長域の蛍光をもつ複数のプローブを反応させ、各プローブに対する反応性の組み合わせのパターンの差異からウェル中の酵素を同定するという手法を考案しました。本研究では別々の疾患に関連する複数のアイソザイムをもつ ALP をターゲットにプローブ開発を行い、これを用いてヒト検体血清中の ALP アイソザイムの1つ、小腸型 ALP を高い信頼性を持って検出・定量することに成功しました。さらに、蛍光プローブの組み合わせを変えることで、サンプル中に存在する基質選択性の異なる複数種のホスファターゼを1分子レベルで検出することに成功しました。
今後は、対象酵素の拡張や対象疾患の探索を行い、新規病態診断法の基盤となる技術の開発に取り組む予定です。
2P-116 三輪 つくみ(東京工業大学)

この度はポスター賞を頂き、光栄に思います。研究について議論を交わし、さらに評価をいただけるということは大変うれしい事です。審査員の先生方をはじめとする学会関係者の皆様に心から御礼申し上げます。
私は低分子熱ショックタンパク質(sHSP)の新規な翻訳応答について研究しています。sHSP は変性タンパク質と共に凝集することが仕事の分子シャペロンで、バクテリアでは mRNA の熱ゆらぎを介した高温依存的な翻訳が行われることが知られています。しかし本発表では大腸菌の sHSP である IbpA は、細胞内に凝集体が蓄積すると温度に関係なく翻訳が促進されるということをお示ししました。また翻訳制御機構について解析を進めたところ、IbpA は自身の翻訳を抑制しており、細胞内の IbpA が不足することで ibpA 翻訳が抑制から解放されるということがわかりました。このことから IbpA の変性タンパク質との共凝集は、遊離の IbpA の枯渇を介して自身の翻訳抑制を解除し、不足した分を翻訳によって補うという制御モデルを提案しました。今後も解析を続け、詳細な機構について解明していくつもりです。
今回いただいた賞を励みに、今後もみなさんに新しく見つけたことをお伝えできるよう頑張っていきます。
2P-137 大岡 紘治(東京大学)

この度は第19回日本蛋白質科学科年会において、ポスター賞を頂きまして大変光栄に思います。
本研究では、理論計算から自由エネルギー地形を導出し、タンパク質のフォールディング機構の解析を行っております。自由エネルギー地形の計算には、タンパク質を粗視化した統計力学モデルである Wako-Saitô-Muñoz-Eaton(WSME)モデルを用いました。このモデルをマルチドメインタンパク質に適用できるように、アミノ酸配列上遠距離の非局所的相互作用が考慮可能な拡張型 WSME モデルを考案し、計算手法を確立しました。
今回はジスルフィド結合に対して拡張を適用し、リゾチームとα-ラクトアルブミンの自由エネルギー地形を計算しました。その結果、実験結果を支持するような自由エネルギー地形の導出に成功しました。さらにリゾチームやα-ラクトアルブミンは由来する生物種によってフォールディング機構が異なることが実験から知られていましたが、自由エネルギー地形の記述により、統一的に生物種によるフォールディング機構の違いが説明できることが示唆されました。
今後も物理学の観点から、タンパク質の奥深い物性に迫っていきたいと思います。
2P-188 唐澤 昌之(名古屋⼤学)

第19回年会にてポスター賞に選出して頂きましたこと、⼼より光栄に思っております。運営関係者の皆様ならびに審査員の先⽣⽅に厚く御礼申し上げます。また、これも終始丁寧なご指導の賜物と、現指導教員の荘司⻑三教授、前指導教員の渡辺芳⼈先⽣にこの場をお借りして深く感謝申し上げます。
さて、酵素と基質の関係は「鍵⽳」と「鍵」に喩えられるように、鍵⽳(酵素の活性部位)と合わない鍵(基質)を⼊れても酵素反応は進⾏しません。そのため、酵素によって標的分⼦を変換するためには、酵素の基質特異性を変える必要があります。当研究室では、「蛋⽩質を騙す」というコンセプトの元、天然の基質に形を似せた擬似基質、いわば偽物の鍵を酵素に作⽤させることで、酵素の基質特異性を変換する⼿法について研究を展開してきました。
本年会では、この反応システムを「菌体反応系」へと応⽤し、擬似基質によって、菌体内に発現した脂肪酸⽔酸化酵素を活性化できることを報告いたしました。酵素を過剰発現させた組み換え⼤腸菌の懸濁液に擬似基質を添加するだけで、擬似基質が菌体の中へと浸透し、⾮天然基質の⽔酸化反応が進⾏しました。私は現在、擬似基質がどのように菌体に取り込まれているのか、また、取り込みを増幅するようなシステムを構築できないかという点に焦点を当て、より効率的な物質変換系の確⽴を⽬指しています。
最後になりますが、当研究室は本年度より、荘司研究室として新体制でのスタートを切りました。この受賞を励みに、決意を新たにして研究に邁進する所存です。皆様、本当にありがとうございました。
