本年度第24回日本蛋白質科学会年会(札幌)における若手奨励賞受賞者の方から原稿をいただきましたのでここにお知らせします(演題番号順)。
日本蛋白質科学会 役員会
若手奨励賞 9名
YSA-01 九川 真衣(東京大学)

この度は、蛋白質科学会若手奨励賞・優秀賞に選出していただき誠にありがとうございます。審査をしてくださった先生方や、年会の開催に携わってくださった先生方、そしてシンポジウムにて発表を聴いてくださった方々に心より御礼申し上げます。
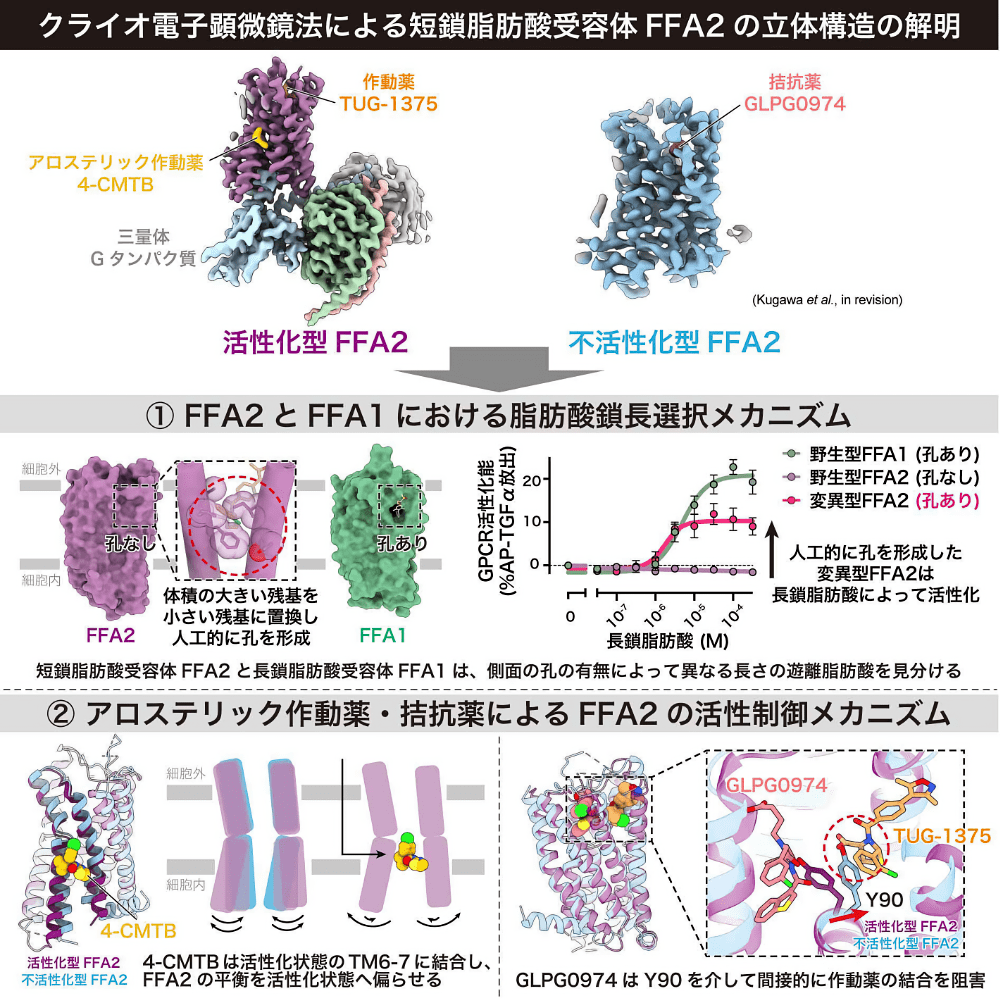
脂質は様々な機能をもちますが、その中でもシグナル分子としての機能は、生物が恒常性を保つために重要です。脂質の一種である遊離脂肪酸は、Gタンパク質共役型受容体である遊離脂肪酸受容体(FFARs)に作用し、代謝機能や免疫機能を幅広く制御しています。私はFFARsの中でも、短鎖脂肪酸を認識するFFA2に着目して研究をしてきました。
これまで、FFA2が多様な長さの遊離脂肪酸の中で短鎖脂肪酸のみを選択的に認識するメカニズムや、FFA2を標的とする作動薬や拮抗薬がFFA2の活性を制御するメカニズムは明らかになっていませんでした。本研究ではクライオ電子顕微鏡を用いて、FFA2の立体構造を活性化型と不活性化型の二状態で明らかにすることに成功しました。立体構造とそれに基づく変異体解析から、FFA2とその近縁である長鎖脂肪酸受容体FFA1が、側面に空いた孔の有無によって遊離脂肪酸の長さを見分けていることを明らかにしました。さらに、FFA2を標的とする作動薬や拮抗薬が、これまでに報告のないユニークなメカニズムによってFFA2の活性をアロステリックに制御していることを見出しました。
最後になりますが、一流の研究者としてのあるべき姿を教えてくださった加藤英明教授、FFA2の熱さに共感し共に研究を作り上げてくださった川上耕季研究員と共同研究者の皆様、そしていつもサポートしてくださる加藤研メンバーの皆様には、この場をお借りして心から感謝申し上げます。そして、3年半苦楽を共にし、私に数えきれないほどのワクワクを体験させてくれた最高の研究対象であるFFA2に、愛と感謝を伝えたいです。
YSA-06 大貫 隼(分子科学研究所)

この度は第24回日本蛋白質科学会年会にて若手奨励賞をいただき、大変光栄に存じます。
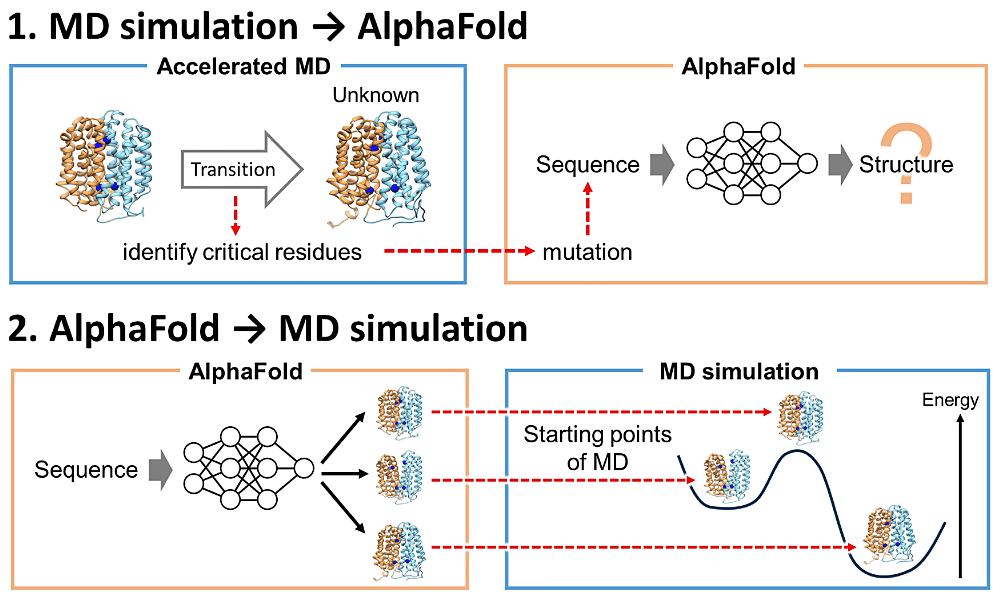
本研究は、トランスポータータンパク質の未解明構造状態を計算科学の立場から明らかにすることを目的としています。トランスポーターは構造状態間の切り替え(交互アクセスメカニズム)によって基質を運ぶと考えられていますが、多くのトランスポーターでは一部構造状態が未解明のままになっています。そこで我々は分子動力学(MD)計算と AlphaFold2(AF2)を統合した二種類の構造探索手法を考案しました。1つはMD計算(探索を効率化するAccelerated MD法を利用)によって既知構造から未解明構造への遷移を観測および遷移時の重要残基を特定した後、AF2でこの重要残基に変異導入して影響を調査する方法です。ここで得た変異体は未解明構造の実験における有益な情報になると期待されます。もう1つはまずAF2により多様な構造状態を予測し、これをMD計算に用いる方法です。AF2予測にはMD計算で得ることが困難な遷移状態付近の構造も含まれていることがわかり、これをMD計算の出発点にすることで構造状態遷移の調査を効率化できます。MD計算とAF2はタンパク質の構造探索の有効なアプローチとして広く利用されてきましたが、これらの相互活用が両者の力をさらに引き出すことを本研究は明らかにしました。
本研究の遂行にあたり、岡崎圭一准教授(分子科学研究所)、山下敦子教授(岡山大学)、Titouan Jaunet-Lahary博士(分子科学研究所)には多くのご助力を賜りました。ここに感謝申し上げます。
YSA-08 佐野 文哉(東京大学)

このたびは歴史ある日本蛋白質科学会から若手奨励賞をいただき、誠にありがとうございます。若手奨励賞シンポジウムにおいては若手奨励賞優秀賞までいただき、大変光栄であると共に、背筋が伸びる思いです。審査をしてくださった先生方をはじめ、蛋白質科学会の関係各位の先生方に、心よりお礼申し上げます。
多くの細胞から構成される高等真核生物が生命活動を営むためには、細胞同士が生理活性物質を介して互いにコミュニケーションを取り合う必要があります。多くの生理活性物質が細胞膜を通過しないため、こうした細胞間のコミュニケーションは主に細胞膜上に存在する受容体が担います。この際、外部からの特定のシグナルを正確に認識するために、生理活性物質であるリガンドと受容体の関係は特異的である必要性があります。しかし、ケモカイン受容体と呼ばれるGタンパク質共役型受容体(GPCR)の一群ではこの特異性がしばしば崩れ、1つの受容体が複数のケモカインを認識したり、また1つのケモカインが複数の受容体に結合したりする乱雑性が存在します。本研究では、最も多様なケモカインを認識する受容体であるC-X-Cケモカイン2型受容体に着目し、クライオ電子顕微鏡法により多様なケモカインの認識機構を原子レベルで明らかにしました。さらに下流のプロファイルが良く調べられているC-X-Cケモカイン3型受容体を題材に、多様なケモカインの受容が下流のシグナルの選択性を生み出す機構も明らかにしました。一連の包括的な研究は、ケモカインを標的とした将来の創薬研究に貢献することが期待されます。
本研究を行うにあたり、濡木教授、Shukla教授をはじめとした東京大学・濡木研究室の方々、インド工科大学・Shulka Laboratoryの方々に大変お世話になりました。この場を借りて御礼申し上げます。
YSA-09 元根 啓佑(ワシントン大学)

この度は若手奨励賞を頂き、大変光栄に存じます。このような機会を頂きました審査員の皆様並びに運営スタッフの皆様に心より御礼申し上げます。
「次世代タンパク質シーケンサー」と呼べるものは未だ存在しません。次世代DNAシーケンサーの登場は生命科学を一変させましたが、プロテオミクス分野においてそのような非連続的な変化は、質量分析法によるパラダイムシフトが起きた1980年代以降起きていません。私はナノポアと呼ばれるハイスループット1分子測定技術を用いて、次世代タンパク質シーケンサーを開発したいという夢を持っています。
私は4年間、米国シアトルにあるワシントン大学でポスドクとして研究を続けてきましたが、この度、大阪大学工学研究科生物工学専攻の青木航教授の研究室に助教として着任し、ナノポア研究を推進していく機会を頂きました。これから日本の研究者の皆様と一緒に研究できることを非常に楽しみにしていますが、日本のナノポア研究者の人口は多くありません。研究者や学生の方々にもっとナノポア研究に興味を持ってもらえるよう、そして一緒に研究したいと思ってもらえるよう、夢のある研究を展開していきたいと思います。
最後になりましたが、ワシントン大学での研究活動をご支援いただきました大阪公立大学の片岡道彦先生、三浦夏子先生、並びに研究推進課の方々には深く御礼申し上げます。また、本研究を共に推進していただいたワシントン大学のラボメンバーと、海外研究支援を頂きましたAMEDと日本学術振興会に深く御礼申し上げます。
YSA-02 松林 英明(東北大学)

この度は第2024年度日本蛋白質科学会年会にて若手奨励賞をいただき大変光栄に思います。審査員の先生方、蛋白質科学会の関係各位の先生方に、心よりお礼申し上げます。
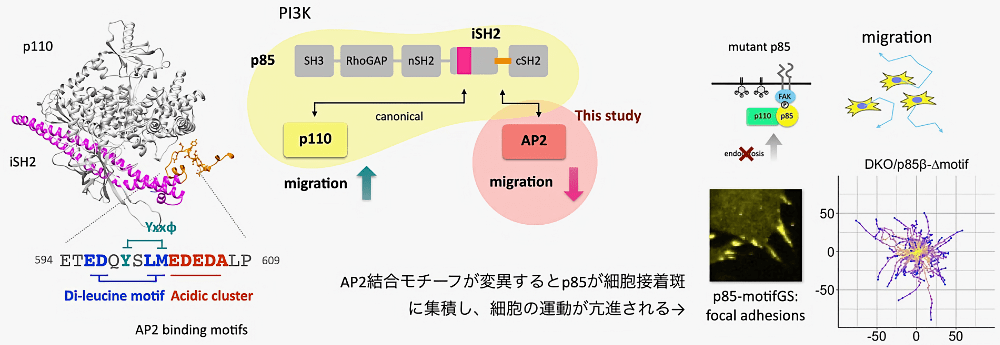
受賞対象となった研究では、細胞膜上でPI(3,4,5)P3を産生する酵素PI3-kinaseについて、新しい機能と制御機構を発見しました(Matsubayashi* et al., 2024, Nat. Commun.)。哺乳類のClass IA PI3-kinaseは触媒サブユニットのp110と制御サブユニットのp85から構成されます。このうちp85がもつiSH2ドメインと呼ばれるcoiled-coil領域は、キナーゼドメインを持つp110への結合と安定化に関わることから、PI3-kinaseを正に制御する部位であると考えれていました。本研究では、このiSH2に、エンドサイトーシスのアダプター分子AP2が結合する領域もあることを新たに発見しました。さらに、生化学、ライブイメージング、細胞生物学を用いた実験から、iSH2-AP2の結合は、クラスリン依存型のエンドサイトーシスを誘導し、PI3-kinaseの細胞内局在を制御することで、細胞の運動のブレーキとして働くことを明らかにしました。
本研究によって、細胞運動のアクセル(正の制御)として働くと考えられていたiSH2ドメインに、実はブレーキ(負の制御)としての顔もあり、ひとつのドメインが細胞運動という基盤的な生命機能を精密に制御していることが明らかになりました。ふとした発見から始まった研究でしたが、PI3K、AP2、エンドサイトーシス、細胞接着班、細胞運動という多数の分子や反応を跨いだ、細胞運動の興味深い制御メカニズムを明らかにできたことに、研究を支えてくださった井上尊生研究室(Johns Hopkins University)の皆様、共同研究者の先生方に改めて感謝申し上げます。
YSA-03 柚 佳祐(神戸大学、台湾国立陽明交通大学)

若手奨励賞をいただき大変光栄に存じます。
今回の講演内容は、私が神戸大学の博士課程在学時より進めてきた研究で、台湾の新竹市にあります国立陽明交通大学の増原研との共同研究の成果です。実験のために何度もタンパク質試料を持って台湾に通ったのは大変でしたが、今では良い思い出です。私は今春に学位を取得し、この度ご縁があり増原研のポスドクとして台湾で研究生活を送っています。学生時代の研究分野はアミロイド線維形成機構に関するタンパク質科学でしたが、現在はレーザー化学の分野に足を踏み入れ、集光レーザーによる光圧を用いた新しいタンパク質研究の開拓に挑戦しているところです。
生物学的液–液相分離によって生成する液滴は、様々な生理機能に関与するだけでなく、アミロイド線維の生成場としても最近注目を集めています。現在では液滴に関する様々な研究が行われていますが、液滴の生成場所、タイミング、個数、動きなどを制御する手法が確立されておらず、詳細な機構解明は困難です。それに対して我々は、光圧によってαシヌクレインの液滴生成を「一液滴レベル」かつ「時空間的」に制御できることを実証しました。さらに、継続的なレーザー照射によって、液滴の生成だけでなく成長や老化までの一連のプロセスをその場観察することに成功しました。このようなタンパク質科学とレーザー化学の融合によって生まれる新規現象に私は大きな可能性を見出しており、引き続きユニークな研究を展開していきたいと思います。
最後になりますが、日頃から温かいご指導いただいております、茶谷絵理先生(神戸大学)、増原宏先生(台湾国立陽明交通大学)をはじめ関係者の皆様に深く感謝申し上げます。今後ともご指導ご鞭撻を賜りますよう何卒よろしくお願いいたします。
YSA-04 伊藤 智之(東北大学)

この度は第24回日本蛋白質科学会年会にて若手奨励賞をいただき大変光栄に存じます。
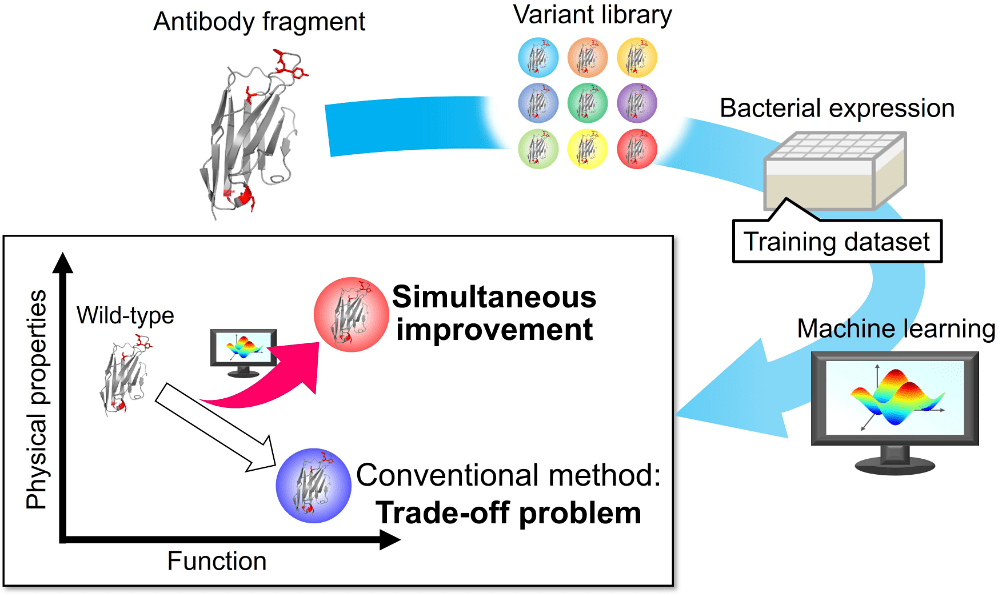
医薬品や産業用タンパク質の機能向上は、しばしば構造安定性の低下という代償を伴います。本研究では、物性を損なわずに機能を向上させる手法として、機械学習を組み込んだ進化分子工学を用いました。ここでは、抗体断片に変異を導入し、100個程度の変異体のアミノ酸配列とその機能・物性を学習データとして使用しました。このアプローチにより、結合力・微生物発現量・熱安定性が同時に向上した変異体を取得することができました。この結果は、限られたデータでも機械学習が複数の特性を同時に最適化できる可能性を示しています。今後、こうした機械学習と進化分子工学の組み合わせにより、タンパク質機能進化のハードルを一層低減できることを期待しています。
本研究を行うにあたり、梅津光央教授、中澤准教授をはじめとする研究室の皆様、ならびに共同研究者の方々からの多大なご支援とご指導を賜りました。心より感謝申し上げます。
YSA-05 藤原 孝彰(東北大学)

この度は第24回日本蛋白質科学会年会にて若手奨励賞をいただき大変光栄に存じます。また、地元である北海道で開催された年会で、顔馴染みの方々をはじめ、多くの皆様に研究を知っていただく機会を頂けたこと心より嬉しく思います。
私は学生の頃よりタンパク質の結晶構造解析を行って参りましたが、構造生物学の分野における昨今の目覚ましい技術革新により、学生当時では挑戦的であった研究課題にも取り組むことができるようになってきていることを実感します。
例えば、酵素反応の途中の状態を精緻に観測することもその一つではないでしょうか。多くの酵素は室温で反応が進行してしまうため、室温付近の測定環境下では、中間状態を観測することが困難な場合があります。一方,クライオトラップ法は、反応の中間状態を捉える手法として従来から利用されてきましたが、極低温条件で捕捉された構造が室温環境と異なっていたり、構造情報が欠失してしまうことがあります。
受賞対象となった研究は、温度などの測定環境が厳密に制御できる測定基盤を構築し、X線自由電子レーザーを用いたシリアルフェムト秒結晶構造解析により、酵素反応の中間体を捉えるものです。標的とした酵素はテルペン環化酵素で、複雑な骨格を有する多環式化合物を合成する反応を触媒します。これまでに、生化学実験や分子シミュレーションにより、多数の反応中間体を経由する反応機構が提案されておりましたが、実際の中間体を観測した報告はありませんでした。我々は、本研究で確立した測定技術を用いることで、当該酵素の反応過程で生じる化合物の結合状態を可視化することに成功しました。
最後になりますが、放射光ビームラインスタッフの皆様や共同研究者の皆様には、本研究を行うにあたり、多大なるご協力を賜りました。この場を借りて厚く感謝申し上げます。
YSA-07 大岡 紘治(東京大学)

この度は第24回日本蛋白質科学会年会にて若手奨励賞をいただき大変光栄に存じます。
タンパク質のフォールディング反応機構の解明は生命科学における重要課題の1つです。統計物理学に基づくタンパク質の粗視化モデルであるWako-Saitô-Muñoz-Eaton(WSME)モデルは、タンパク質の立体構造を入力として、フォールディング自由エネルギー地形を描くことができます。本研究ではWSMEモデルに非局所的相互作用を導入した「WSME-Lモデル」を構築しました。このモデルにより、従来のモデルと比べて小型タンパク質の予測精度が向上し、従来は扱えなかった大型タンパク質についても、実験と整合するフォールディング反応過程の予測に成功しました。さらに、ジスルフィド結合を非局所的相互作用の一種として扱うようにWSME-Lモデルを改良することで、ジスルフィド結合の形成を伴うフォールディング反応や、ジスルフィド結合存在下におけるフォールディング反応も予測可能となりました。今後はWSME-Lモデルを、実験やAlphaFold 2の予測で得られたタンパク質の立体構造に適用することで、様々なタンパク質のフォールディング反応機構の解析に取り組んでまいります。
最後に、本研究を遂行するにあたりご指導をいただきました新井宗仁先生(東京大学)をはじめ、研究をサポートしていただきました皆様に心より御礼申し上げます。
