本年度第23回日本蛋白質科学会年会(名古屋)におけるポスター受賞者の方から原稿をいただきましたのでここにお知らせします(演題番号順)。
日本蛋白質科学会 役員会
1P-016 菊地 杏美香(横浜市立大学)

この度は、第22回日本蛋白質科学会年会におきましてポスター賞を授与いただき、大変嬉しく思います。
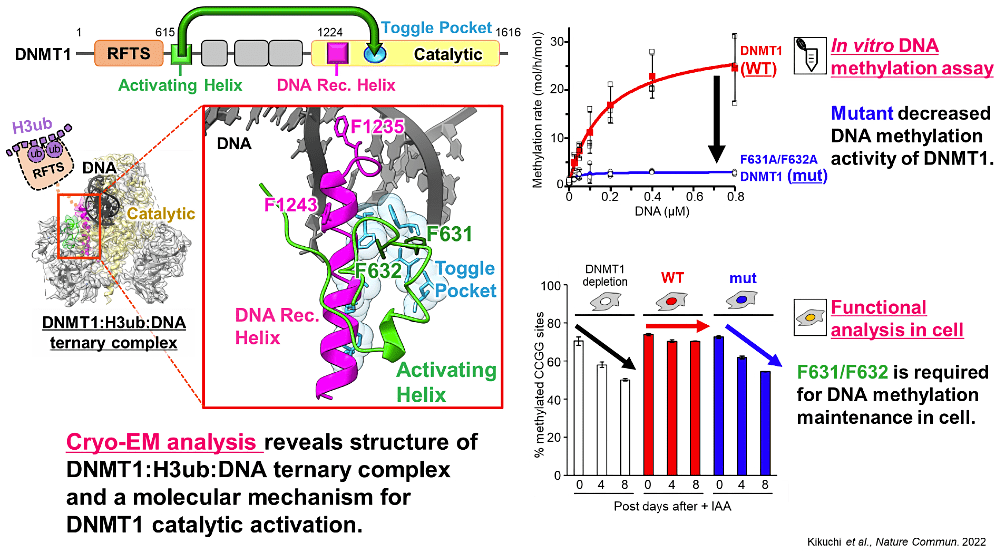
私は、DNA メチル化酵素 DNMT1 の活性化機構を構造生物学的な観点から解明する研究をしています。DNMT1 は個体の形成に必須のタンパク質であり、がん細胞では DNMT1 の過剰発現が知られています。DNMT1 単体は、DNA が結合できない自己阻害型の構造をとります。この解除にはユビキチン化されたヒストン H3 が関わりますが、どのような構造変化を伴って DNMT1 を活性化するのかはこれまで不明でした。私は、DNMT1 にユビキチン化ヒストン H3 と DNA が結合した3者複合体構造をクライオ電子顕微鏡で決定しました。この立体構造情報から、活性化のスイッチとなる触媒ドメインのトグルポケットに、約600残基離れた N 末端の Activating Helix が入り込むという、DNMT1 の新たな活性化機構を発見しました。さらに、in vitro と哺乳類細胞を用いた変異体解析から、Activating Helix のわずか2つのフェニルアラニン残基が DNMT1 の活性化に重要であることを明らかにしました。
今後は、発見した新規の活性制御部位をもとに DNMT1 阻害剤の開発を目指して研究を進めていきます。最後に、審査員の先生方をはじめ、日頃から熱心にご指導くださった有田恭平教授、構造生物学研究室の皆様、そして共同研究者の方々にこの場を借りて心より感謝申し上げます。
1P-028 長畑 直人(東京大学)

第23回蛋白質科学会年会においてポスター賞に選んでいただきありがとうございました。審査員の先生方をはじめとした学会関係者の皆様に、この場をお借りして感謝申し上げます。今回の受賞を励みに、今後も研究活動に勤しんでいく所存です。
原核生物の免疫機構にかかわる CRISPR-Cas9 はガイド RNA を用いて標的 DNA 配列を特異的に認識し、切断します。化膿レンサ球菌由来の Cas9(SpCas9)は高い DNA 切断活性をもつことから、ゲノム編集ツールとして応用されています。近年、Cas9 の進化的な祖先にあたるタンパク質として IscB が同定され、Cas9 と同様にガイド RNA を用いて標的 DNA を切断することが示されました。これまでに IscB や SpCas9 の立体構造が決定され、ガイド RNA 依存的な DNA 切断機構が解明されてきました。しかし、IscB と SpCas9 の立体構造は大きく異なっており、IscB から SpCas9 への進化の過程は不明でした。
本研究では、クライオ電子顕微鏡を用いた単粒子解析によって、IscB から SpCas9 への進化過程の中間体である II-D 型 Cas9 の立体構造を決定しました。IscB、SpCas9 との立体構造比較から、IscB から Cas9 へ進化する過程で、DNA 認識にかかわるガイド RNA の一部が段階的にタンパク質に置き換わったことを明らかにし、CRISPR-Cas9 の分子進化を可視化することに成功しました。
最後に、本研究を行うにあたりご指導いただいた西増教授をはじめとする西増研究室の方々に心より感謝申し上げます。
1P-049 村田 裕斗(名古屋大学)

この度はポスター賞をいただき大変光栄に思っています。審査員の先生方や、運営に尽力してくださった皆様、そして、日頃から研究に関する指導をしてくださっている千見寺浄慈助教、Leonard Chavas 教授、寺田智樹准教授をはじめとした研究室の方々に感謝を申し上げます。
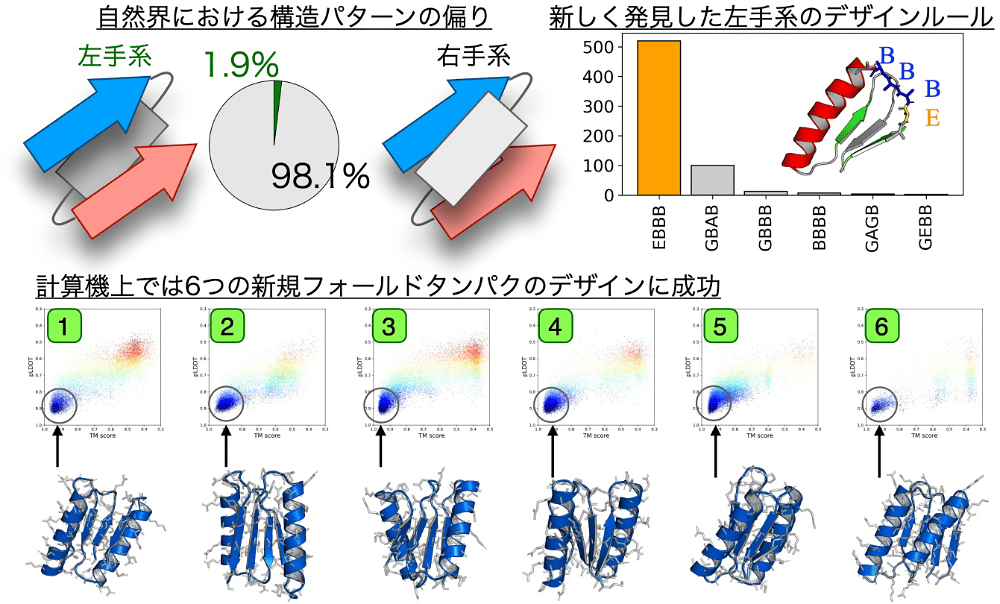
自然界に存在するタンパク質のフォールドの数は約1000種類程度であるということが広く信じられていますが、生物の進化は物理的に存在できるすべてのタンパク質のフォールド空間を探索しきれてはいないということがわかっています。
さらなるフォールド空間を探索するために、我々は、自然界にほとんど存在しない部分構造を用いたタンパク質デザイン手法の開発に取り組んでいます。
その一環として今回、左手系の βαβ モチーフを持つタンパク質のデザインについてポスター発表を行いました。
我々は、主鎖構造構築モデルの一つである Rosetta に幾何学的束縛がかかるようなポテンシャルを与えることで多くの左手系 βαβ モチーフを作成することに成功し、それらの特徴量を解析することでデザインルールを発見することができました。
このルールを用いて異なる6つの新規フォールドに関して計算機上でデザインを行ったところ、すべてのフォールドに関して信頼度の高いアミノ酸配列を得ることができました。
現在そのうちの1つのフォールドに関して実験が進んでおり、最終的には X 線による構造決定を行う予定です。
1P-065 宮崎 友輝(名古屋工業大学)

この度は第23回日本蛋白質科学会年会におきましてポスター賞を頂けたこと、大変光栄に思っております。審査員の先生方、そして本学会の開催にご尽力いただいた学会関係者の皆様に、この場をお借りして心より感謝申し上げます。
私の研究では、進化分子工学の力を駆使することで、「タグタンパク質―小分子リガンドペア」を人工創製することに挑戦しています。「タグタンパク質―小分子リガンドペア」とは、特定のリガンドとそれに特異的に結合することが可能なタンパク質のペアのことであり、既存のペアの代表例として、HaloTag/クロロアルカン1や SNAP-tag/ベンジルグアニン2、eDHFR(大腸菌ジヒドロ葉酸還元酵素)/トリメトプリム3などが挙げられます。機能を操作したいタンパク質に対してタグタンパク質を遺伝子工学的に融合することで、タグタンパク質を介して標的タンパク質の細胞内局在や二量体化を小分子リガンドで操作することが可能になります。この手法は、特定のリガンド化合物でさまざまなタンパク質の機能制御を可能にすることから、非常に魅力的なケミカルバイオロジーツールの1つとして注目されています。一方、既存の「タグタンパク質―小分子リガンドペア」にはいくつかの限界もあるのが現状です。まず、これまでに開発されてきたタグタンパク質は全て天然由来のタンパク質(もしくはその変異体)であるため、動物細胞内の生体分子には作用しない生体直交性の高い(かつ特異的リガンドが存在する)タンパク質を見つけ出すのは容易ではありません。そのため、動物細胞で使える有用なペアの種類は今なお非常に限られています。また、天然由来のタンパク質に特異的に結合する小分子リガンドの構造は厳密に決まっており、誘導化が難しい場合が多いです。そのため、既存のタグタンパク質用のリガンドを用途に合わせて機能化・誘導化するには大きな制限があるのが現状です。
このような状況を打破すべく、私たちは「タグタンパク質―小分子リガンドペア」の拡張のための新たな方法論を検討することにしました。私たちが今回提案するのは、「タグタンパク質―小分子リガンドペア」を従来のように天然から探し出すのではなく、進化分子工学を利用して “de novo 創製する” というものです。その概念実証のための実験として、今回私たちは、人工タンパク質の試験管内進化技術である TRAP 提示法4を用いることで、trans 型アゾベンゼンには結合せず、cis 型アゾベンゼン特異的に結合する人工抗体タグの創製に成功しました。非常にエキサイティングなことに、in vitro で取得した人工抗体タグは動物細胞内で安定に発現させることができ、さらに細胞内でもその結合特異性と十分な親和性を保持している(trans 型アゾベンゼンには結合せず、cis 型アゾベンゼン特異的に結合する)ことが示されました。本研究で私たちが提案・実証した “人工抗体の進化分子工学” というアプローチを利用すれば、さまざまな機能性リガンドとそれに特異的に結合する人工抗体タグのペアを自由に創製することが可能となり、細胞機能操作に有用なツールレパートリーを飛躍的に拡張できると期待しています。
本ポスターで発表した内容については、現在、論文投稿の準備を行なっています。今回取得した「人工抗体―cis 型アゾベンゼンペア」は光で結合と解離を繰り返し制御できるという特徴を持っています。現在私たちはこのユニークな特徴を活かし、細胞内で時空間的に制御された生命現象や情報伝達を光で自在に ON/OFF 操作可能な、新たなケモオプトジェネティクスツールの開発に取り組んでいます。年内にはケモオプトジェネティクスへの応用まで盛り込んだ論文を投稿する予定ですので、論文の完成を目指して引き続き頑張っていきたいと思います。
また、今回このような歴史と名誉ある大会でポスター賞を受賞できたことに大きな喜びを感じています。私自身は研究を始めてまだ一年ほどで、ポスター発表も初めての経験であったため、不安な点は少なからずありました。しかし、自分の研究について多くの先生方や他大学の学生さん達からさまざまな質問やコメントを頂き、近い距離感でディスカッションできることがとにかく楽しく、発表中はテンションが上がりっぱなしでした。その一方で、同時に今回の受賞によって、身の引き締まる思いを強く感じています。まだまだ私自身、研究者としては未熟ですので、今回の学会参加を通じて研究者としての更なる成長を決心する機会にもなりました。今後は、日々の研究活動に今まで以上により一層精進することはもちろんのこと、蛋白質工学とケミカルバイオロジーの融合による新たなブレイクスルーを実現する研究を目指し、挑戦と努力を日々積み重ねていきたいと思います。
最後になりますが、日々の研究活動のご指導をいただく築地真也先生、共同研究者である名古屋大学の村上裕先生、そして本研究にご協力いただいた全ての関係者の方々に、この場をお借りして心より感謝申し上げます。
- Georgyi V. Los et al., ACS. Chem. Biol., 2008, 3, 6, 373–382.
- A. Keppler et al., Nat. Biotechnol., 2003, 21, 86–89.
- N. T. Calloway et al., ChemBioChem., 2007, 8, 767–774.
- T. Ishizawa et al., J. Am. Chem. Soc., 2013, 135, 5433–5440.
1P-090 武井 梓穂(北海道大学)

この度は、2023年度 第23回日本蛋白質科学会年会におきまして、このような栄誉ある賞を頂戴し大変光栄に思っております。
日々の研究活動を熱心にご指導していただいている北海道大学 生命科学院 構造生物化学研究室 尾瀬農之教授、姚閔名誉教授へこの場をお借りして深くお礼を申し上げます。また、夢中で研究に打ち込むことを応援してくれている父や母、そして日々切磋琢磨し合う構造生物化学研究室のメンバーの皆様にも感謝を申し上げます。
乳がんは日本人女性の癌部位別罹患数の1位であり、現代日本において非常に深刻な疾患の一つです。乳がんの新規治療法開発のためにもがん増悪化の分子メカニズムを理解することは重要と考え、乳がん特異的なキナーゼに関する研究に取り組んでおります。本会では、乳がんで特異的に発現するキナーゼと、キナーゼの活性制御に関わるアダプター分子の活性解析並びに相互作用解析についての研究結果をご報告させていただきました。
審査員の方々をはじめ、蛋白質科学に造詣深い多くの先生方と議論ができましたこと、またさまざまな研究アドバイスをいただくことができ、大変嬉しい3日間となりました。皆様ありがとうございました。この研究成果を1日でも早く世に出せますよう、北の地でまた研究に励みたいと思います。
今年度の蛋白質科学会では多くの素敵な研究者の皆様とお会いできたことが印象的です。特に、第3回 蛋白質科学会若手の会 研究交流会は刺激的な体験でした。全国の若手研究者の皆様と学会0日目から交流を深められたことで、今までにない新たな繋がりを得ることができました。黙々と大腸菌に向き合うことも大切ですが、全国どこかで同年代の誰かが頑張っていると思うと、より一層の励みになるかと思います。この場をお借りして、若手の会開催に尽力してくださった関係者の皆様に感謝を申し上げます。
来年度の蛋白質科学会は北海道・札幌開催です。北海道といえば、うに・ほたてなどの海鮮、とうもろこし・アスパラガスなどの野菜、なんといってもサッポロクラシック!是非是非お越しいただき、みなさんと乾杯できる日を楽しみにしております!
2P-011 福永 彩美(東京大学)

この度は第23回日本蛋白質科学会年会におきましてポスター賞をいただき、大変光栄に存じます。この場をお借りして、審査員の先生方はじめ学会関係者の皆様に感謝申し上げます。
私はタンパク質一分子の理解に留まらず、そのタンパク質が制御する多様な生命現象の謎に迫れる研究をしたいと考えています。現在取り組んでいるGタンパク質共役型受容体(GPCR)の研究では、構造解析を通じて分子レベルで機能に関わる重要な構造的特徴の理解をし、更にその構造をもとに機能の解析を行うことで、このタンパク質が関わる生命現象の謎の解明に向けて一歩前進することができました。構造生物学的な観点でタンパク質を捉えるだけでなく生命現象の理解まで目指すことは常に新しい技術の習得を必要としますが、分野の枠に捉われないとても夢のある研究で、日々実験に没頭しています。
今回の発表では、ポスター賞というかたちで本研究を評価していただき、大変嬉しく思っております。また大変多くの方と研究内容を議論することができ、今後の研究の発展に期待が膨らみました。今後はこの経験を糧に、更に研究に邁進する所存です。
最後に、ご指導いただいております加藤英明先生をはじめとした加藤研究室の皆様、関係者の方々に心より感謝申し上げます。
2P-029 片岡 万知華(兵庫県立大学)

この度は第23回日本蛋白質科学会年会ポスター賞をいただくことができ、大変光栄に存じます。
私はクライオ電子顕微鏡を用いた病原菌由来ヘムトランスポーターの構造解析をおこなっています。ヘムトランスポーターは ABC トランスポーターファミリーに属し、ATP の加水分解を駆動力にしてヘムの膜輸送を担っています。これまでに X 線結晶構造解析では細胞質側のゲートが開いたアポ型構造を得ていましたが、輸送サイクル中の他の状態の結晶化がうまくできませんでした。私たちはクライオ電子顕微鏡を用いて輸送の各状態のスナップショットを得ることで、ヘムの膜輸送メカニズムを明らかにすることを目指しています。ポスター発表では結晶構造とクライオ電子顕微鏡で解析した4つの状態を報告しました。予想とは異なり、ATP アナログ結合状態でペリプラズム側と細胞質側の両方のゲートが閉じた「閉塞型」の構造を得たことから、新たなヘム輸送メカニズムを提案しました。本賞を励みに、ヘム結合型の構造取得に向けて今後とも研究に邁進してまいります。
最後になりましたが、日々指導していただいております杉本宏先生、Chai Gopalasingam 先生、Christoph Gerle 先生、研究室関係者の皆様に感謝申し上げます。
2P-064 杉浦 雅大(名古屋工業大学)

この度は第23回日本蛋白質科学会年会よりポスター賞を賜りましたこと、大変光栄に存じます。また、審査員の先生方はじめ学会関係者の皆様には、この場をお借りして心より御礼申し上げます。
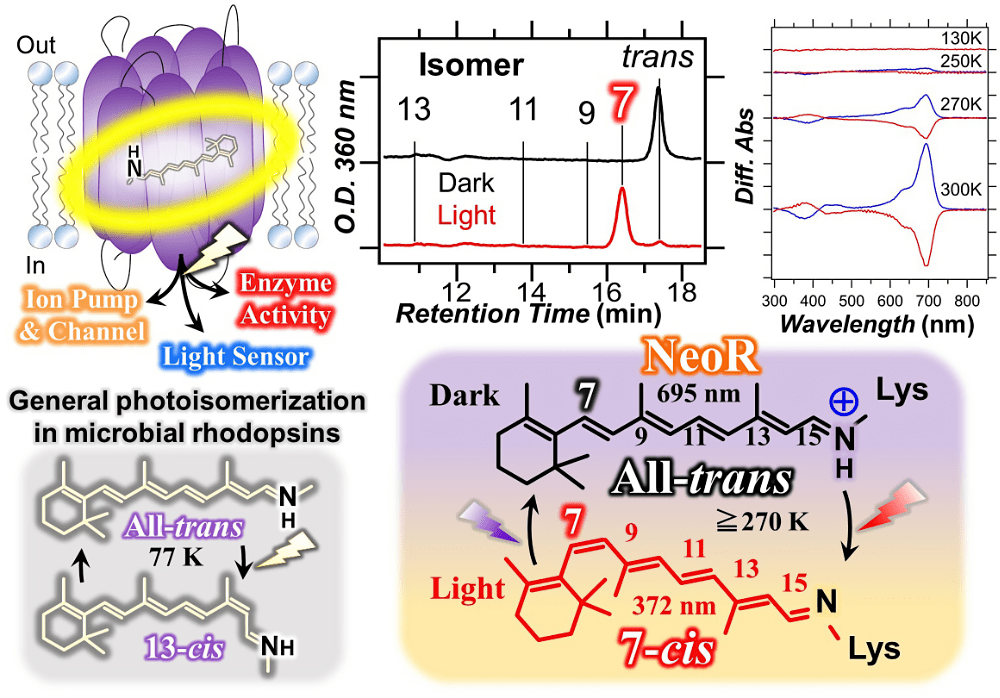
ロドプシンは発色団としてレチナールを結合する光受容膜タンパク質として知られており、その光応答はレチナールの光異性化反応によってスタートします。そのため、レチナール光異性化の研究は50年以上の歴史を持ち、微生物ロドプシンでは全トランス型から13シス型へと異性化することが明らかとなっています。また、その異性化反応がマイナス200度の低温でも起こることもロドプシンに共通した特徴でした。
本研究では、水生真菌から発見された近赤外光吸収酵素ロドプシン(NeoR)に着目し、その光反応を調べました。すると、近赤外光照射により生成した異性体は微生物ロドプシンではこれまでに見られなかった異性化状態をとることが明らかとなりました。そこで、この異性体の構造を NMR 法で調べ、この光産物が7シス型であることを明らかにしました。次に光反応の性質を調べるため、温度を下げて近赤外光を照射したところ、マイナス3度でも室温の半分しか反応せず、それ以下の温度では光反応は全く見られませんでした。これは高い反応の障壁が存在することを示しており、有機溶媒中では不安定な7シス型への異性化という特異な光反応の性質とよく対応します。
本研究は、タンパク質分子の中で起こる「特異な7シス型への光異性化」「低温で反応しない」といった基礎研究の観点だけでなく、応用研究の観点からも注目されます。NeoR は、細胞内シグナル伝達物質の濃度を制御することができるため、生命科学に革新をもたらした新技術である光遺伝学へのツール応用も期待されます。特に、光遺伝学では生体毒性が低い赤色光での活性化が好まれるため、近赤外光が利用できる点はツールとして有望かもしれません。
最後に、今回初めて行った NMR 測定は、光を当てることができなかったため、名古屋工業大学教授の柴田先生にご意見をいただき、准教授の住井先生には真夜中の実験に同行していただきました。カナダの Guelph 大学教授の Leonid S. Brown 先生には遺伝子情報をいただくとともに有意義なご意見をいただきました。深く感謝いたします。また、ご指導・ご鞭撻を賜った指導担当の先生方をはじめ、研究室の仲間、関係者の方々にも深く感謝いたします。
https://pubs.acs.org/doi/10.1021/acs.jpclett.2c02334
2P-068 池田 刀麻(東京工業大学)

第23回日本蛋白質科学会にてポスター賞を賜りましたこと、大変光栄に存じます。また、学会関係者の皆様、ご指導いただいております田口教授をはじめ研究室の皆様に感謝申し上げます。
ポスター発表では一つのアミノ酸配列から一つの立体構造が一義に決まるという蛋白質科学の基本原理(アンフィンゼンのドグマ)に合わないような二つの相互変換可能な立体構造を持つタンパク質について報告いたしました。天然ではこのような性質を持つタンパク質がこれまでに複数報告されています。しかし、その人工的な設計や二つの立体構造の制御については明らかになっていません。
本研究では、機能や構造が全く異なる二つのタンパク質の末端の領域を重複して融合することによって、二つの立体構造を持つタンパク質を実現しました。設計したタンパク質は N 末端側のタンパク質領域が重複した領域を取りこんだ構造と C 末端側が取り込んだ構造の二つの構造を持つと期待されます。
精製タンパク質を用いた機能解析と分解耐性の実験から設計タンパク質は二つの立体構造を持つことが明らかになりました。またその立体構造の制御にも取り組み、アミノ酸変異やリガンドによってその二つの立体構造を制御できることも明らかにしました。
今後も通常のアンフィンゼンのドグマを超える複数の異なる立体構造を持つタンパク質の解明とその立体構造の制御についての研究に取り組んでいきます。
2P-087 今浦 稜太(広島大学)

この度は第23回日本蛋白質科学会にてポスター賞を頂き、大変光栄に思います。
審査員の先生方をはじめ、学会関係者の皆様に深く御礼申し上げます。
パーキンソン病やレビー小体型認知症では、αシヌクレイン(αS)が神経細胞内の膜と相互作用した後にアミロイド線維を形成し、神経細胞死を引き起こすと知られています。また細胞内に普遍的に存在する NaCl などの塩の有無や濃度が膜結合構造やアミロイド線維形成に強く影響するとの報告がされていますが、その詳細については未解明でした。
本研究では、放射光真空紫外円二色性(VUVCD)法と MD simulation から、線維形成に重要な領域として考えられている NAC 領域を含むペプチド(αS57–102)の構造変化を解析し、塩の効果による結合構造と膜相互作用の違いについて報告しました。塩の有無で αS57–102 の構造変化経路と膜結合構造が異なり、線維形成に影響すると考えられる中間構造の存在を見出すことが出来ました。
この受賞を励みに、これからも研究に邁進していきたいと思います。
最後になりましたが、日頃からご指導いただいている松尾光一准教授をはじめ、広島大学放射光科学研究センター(HiSOR)の皆様に厚く御礼申し上げます。
2P-115 住川 太一(東京大学)

この度は第23回⽇本蛋⽩質科学会年会にてポスター賞を賜り、⼤変光栄に存じます。学会関係者の皆様、そして津本浩平先⽣をはじめとしてご指導いただいております津本研究室の皆様に、この場をお借りして厚く御礼申し上げます。
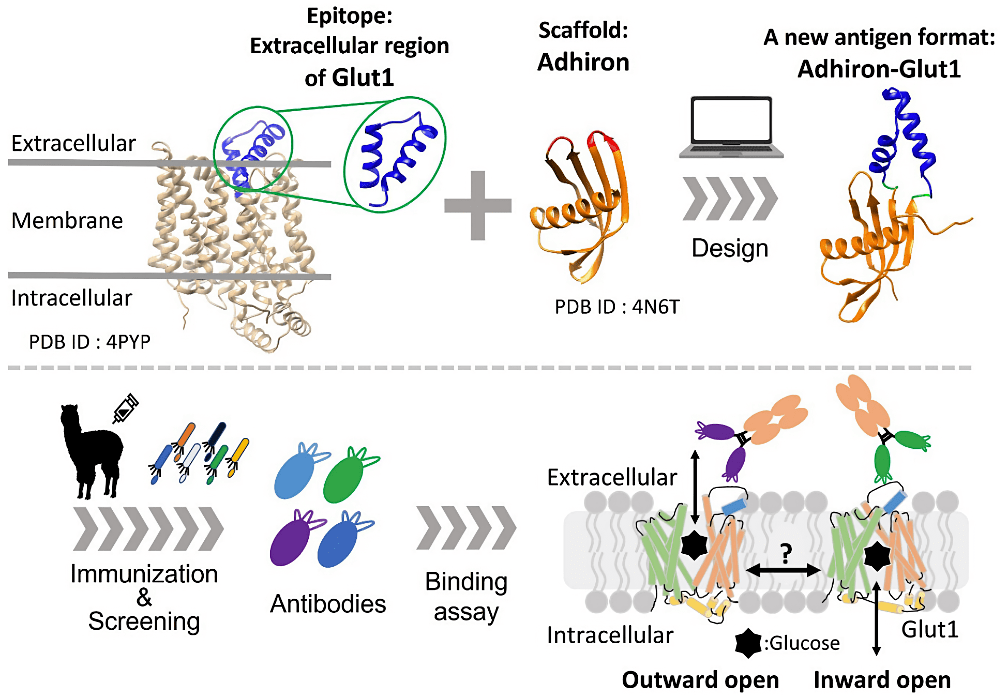
ポスター発表では、膜蛋⽩質 Glut1 の動態解明を指向した細胞外領域を認識する新規抗体取得系の提案について報告いたしました。膜蛋⽩質 Glut1 は、動的なコンフォメーション変化により基質であるグルコースを輸送していることが知られていますが、実際に細胞膜上における動態は明らかになっておりません。そこで本研究では、膜蛋⽩質 Glut1 の動態解明を⽬指し、コンフォメーションの違いを認識できる抗体分⼦の取得を試みました。⼀般に、細胞外領域の⼩さい膜蛋⽩質は、その免疫抗原としての調製の難しさから、抗体取得が困難だと⾔われています。本発表では、膜蛋⽩質のエピトープ部分の構造に着⽬し、⾜場蛋⽩質にエピトープ部分を移植した新しい免疫抗原を計算科学的⼿法を⽤いて設計することで、細胞膜上の Glut1 を認識する抗体取得に成功いたしました。
今後は、取得した抗体を⽤いて Glut1 の⽣細胞上での動態解明に迫ります。本研究について⾮常に有意義な議論をさせていただきましたこと、重ねて感謝申し上げます。
2P-117 佐藤 那音(東京大学)

この度は第23回蛋白質科学会年会におきまして、ポスター賞をいただき、大変光栄に存じます。
タンパク質間相互作用は、創薬標的として注目されていますが、一般に広く浅い相互作用面を持つため、低分子化合物では十分な阻害が困難であり、ペプチドを用いた阻害剤開発が有望視されています。私たちはこれまでに、白血病などの疾患に関わるタンパク質が持つ2カ所の標的分子結合部位それぞれに対するペプチド阻害剤を開発してきました。本研究では、2つの阻害剤を繋ぐリンカーを合理的に設計し、2カ所の結合部位を同時に阻害可能なキメラペプチド阻害剤の開発を目指しました。Rosetta・ProteinMPNN・AlphaFold2 などのソフトウェアを用いて、鋳型構造の作製・リンカーのアミノ酸配列設計・In silico 評価を行い、最も評価の高かった配列について実験による検証を行った結果、疾患に関わるタンパク質への結合親和性が大幅に向上したキメラペプチドが得られました。今後はさらなる機能向上を目指して研究を進めてまいります。
最後に、ご指導を賜りました新井宗仁教授をはじめ、研究室の皆様、学会関係者の皆様にこの場をお借りして厚く御礼申し上げます。
