本年度第23回日本蛋白質科学会年会(名古屋)における若手奨励賞受賞者の方から原稿をいただきましたのでここにお知らせします(演題番号順)。
日本蛋白質科学会 役員会
若手奨励賞 10名
YSA-01 杉田 昌岳(東京工業大学)

この度は第23回日本蛋白質科学会年会にて若手奨励賞をいただき大変光栄に存じます。ご選出くださった審査員の皆様、本研究の共著者の皆様、共同研究者の皆さまへ心より感謝申し上げます。
受賞対象となった研究は、環状ペプチドの膜透過メカニズムを明らかにするための分子動力学シミュレーションプロトコルを作成し、そのプロトコルに基づいて多数のペプチドの膜透過過程を解析したものです。分子動力学シミュレーションは分子の動きを実際に見ることができる有用なツールではありますが、非常に限られた数の分子の限られた時間の運動のみしか再現することが出来ないため、ともすると非現実的な挙動を見ることになってしまいます。今回の研究ではペプチドの遅い運動をサンプリング可能な手法の導入に加え、膜のモデルを POPC とコレステロールの混合膜にしたことで、膜透過時にペプチドがほぼ完全に脱水和される実験と矛盾の無いデータが得られるようになりました。
膜透過可能なペプチドを合理的に設計することが可能となれば、細胞内の標的を特異的に阻害可能な新薬を効率よく開発することが可能となります。その目標へ向けて、より詳細なメカニズムの解析と、まだシミュレーションで解析ができていない現象を再現する努力を続けていく予定です。
YSA-02 但馬 聖也(東京大学)

この度は第23回日本蛋白質科学会年会にて若手奨励賞をいただき大変光栄に思います。
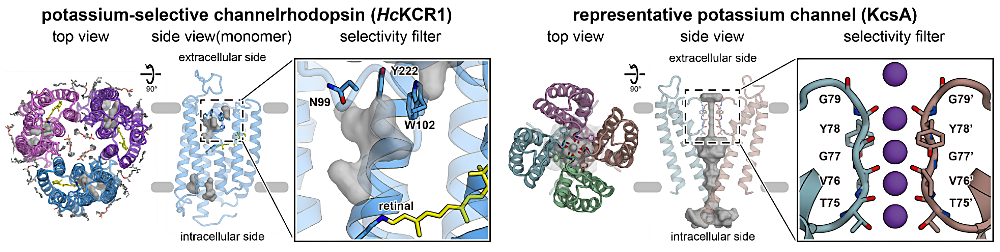
本研究では、カリウムを選択的に輸送する光駆動型のイオンチャネルであるカリウムチャネルロドプシン(KCR)の立体構造をクライオ電子顕微鏡より決定し、従来のカリウムチャネルと異なる新奇のカリウム選択機構を解明致しました。
2021年初めてカリウムに対して高い選択性を示すチャネルロドプシンである KCR が発見されました。KCR 発見以前に報告された陽イオンを輸送するチャネルロドプシンはすべて非選択的にカチオンを輸送するのに対し、今回構造決定された KCR は細胞外側の選択フィルターによってカリウムの選択的な輸送を実現していることが判明しました。KCR の選択フィルターは KcsA をはじめとする従来のカリウムチャネルの選択フィルターと異なり非対称的でモノマー内の三残基より構成され、KCR はユニークなカリウム選択機構を有することが明らかとなりました。
本研究を行うにあたりご指導いただいた加藤英明准教授、福田特任助教をはじめとする研究室の皆様及び多大なるご支援を賜りました共同研究者の方々に心より感謝申し上げます。これからも光によって様々な機能を示すロドプシンの不思議と可能性を探求していきたいです。
YSA-03 髙田 咲良(慶應義塾大学)

この度は2023年度の日本蛋白質科学会若手奨励賞をいただき、大変光栄に存じます。
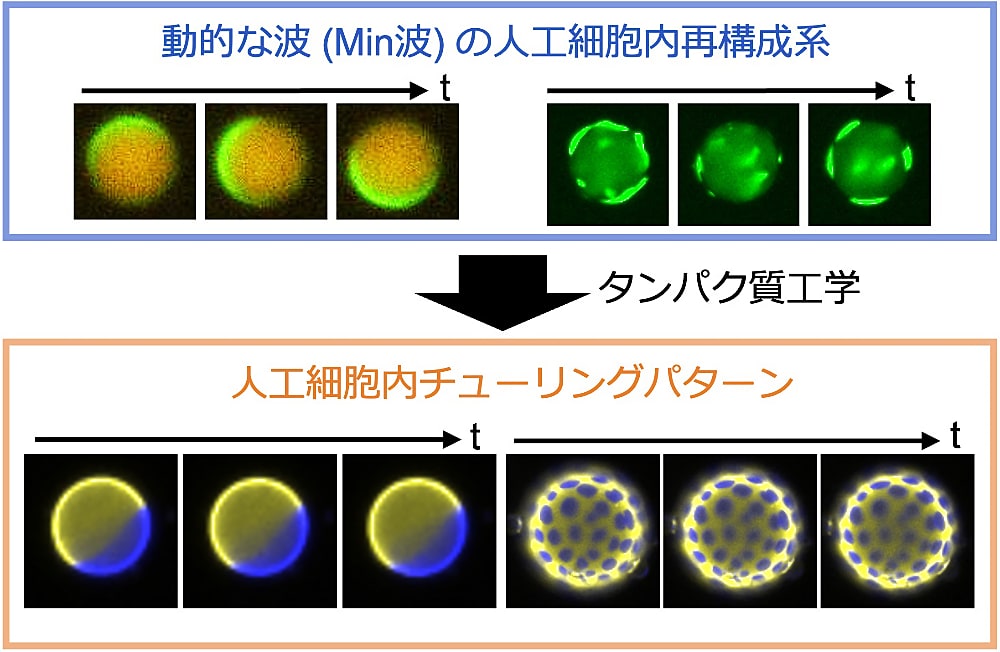
細胞の分裂位置やタイミング、極性などを制御するためには分子がどこに存在するか(分子配置)が重要です。このような細胞内の分子配置は、単純な分子間相互作用だけではなく、分子集団としての物理現象(反応拡散共役)により形成されることが明らかになってきています。私はこの反応拡散共役に基づく分子配置の形成原理について、精製タンパク質のみを内包した人工細胞内再構成系を用いることで研究しています。
反応拡散共役では、波のように動く集団運動や、その場にとどまっているように見える静的な構造が形成されますが、静的なパターンは細胞サイズの空間で形成可能かどうかは明らかではありませんでした。本研究では、以前に構築された動的な波(バクテリアの Min 波)の人工細胞内再構成系をタンパク質工学的に改変し、反応拡散共役に基づく静的なパターンの人工細胞内創成に成功しました。このパターンは空間周期性や非平衡性など、動物の体表で見られるチューリングパターンの性質を全て満たしました。この成果は、チューリングパターンが細胞内の静的な分子配置の形成原理として存在しうることを実証するものです。
研究を行うにあたりご指導いただいた藤原准教授(慶應大)、共同研究者の義永准教授(東北大)、そして土居教授(慶應大)を含むお世話になっている方々に心より感謝申し上げます。
YSA-04 小菅 啓史(東京大学)

この度は2023年度の日本蛋白質科学会若手奨励賞を頂き、大変光栄に存じます。
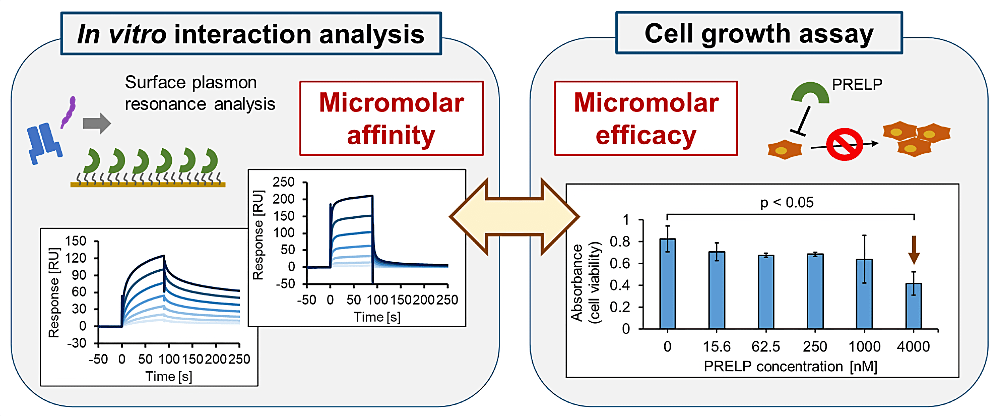
私は腫瘍抑制蛋白質 PRELP の多重特異的相互作用に着目して研究を進めております。PRELP は細胞外環境において複数のサイトカインや受容体と結合する分泌蛋白質であり、最近になって PRELP によるがん細胞の増殖抑制作用が注目されつつあります。本研究では、PRELP の多重特異的相互作用に基づく腫瘍抑制メカニズムの解明を目指した研究を展開してきました。プロテオミクス解析により IGFI-R や p75NTR をはじめとした複数の PRELP の新規相互作用蛋白質を発見し、組換え蛋白質を用いた物理化学的解析と細胞アッセイを組み合わせることで、PRELP が µM 程度の比較的弱い親和性でこれらの標的蛋白質と多重特異的に相互作用することで機能を発揮していることがわかってきました。さらに現在では、蛋白質科学に基づき PRELP がどのようにして多重特異性を創出しているのかを紐解きつつ、バイオロジーの観点から細胞外マトリクスへの局在に伴う PRELP の弱い多重特異的相互作用の制御システム解明を目指して研究を進めています。
本研究の遂行にあたりご指導いただいた津本浩平教授をはじめとした東京大学津本研究室の皆様と、バイオシス・テクノロジーズ株式会社の板東泰彦様、福田哲也様をはじめとした共同研究者の皆様に心より感謝申し上げます。
YSA-05 宗 正智(奈良県立医科大学、リーズ大学)

この度は2023年度日本蛋白質科学会若手奨励賞をいただき大変光栄に存じます。
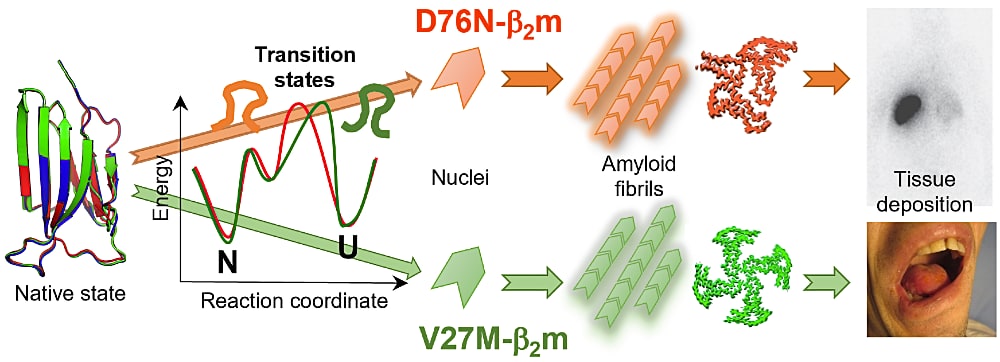
私の研究は、蛋白質の異常凝集であるアミロイド線維の構造多型と病態の関連および構造多型を生み出すメカニズムの解明です。β2-ミクログロブリンが作るアミロイド線維は透析アミロイドーシスの原因として長年研究されてきたが、近年では遺伝性で異なる疾患に関わる変異体が見つかってきています。私は、透析アミロイドーシスに関連する V27M と全身性アミロイドーシスに関連する D76N を比較し、それらの物理化学的な特徴づけをおこないました。これらの変異体蛋白質のアミロイド線維のクライオ電子顕微鏡構造は、モノマーユニットの構造はほぼ同じでしたが、フィラメント間の相互作用が異なり、高次的な線維の形態が異なっていました。この構造多型を生み出す要因として、生理条件下でのアミロイド形成速度とアンフォールディングの遷移状態の違いを見出し、アミロイド線維の一次核形成を変化させ、異なる組織への沈着や病気の発症を変化させる要因の解明へとつながる成果を得ました。これらの変異体アミロイド沈着の組織特異性の要因を突き止め、発症機構の全容を解明すべく今後も研究を進めてまいります。
本研究を遂行するにあたり、イギリス・リーズ大学 Sheena Radford 教授と研究室のメンバー、信州大学矢﨑正英教授、大阪大学後藤祐児教授をはじめ多くの方々にご支援、ご協力いただきました。また、留学を支援していただいた中谷医工計測技術振興財団に深くお礼申し上げます。
YSA-06 小林 穂高(JST さきがけ)

このたびは歴史ある日本蛋白質科学会から若手奨励賞をいただき、誠にありがとうございます。若手奨励賞シンポジウムにおいては若手奨励賞優秀賞までいただき、大変光栄であると共に、背筋が伸びる思いです。審査をしてくださった先生方をはじめ、蛋白質科学会の関係各位の先生方に、心よりお礼申し上げます。
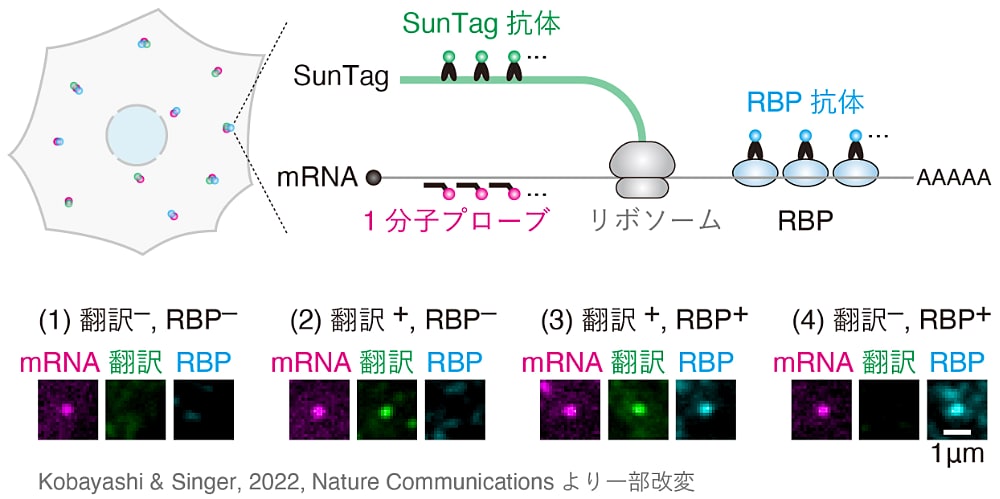
本研究では「蛋白質合成の制御過程を細胞内1分子イメージングで見る」ことに挑戦しました。あらゆる生命現象の担い手である蛋白質は、mRNA がリボソームによって蛋白質へと翻訳されることで合成されます。その重要性ゆえに、蛋白質合成の制御過程を明らかにするべく、長年にわたり精力的に研究が行われてきました。ですが、実はその大部分は生化学的なアプローチ(例えば、細胞のライセートを試験管内で解析するような手法)によるものです。そのため、蛋白質合成の制御過程がどういった因子によってどのように実行されるのかという「How, Who, Whom」については理解が進んでいる一方で、それが細胞内において一体いつどこで実行されるのかという「When, Where」については驚くほど明らかでありません。そこで本研究では、蛋白質合成の制御過程を細胞内において1分子レベルで見ることができる独自の新規イメージング技術(図参照)により、その謎多き時空間的な側面に光をあてました。興味を持っていただけた方は、Kobayashi & Singer, 2022, Nature Communications もご覧いただけますと幸いです。
本研究を行うにあたり、いつも大らかな心で自由に伸び伸びと研究をさせてくれた Robert H Singer 教授(Albert Einstein College of Medicine および HHMI Janelia Research Campus)には、この場をお借りして心からの感謝を申し上げます。このたびの若手奨励賞/若手奨励賞優秀賞を励みに、今後さらに面白い研究をすることで、蛋白質科学会に少しでも恩返しができればと考えておりますので、みなさま今後ともどうぞよろしくお願いいたします。
YSA-07 中島 吉太郎(大阪大学)

この度は、第23回年会において若手奨励賞をいただき、大変光栄に存じます。
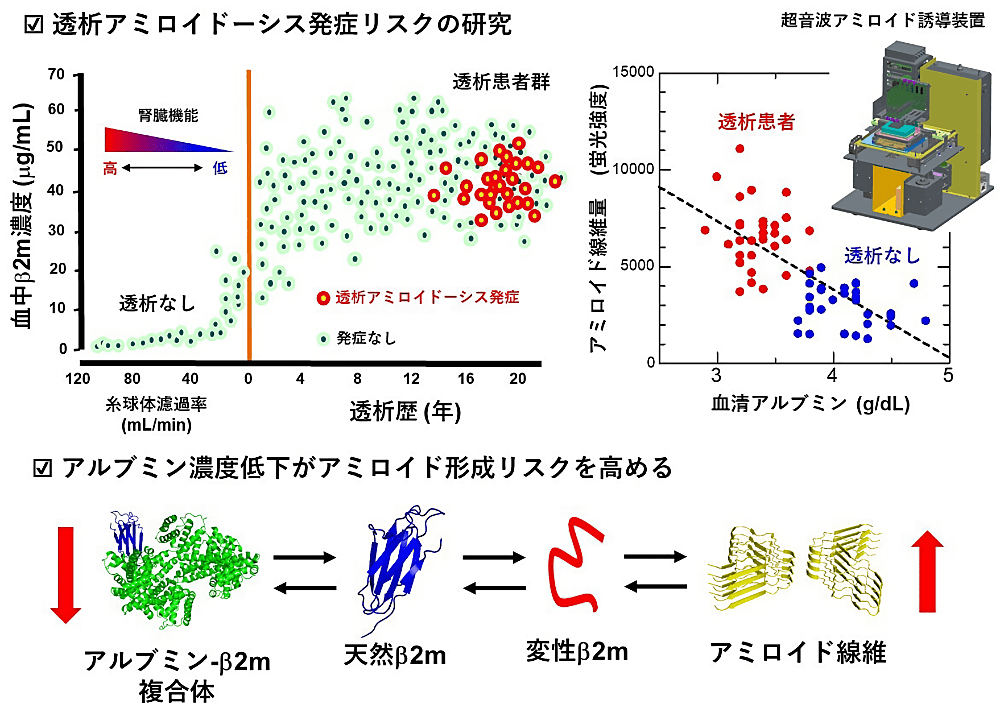
本研究では、長期透析患者に特異的に発症する透析アミロイドーシスの発症機構を研究することを通して、生体内におけるアミロイド線維形成反応に影響を及ぼす因子を特定し、アミロイドーシスの発症機構の一端を解明することを目指しました。研究においては、独自に開発を進めている超音波アミロイド誘導装置を用いて、透析患者から採取した血清検体が透析アミロイドーシスの原因蛋白質である β2 ミクログロブリン(β2m)の線維形成反応に及ぼす影響を実験的に研究しました。実験結果から、血清成分を β2m モノマー溶液に添加することにより β2m のアミロイド線維形成反応は抑制されますが、透析患者由来の血清は健常者の血清と比して、アミロイド線維を阻害する能力が低下することが示唆されました。さらに解析を進めると、血清環境中の血清アルブミン濃度の低下が生体内でのアミロイド線維形成反応のリスクとなり、アミロイドーシスの発症リスクとなりうることを新たに発見しました。そして、血清アルブミンの阻害効果を組み込んだアミロイドーシス発症予測のための理論モデルを提案しました。これらの研究結果とアミロイド線維形成反応が自己触媒的に進行することを鑑みると、アミロイドーシスを根絶するためには、生体内のアミロイド線維形成に対する防御機構をよく理解し、加齢とともに起こる機能低下を防ぎ、アミロイドの核形成を妨げることが必須であると改めて痛感しました。
最後になりますが、日ごろからご指導賜っております後藤祐児先生(大阪大学)、山本卓先生(新潟大学)、共同研究者の山口圭一先生(大阪大学)、野地真広先生(京都大学)に感謝申し上げます。また、現所属の大阪大学大学院工学研究科量子計測領域(荻研究室)の荻博次先生と研究室の皆様、マイクロソノケミストリー共同研究講座の松田洋和さん(株式会社ダイセル)と永松信二さん(株式会社ダイセル)に感謝いたします。これからもアミロイドーシスの根絶に向けた研究に貢献することを目指し、より一層研究活動に励みたいと思います。
YSA-08 田中 達基(東京大学)

この度は日本蛋白質科学会若手奨励賞をいただき大変光栄に存じます。
クリプト藻由来のカチオンチャネルロドプシン GtCCR4 は2017年に名古屋工業大学・神取研究室によって報告され、その光感受性の高さ、不活化の小ささから新たな光遺伝学ツールおよび網膜色素変性症に対する遺伝子治療薬として研究されています。GtCCR4 はチャネルロドプシン-2と比べ30倍ほど高い光感受性を持ちますが、その理由はその量子効率やチャネル開時間では説明できませんでした。そのため我々は光感受性の低い GtCCR2 と高い GtCCR4 の構造を決定し、比較することでその高感度光感受機構を明らかにしようと試みました。
弊研究室において GtCCR4 の X 線結晶構造解析には2018年から取り組まれていましたが、今回クライオ電子顕微鏡および人工脂質二重膜 nanodisc を用いることで構造決定に成功しました。その結果、我々は基底状態の GtCCR4 において6番目の膜貫通領域の細胞内側が大きく折れ曲がった新規構造を明らかにしました。また構造および赤外分光実験の結果から、GtCCR4 はこの新規構造をとることによって活性化に伴った主鎖の構造変化が小さいことが示唆されました。我々はこの機構が GtCCR4 の高感度を生んでいるとの仮説を立て、研究を進めています。
本研究を行うにあたり、濡木教授、志甫谷助教をはじめとした東京大学・濡木研究室の方々、神取教授、細島特任助教をはじめとした名古屋工業大学・神取研究室の方々に大変お世話になりました。この場を借りて御礼申し上げます。
また、当年会では蛋白質科学会若手の会代表として若手研究交流会を主催させていただき、盛況のうちに終えることができました。若手育成担当の先生方、運営スタッフの皆様、そして参加してくださった若手研究者の皆様に深くお礼申し上げます。
YSA-09 金村 進吾(関西学院大学)

この度は若手奨励賞をいただき、大変光栄に思っております。
哺乳動物細胞の小胞体では20種類以上の Protein Disulfide Isomerase(PDI)ファミリー酵素が存在しており、基質タンパク質のジスルフィド結合形成を伴った立体構造形成反応(酸化的フォールディング)を触媒します。一方で、いくつかの PDI ファミリー酵素は血中や細胞表面に存在していることが明らかになりつつありますが、細胞外における酵素の機能の多くはわかっていませんでした。我々は本研究において細胞外 PDI ファミリー酵素の新たな機能として抗ウイルス活性機能を明らかにしました。実際には、細胞外PDIファミリー酵素は新型コロナウイルス感染症の原因ウイルス SARS-CoV-2 のスパイクタンパク質 Receptor Binding Domain(RBD)のジスルフィド結合を還元し構造崩壊(還元的アンフォールディング)させることで、ウイルス感染を阻害していることがわかりました。また、細胞外PDIファミリー酵素は SARS-CoV-2 のバリアントであるデルタ株、オミクロン株の還元的アンフォールディングを触媒し、それらウイルスの感染をも抑制することがわかりました。本成果は、レドックスを介した生体防御システムの理解及び、様々なウイルスに対峙する創薬研究への展開が期待されます。
最後に、本研究に多大なご協力をいただきました奥村正樹准教授(東北大学)、高山和雄講師(京都大学)、齋尾智英教授(徳島大学)、李映昊教授(KBSI)、松﨑元紀助教(徳島大学)、馬渕拓哉助教(東北大学)、橋本里菜博士(京都大学)、渡部マイ氏(東北大学)および、山口研究室(関西学院大学)の皆様に心より感謝申し上げます。
YSA-10 氷見山 幹基(産業技術総合研究所)

第23回日本蛋白質科学会年会において若手奨励賞を頂き、大変光栄に存じます。
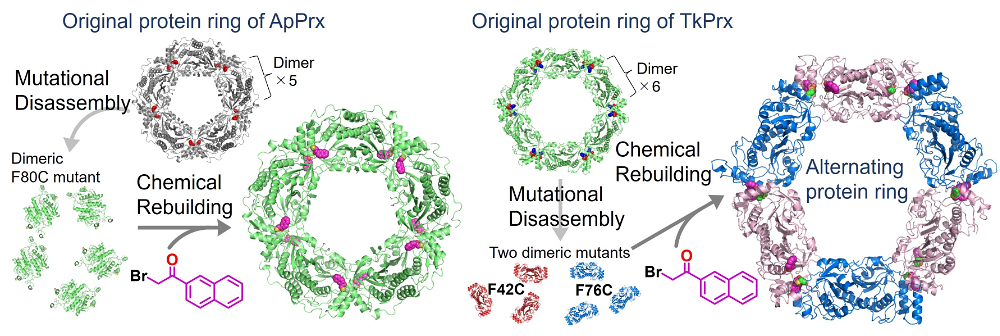
受賞対象となった研究では、二量体を複数集積した環状の四次構造を有するペルオキシレドキシンの集合形態を、化学修飾で制御する手法を開発しました。二量体界面のフェニルアラニンをシステインに置換すると、二量体間で生じていた疎水性相互作用が失われて、環状四次構造が二量体に解離します。ここに化学修飾でナフタレン環などの芳香環を付加すると、相互作用が再生し、環状構造を再構築できます。この Scrap and build のアプローチにより、二種類の変異体を交互に並べた人工的な集合体の構築にも成功しました。この研究に携わる前は、有機合成化学的に得られる分子と比較してタンパク質は分子と言うにはあまりに巨大かつ複雑で、簡単に構造や集合形態を変えられるものではないと考えていました。しかし、本研究を通して意外にもタンパク質が素直な挙動を示すことを発見し、分子としての制御可能性にワクワクしました。化学修飾により、20種類のアミノ酸残基のレパートリーを超えて、自在な形状と機能を持った部位をタンパク質に導入可能です。今後も生体分子と人工分子を組み合わせて新たな材料を創製することを目指して研究に邁進していく所存です。
本研究を遂行するにあたり、共同研究者の方々に大変お世話になりました。また、審査員の先生方をはじめとした学会関係者の皆様に、この場を借りて厚く御礼申し上げます。