本年度第22回日本蛋白質科学会年会(つくば)における学生口頭発表賞受賞者の方から原稿をいただきましたのでここにお知らせします(演題番号順)。
日本蛋白質科学会 役員会
SO1-04 仲 絢香(神戸大学)

この度は学生口頭発表賞を頂くことができ、大変嬉しく思います。この場をお借りして審査員の先生方をはじめとした学会関係者の皆様に心より感謝申し上げます。
口頭発表では、ABC トランスポーター BhuUV-T の二重スピンラベル ESR 分光法による構造変化の解析について報告させて頂きました。ABC トランスポーターは ATP 依存的な膜輸送を行う膜タンパク質です。本研究では、基質のヘムが紫外・可視光領域に吸収を持つことで基質移動を追跡できる、ヘムインポーターの BhuUV-T の構造変化を解析することにより、基質移動と構造変化の相関関係を調べることを目標としております。ペリプラズム側・細胞質側のそれぞれに部位特異的にスピンラベルを化学修飾し、その運動性やそれを取り巻く環境の極性の変化を調べると、ペリプラズムに遊離するヘムを BhuUV に運搬してくる BhuT、あるいは ATP の結合により BhuUV の構造変化が誘起されることが分かりました。今後は2つのスピンラベルの間の距離を測定することで詳細な構造を明らかにしたいと考えています。
最後となりますが、日々研究のご指導をいただいております木村先生、共同研究の先生方、研究室の皆様に感謝申し上げます。
SO1-06 横尾 尚典(東京大学)

この度は第22回日本蛋白質科学会にて学生口頭発表賞を頂くことができ、大変光栄に思っております。審査員の先生方をはじめとした学会関係者の皆様、指導頂きました先生方にこの場をお借りして感謝申し上げます。
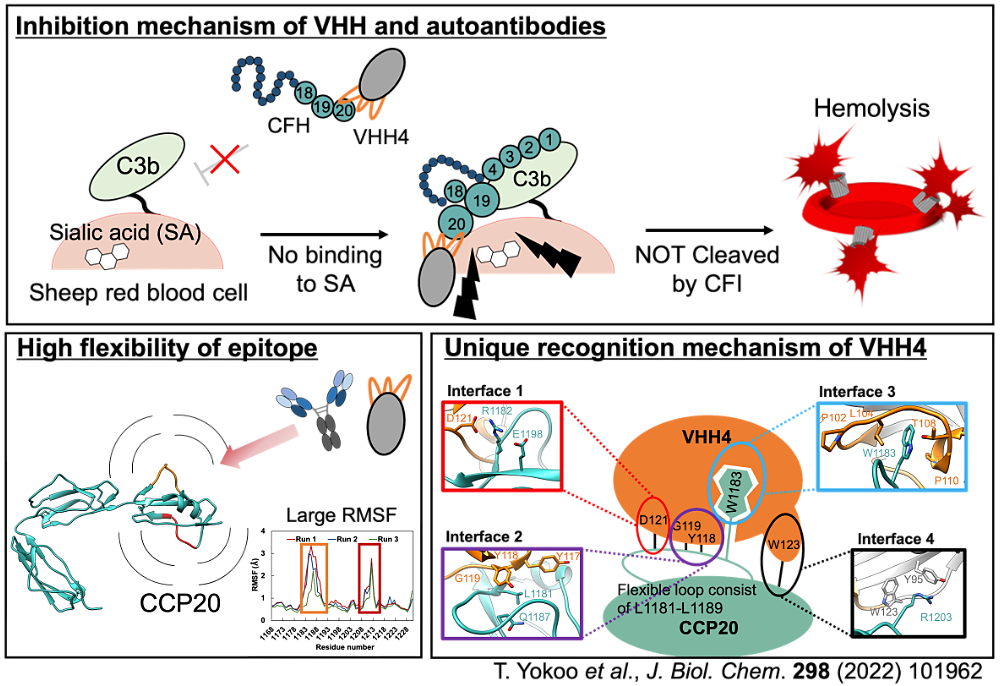
今回の発表におきましては、補体抑制補因子 CFH に対する自己抗体と同様の特徴を持つ VHH 抗体の機能解析について報告させて頂きました。CFH は細胞上における補体系の活性化を抑制する役割をもちますが、CFH に対する自己抗体は自己細胞上での補体の過剰活性化を引き起こし、重篤な疾患 aHUS の原因となります。しかし、抗 CFH 自己抗体は不明な点が多く、分子レベルでの解析はほとんどなされておりませんでした。本研究においては、結晶構造解析と溶血試験から、取得した VHH 抗体が自己抗体と類似した特徴を持つことを示し、その阻害機構を明らかにしました。さらに物理化学的手法と MD シミュレーションに基づいて VHH が持つユニークな分子認識機構と特徴的なエピトープの挙動を解明しています。本研究の成果は JBC に掲載されており、抗 CFH 自己抗体の1つのモデルを提示するものと考えております。
受賞を励みにこれからも研究に努め、蛋白質科学、蛋白質工学、そして生命現象の解明に貢献していきたいと思います。
SO2-05 赤坂 浩明(東京大学)

この度は学生口頭発表賞を頂き、大変嬉しく思います。今回の受賞を励みに、今後も研究活動に勤しんでいく所存です。
私が研究しているリゾホスファジン酸(LPA)受容体は G タンパク質共役型受容体(GPCR)の一種で、アゴニスト(作動薬)と結合すると活性型構造へと変化し、細胞内の三量体 G タンパク質と結合、活性化することで細胞内へとシグナルを伝達します。
本研究でクライオ電子顕微鏡を用いた単粒子解析によって、作動薬と結合した活性型 LPA1 と三量体 G タンパク質(Gi)との複合体構造を取得しました。これにより、作動薬の認識様式を明らかにするとともに、作動薬によって受容体が活性型状態へと変化する機序を解明しました。また、受容体と G タンパク質との結合における揺らぎを確認し、そのダイナミクスも示しました。本研究により、薬剤と受容体との相互作用を詳細に理解することができ、LPA1 を標的とする薬剤の開発へ貢献が大いに期待されます。
最後になりますが、いつもご指導いただいております濡木教授、志甫谷助教ならびに濡木研究室の皆様に、この場をお借りして心から御礼申し上げます。
SO2-10 石川 潤一郎(東京大学)

この度は第22回日本蛋白質科学会年会にて学生口頭発表賞を頂き大変光栄に思います。審査員の先生方をはじめ学会関係者の皆様には、この場をお借りして心よりお礼申し上げます。
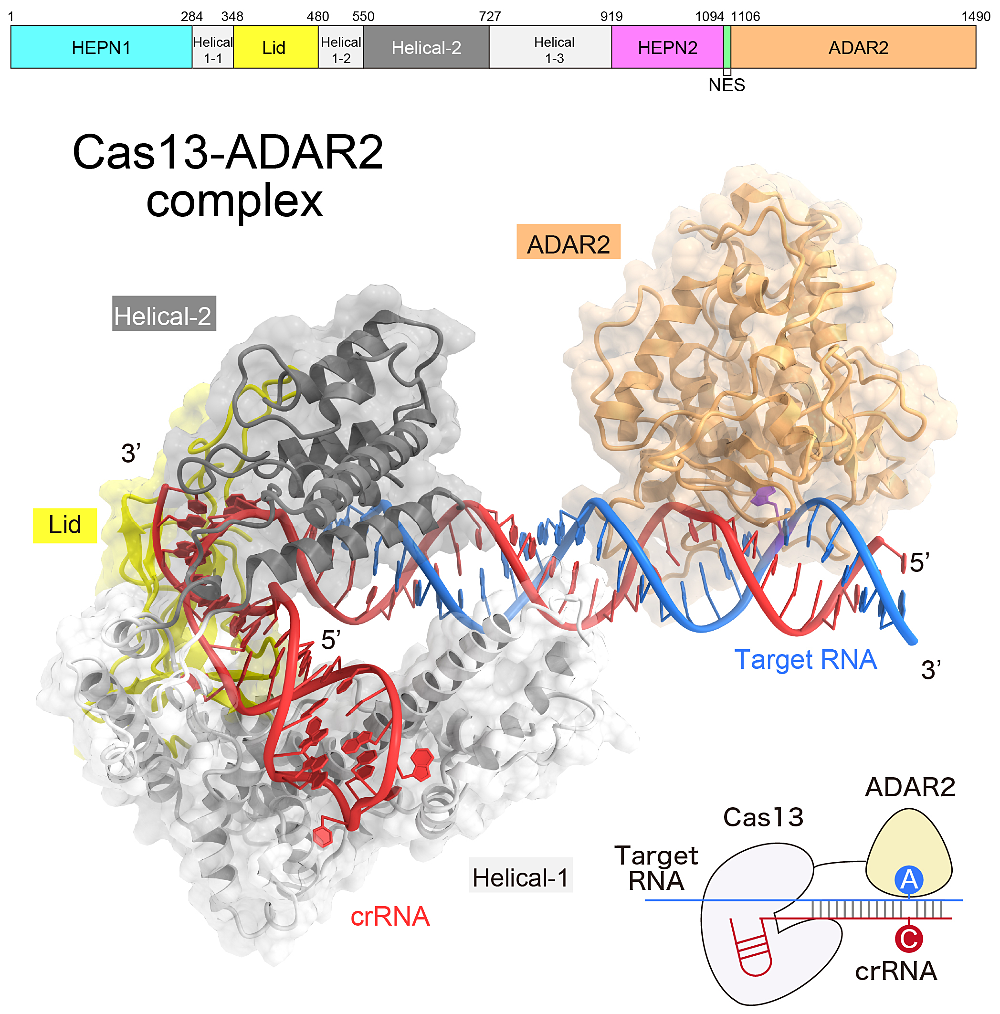
RNA 編集は新しい遺伝子改変技術として注目されています。中でも、近年報告された REPAIR 法(RNA Editing for Programmable A-to-I Replacement)は RNA 切断活性を消失させた Cas13 と脱アミノ化酵素 ADAR2 の融合タンパク質 Cas13–ADAR2 を用いることにより、標的となる RNA 中の特定のアデニンをイノシン(グアニンとして翻訳される)に編集することができます。REPAIR 法は G→A 変異に起因する遺伝子疾患の治療への応用が期待されていますが、その一方で、Cas13–ADAR2 による RNA 認識・編集機構は不明のままでした。
本研究では、REPAIR 法に利用される Cas13–ADAR2 複合体の立体構造を、クライオ電子顕微鏡を用いた単粒子構造解析により決定し、その RNA 認識・編集機構を明らかにしました。今後は構造情報に基づく分子改変を行い、より優れた RNA 編集ツールの開発を目指したいと考えています。
今回、学生口頭発表賞として本研究を評価して頂いたことは励みになりました。本研究の経験を基に、今後は RNA 編集酵素についての研究を展開していきたいと考えています。
最後に、本研究を行うにあたりご指導いただいた西増教授をはじめとする西増研究室の方々に心より感謝申し上げます。
SO3-02 工藤 玄己(筑波大学)

この度は第22回日本蛋白質科学会年会学生口頭発表賞に選出いただき、誠にありがとうございます。審査員の方々はじめ年会の現地開催にご尽力いただいた学会関係者のみなさまに、この場をお借りして心より感謝申し上げます。
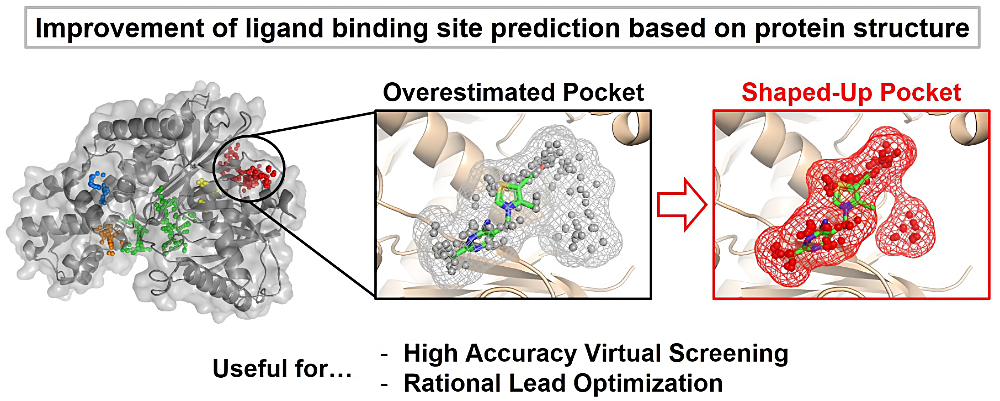
今回の発表では蛋白質の結合部位形状予測における高精度化について報告させていただきました。結合部位自体は従来の方法でも高い精度で予測できる一方で、その詳細な形状等の予測は未だに十分ではありません。本研究では探索ソフトウェアの予測ポケットに着目し、より明確な結合部位形状に補正する手法を開発しました。また、ヒット化合物を持つ複合体構造にこの補正手法を適用することで、リード化合物として適切な形状を予測可能であることを確認しました。
我々の開発した結合部位予測の形状補正手法は、構造解析の発達や AlphaFold2 の登場により Structure-based drug design が台頭する現代において、非常に有用であると考えています。開発したツールは今後公開予定のため、幅広い分野の研究者の皆さまにご使用いただけますと幸いです。
最後に、日々研究のご指導をいただいております広川貴次教授をはじめ、計算科学研究センター・重田育照教授、医学医療系・吉野龍ノ介助教、研究室の皆さま方に厚く御礼申し上げます。
SO4-01 山口 祐希(大阪大学)

この度は学生口頭発表賞を頂き、大変嬉しく、光栄に思っております。このような状況の中、学会の開催に尽力してくださった学会関係者の皆様、そして審査員の皆様に心より感謝申し上げます。
抗体は血液中に多く存在する蛋白質で、生体内に侵入したウイルスなどの抗原を認識し、それらを排除する重要な役割を果たしています。抗体は抗原と結合した後に免疫細胞上の受容体と結合することで免疫エフェクター機能を誘導しますが、抗体と抗原の結合と、抗体と受容体との結合の関連性は明らかにされていませんでした。本研究では、バイオレイヤー干渉法や水素/重水素交換質量分析法、クロスリンク質量分析法といった速度論的および構造生物学的な手法を組み合わせることで、抗原は抗体に結合すると、抗体の受容体との結合に関与する領域に構造変化を引き起こし、その構造変化を介して抗体の免疫エフェクター機能を調節している可能性があることを明らかにしました。
この賞をいただいたことを励みに、これからも精一杯研究に励んでまいります。
最後になりましたが、本研究を行うにあたりご指導を賜りました内山進教授ならびに研究室の皆様、共同研究者の皆様にこの場をお借りして、厚く御礼申し上げます。
SO4-08 大原 直也(慶應義塾大学)

この度は第22回日本蛋白質科学会年会におきまして学生口頭発表賞に選出いただいたこと、大変光栄に思います。審査員の先生方をはじめ、大会関係者の皆様に御礼申し上げます。
本会では、以前に設計・構築された人工タンパク質超分子 TIP60 を題材に、その多量体形成を外部刺激によって誘導可能にすることを目指したさらなる設計について報告しました。
TIP60 のモノマーは、5量体ドメインと2量体ドメインを有しており、通常それぞれのドメインでの自発的な会合により、ウイルスキャプシドのようなタンパク質ケージを形成します。
今回私は、5量体形成に重要なタンパク質間相互作用を、金属イオンの配位結合で置き換えることを試みました。結果として、設計した変異体の一つが、アルカリ土類金属の添加によりケージ構造を形成することを明らかにしました。これらの成果は、タンパク質ケージの会合状態をアルカリ土類金属により制御した初めての例であり、今後の設計指針を与えるものとして期待されます。
最後に、本研究を行うにあたり日頃よりご指導頂きました宮本先生、川上先生、および多大なるご支援を賜りました共同研究者の先生方に、この場をお借りして改めて感謝申し上げます。
SO5-02 武井 梓穂(北海道大学)

この度は、第23回日本蛋白質科学会年会におきまして、このような栄誉ある賞を頂戴し大変光栄に思っております。
日々の研究活動を熱心にご指導していただいている尾瀬教授、姚名誉教授へこの場をお借りして深くお礼を申し上げます。また、夢中で研究に打ち込むことを応援してくれている母と父、そして日々切磋琢磨し合う構造生物化学研究室のメンバーの皆様にも感謝を申し上げます。
乳がんは日本人女性の癌部位別罹患数の1位であり、現代日本において非常に深刻な疾患の一つです。乳がんの新規治療法開発のためにもがんの増悪化メカニズムを理解することは重要と考え、乳がん特異的なキナーゼに関する研究に取り組んでおります。本会では、乳がんで特異的に発現するキナーゼと、キナーゼの活性制御に関わるアダプター分子の活性解析並びに相互作用解析についての研究結果をご報告させていただきました。
新型コロナウイルスの蔓延と共に始まった研究生活でしたので、オンサイトでの学会参加は本会が初めてでした。人前で発表をさせていただく緊張感と、直接質問を受ける高揚感はとても刺激的でした。また、さまざまな先生や学生と出会うことができ、技術面・学術面だけでなく、多角的に研究を考えることができるとても良い経験となりました。オンサイトでの学会開催に尽力してくださった全ての関係者の皆様に感謝を申し上げます。
この喜びを励みに、興味深い生命現象をとことん掘り下げ、サイエンスを楽しむ学生生活にしたいです。本当にありがとうございました。
SO7-07 川越 聡一郎(北海道大学)

第22回蛋白質科学会年会において学生口頭発表賞を授与いただき、大変光栄に思います。
学会関係者のみなさまと、日頃から多大なるご支援をいただいております、北大・構造化学研究室の石森浩一郎先生、徳島大・分子生命科学分野の齋尾智英先生をはじめとした本研究の関係者のみなさまに、この場をお借りして心より感謝申し上げます。
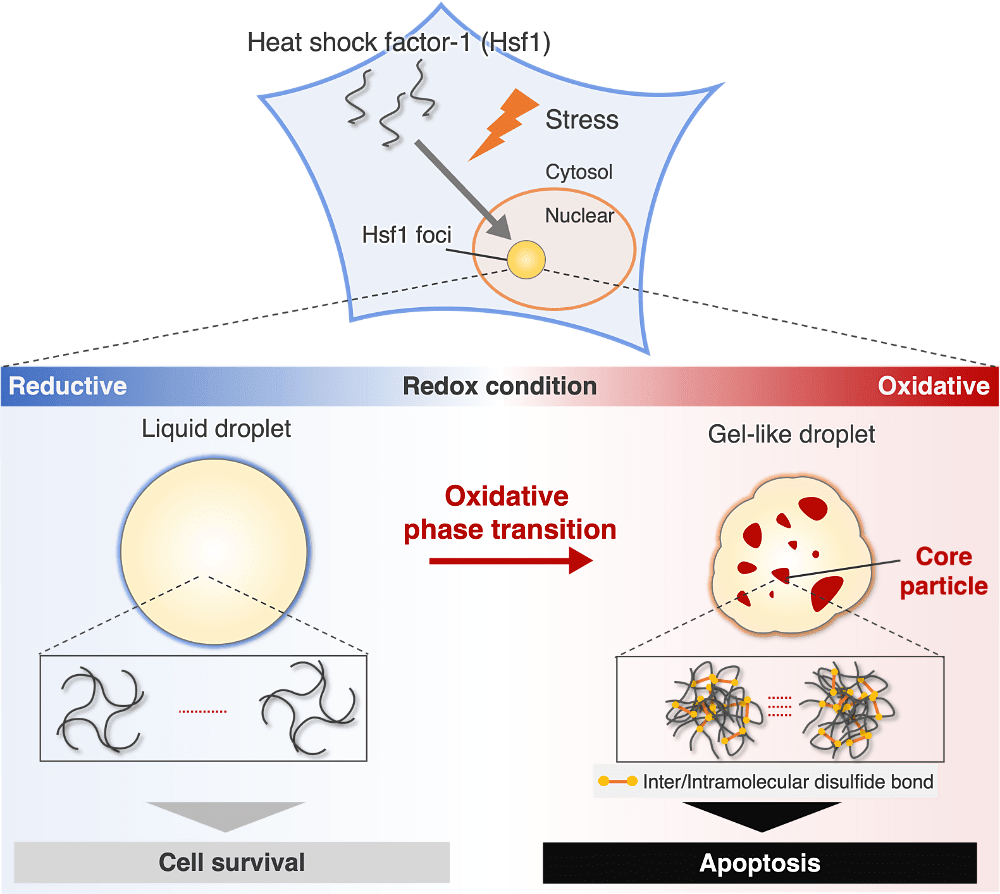
生物は細胞死誘導とストレス適応を、ストレスレベルに応じて巧みに制御することで、個体としての恒常性を維持しています。Heat shock factor-1(Hsf1)は、ストレスを感知して多量体化し、分子シャペロンの転写促進により細胞を保護する一方、強いストレス下ではゲル状の液滴を細胞内で形成し、このゲル状液滴への相転移はアポトーシスを誘導します。つまり、Hsf1 はストレスに応じて、細胞保護とアポトーシスという相反する効果をもたらしますが、その詳細な機構は未解明でした。
そこで、in vitro 及び培養細胞中での Hsf1 液滴の形状と流動性を評価し、Hsf1 は酸化環境下で相転移することを明らかにしました。さらに、この酸化的相転移は、ジスルフィド結合を介した Hsf1 の高次多量体化による、より高密度な液滴形成により引き起こされることを、屈折率イメージングと SEC-MALS により示しました。これらの結果は、Hsf1 がレドックスバランスを細胞内のストレスレベルとして感知し、酸化的相転移により細胞運命を制御することを示唆しています。
今回の賞を励みに、今後もタンパク質恒常性管理システムの分子機構解明に貢献できるよう、日々精進して参りたいと思います。
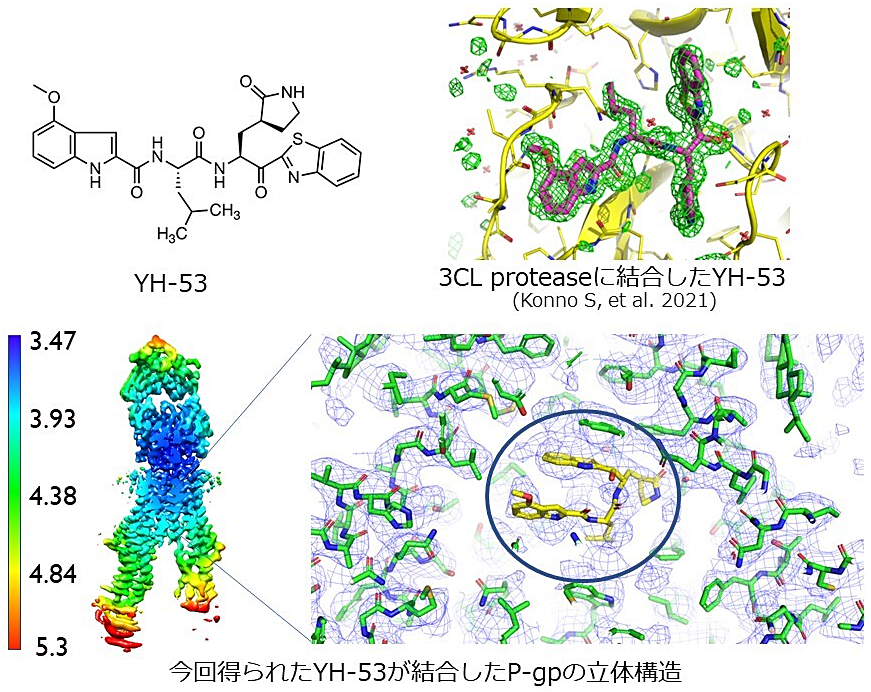
SO8-03 濱口 紀江(千葉大学)

この度は、第22回日本蛋白質科学会年会におきまして学生口頭発表賞に選出いただき、大変光栄に思います。
P 糖タンパク質(P-gp)は多剤排出トランスポーターで、非常に幅広い構造の化合物を認識し輸送することから薬物動態に深く関与しています。
林グループの研究で、SARS-CoV-2 の 3CL protease 阻害剤である YH-53 が、この P 糖タンパク質に基質として認識され、細胞外に排出されることで薬効が低下していることが報告されていました。すでに YH-53 と 3CL protese の共結晶構造が報告され、YH-53 の改変可能領域が分かっていることから、P-gp における YH-53 の結合様式が得られれば、3CL protease の阻害能は維持したまま、P-gp に排出されない薬剤の設計が可能になるのではと考え、YH-53 が結合した P-gp の立体構造決定を行いました。今後は構造情報をもとに、薬剤のデザインを提案していきたいと考えております。
最後となりましたが、学会関係者の皆様、日頃からご指導をいただいている村田武士教授をはじめとする生体構造化学研究室の皆様、共同研究者の先生方に心より感謝申し上げます。
SO8-10 山田 等仁(京都産業大学)

この度は学生口頭発表賞を頂けたことを大変光栄に思います。日頃よりお世話になっております指導教員の津下英明先生、日本女子大学の吉田徹先生をはじめ大阪大学蛋白質研究所の川本晃大先生、加藤貴之先生にこの場を借りて感謝申し上げます。
二成分毒素は細胞に重篤な影響を与える酵素成分と、それを細胞に送り込む膜孔の二つの蛋白質からなる細菌毒素です。酵素成分が膜孔を透過するためにはその構造を失う必要がありますが、この機構は明らかにされていない状況でした。まず我々はウェルシュ菌が産生する二成分毒素の構造解析を行い、複合体中において酵素成分の N 末端がアンフォールドされることを見出し、昨年の年会の若手奨励賞演題にて発表を行わせて頂きました。今年は続編となる、ディフィシル菌の二成分毒素(CDT)の酵素成分・膜孔複合体の構造解析について発表を行いました。今回の研究から、上記の構造変化の動的な過程を連続的に捉えたとも思われる結果を得ることができました。これによって二成分毒素の膜透過機構解明にさらに迫ることができたと考えています。
二成分毒素の膜透過機構について知見が重なることで、膜を介した細胞内への様々な分子のインジェクションの開発などの応用が期待されます。今後も楽しく面白い研究を続けていきたいと考えております。
SO9-07 橋本 聡(広島大学)

この度は第22回日本蛋白質科学会にて学生口頭発表賞をいただけたことを大変光栄に思います。まずはこの場をお借りして、学会関係者の皆様、日頃からご指導いただいている松尾光一准教授をはじめ、放射光科学研究センター(HiSOR)の皆様に厚く御礼申し上げます。
生体膜に相互作用し機能を発現する膜結合タンパク質は、試料調製、測定の困難さからその機能の解明はいまだ不十分であるのが現状です。当研究室の放射光を光源とする真空紫外円二色性分光(VUVCD)装置は、スペクトルから二次構造の含量、本数、位置解析を可能とし、これまで多くの膜結合タンパク質の構造解析に応用されてきました。
本研究では VUVCD 装置に時間分解セルを組み込み、タンパク質–生体膜相互作用の動的構造観測を実現する新しい研究手法の開発を行っています。口頭発表ではモデルタンパク質であるβラクトグロブリンとリゾリン脂質との相互作用過程の時間分解観測について報告いたしました。天然状態、中間状態、膜結合状態といった構造変化経路を見出し、それぞれの二次構造情報算出に成功しました。
本研究は HiSOR だから実現できる他に例のないチャレンジだと考えております。恵まれた研究環境に感謝し、引き続きタンパク質の動的構造理解に向けて果敢に挑み続けていきます。
