本年度第22回日本蛋白質科学会年会(つくば)における若手奨励賞受賞者の方から原稿をいただきましたのでここにお知らせします(演題番号順)。
日本蛋白質科学会 役員会
若手奨励賞 7名
YSA-01 石田 祥一(横浜市立大学)

この度は第22回年会にて若手奨励賞を賜り、大変光栄に存じます。日本蛋白質科学会年会にははじめての参加でしたが、このような発表の機会を頂き貴重な体験となりました。
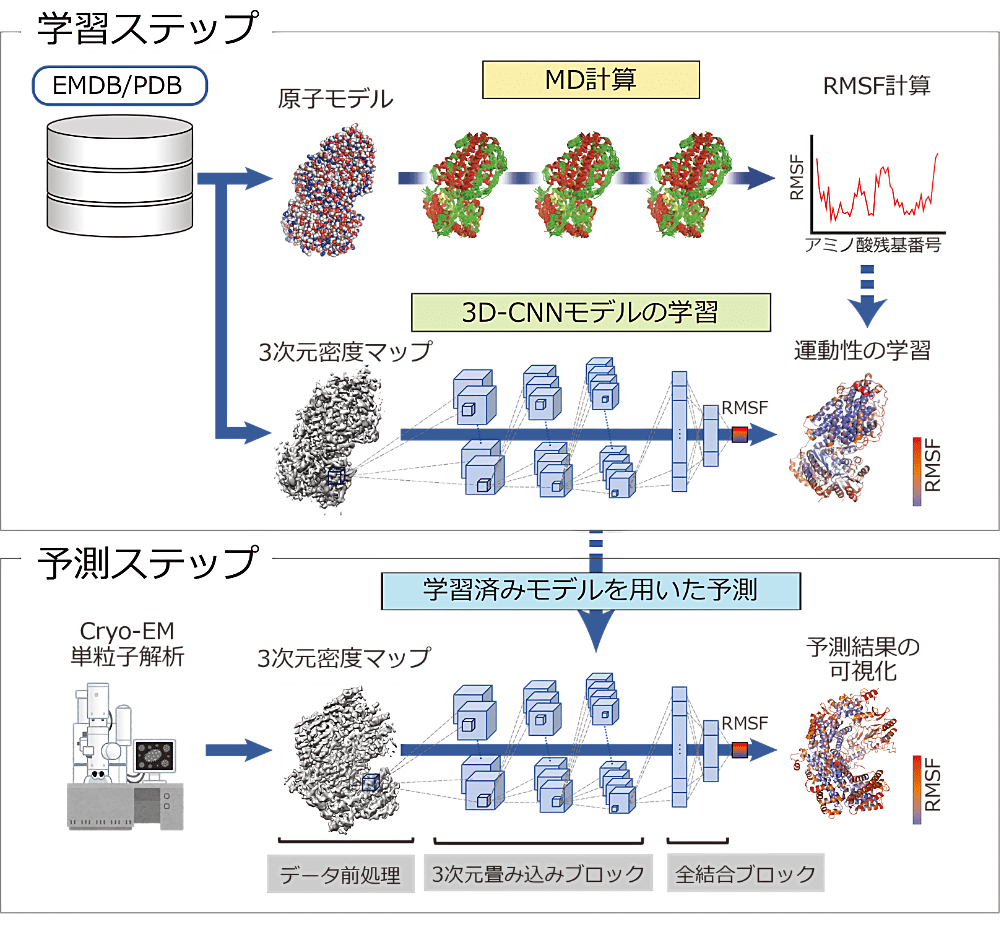
本研究では、深層学習とMD計算を組み合わせることで、cryo-EM を用いた単粒子解析法により得られる3次元密度マップのみからタンパク質の運動性情報を予測する新たな手法「Dynamics Extraction From cryo-EM Map(DEFMap)」を開発しました。DEFMap が予測した運動性情報は、MD 計算で得られた RMSF 値や HDX-MS で実験的に計測された運動性情報とも良い相関を示しており、かつ非常に低い計算コストで計算をすることができます。さらに DEFMap を用いたことで初めて得られたタンパク質–リガンド相互作用に関する知見や、通常では MD 計算が困難な超巨大なウイルス粒子タンパク質に関しても迅速に運動性を予測し、その分子の運動性に関する知見を得ることにも成功しました。加えて、多くの研究者に DEFMap を使ってもらえるよう、Google Colaboratory を含めいくつかのユーザーインターフェースも併せて公開しています。
本研究は計算科学、構造生物学、情報科学の3つの分野が合わることで達成できた学際的な共同研究になります。共著者である寺山慧准教授(横浜市大)、松本篤幸特定准教授(京大)、荒木望嗣特定准教授(京大)、加藤貴之教授(大阪大)、奥野恭史教授(京大)の皆様に、このような研究に携わらせていただいたことをこの場を借りて改めて感謝と御礼を申し上げます。
YSA-02 中尾 新(岡山大学)

この度は第22回日本蛋白質科学会年会におきまして若手奨励賞を頂き、大変光栄に存じます。審査員の先生方をはじめとした学会関係者の皆様には、この場をお借りして心より御礼申し上げます。
膜タンパク質の一種である微生物型ロドプシンは光を受容することによりイオンを輸送する性質から、光で生理機能を操作する技術(オプトジェネティクス)のツールとして用いられています。オプトジェネティクスは主に膜電位制御を介した神経活動の操作に利用されていますが、細胞全般に備わる生理機能の操作にはあまり利用されていません。本研究ではオプトジェネティクスを用いて、細胞全般に備わる生理機能の1つである細胞死の操作に取り組みました。外向きプロトンポンプ型ロドプシン(AR3)は、光照射によりプロトンを細胞内から細胞外へ輸送するため、細胞内をアルカリ化することができると考えられます。また、細胞内のアルカリ化は細胞自死(アポトーシス)に関与することが示唆されています。そこでこれらの要素を組み合わせ、AR3 を用いた細胞内のアルカリ化により、光でアポトーシスを誘導する手法を確立しました。さらに、本手法が様々な種類の培養細胞・モデル動物である線虫個体に適用可能であることを実証しました。将来的には本手法をがん治療へ適用し、狙った細胞のみを刺激することができるという光の利点を活かすことで、副作用を限りなく抑えたがん治療法を実現したいと考えています。
本研究を行うにあたりご指導いただいた須藤教授、小島助教をはじめとする須藤研究室の方々に心より感謝申し上げます。

YSA-03 野井 健太郎(大阪大学)

この度は第22回日本蛋白質科学会年会において若手奨励賞をいただき、大変光栄に存じます。3年ぶりの現地開催で発表の機会を設けていただき、誠にありがとうございました。
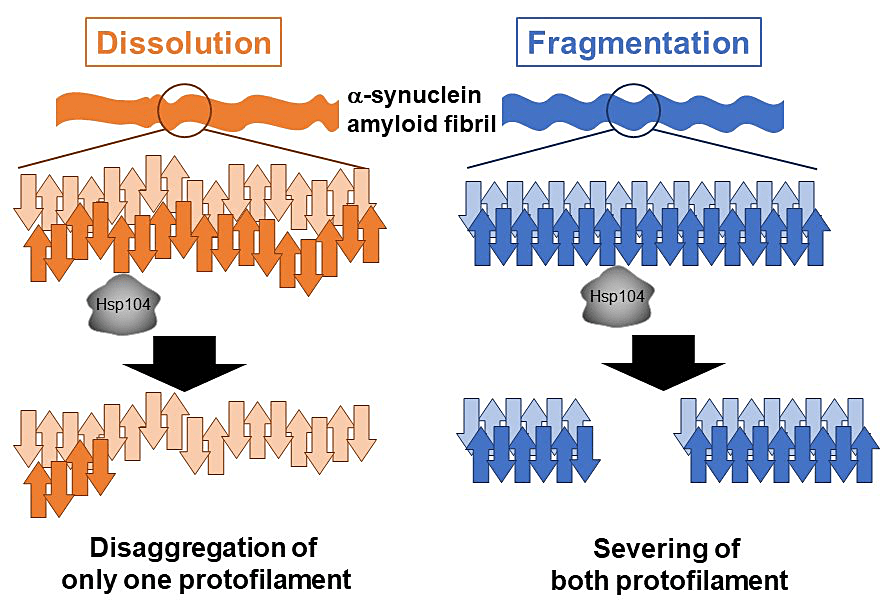
私は、分子シャペロンの一種である Hsp104 の機能に着目をし、研究を進めております。Hsp104 は ATP 依存的な構造変化を繰り返すことでタンパク質の凝集体を解きほどくことができます。標的とする凝集物の中には、神経変性疾患の発症に関与するアミロイド線維も含まれていることから、研究が盛んに行われています。しかし、Hsp104 による詳細な脱凝集機構にはまだ未解明な点があります。そこで私は Hsp104 の脱凝集過程を、生理条件下で高分解能・リアルタイム観察が可能な高速原子間力顕微鏡を用いて観察を行いました。高速原子間力顕微鏡の観察から、αシヌクレインのアミロイド線維に対する Hsp104 の脱凝集機構には、アミロイド線維を構成する2本のプロトフィラメントのうち1本を脱凝集する “Dissolution” と、2本のプロトフィラメントをほぼ同時に脱凝集する “Fragmentation” の2種類があることを明らかにしました。さらに、この脱凝集過程が異なる2種類を引き起こす要因として、アミロイド線維表面の微細な構造が重要であることを見出しました。
本研究を行うにあたり養王田 正文教授、篠原 恭介准教授(東京農工大学)をはじめとする養王田研究室の方々、及び小椋 光特任教授(熊本大学)、山本 大輔教授(福岡大学)をはじめとする共同研究者の方々にこの場を借りて厚く御礼申し上げます。
YSA-04 齋藤 徹(広島市立大学)

この度は2022年度の日本蛋白質科学会若手奨励賞をいただき、大変光栄に存じます。
私は金属酵素の高い反応性と反応選択性に魅せられ、計算化学による研究を行っております。金属酵素の活性部位は、開殻系と呼ばれる複雑な電子状態を持つため、量子化学計算に膨大な計算時間を必要とします。そこで私は、計算精度を維持しながら計算時間を短縮する方法の開発と大規模開殻系への展開を目指してきました。学生時代に小さな有機ビラジカル分子の研究からスタートし、最近ようやく金属酵素の研究に着手できるようになりました。
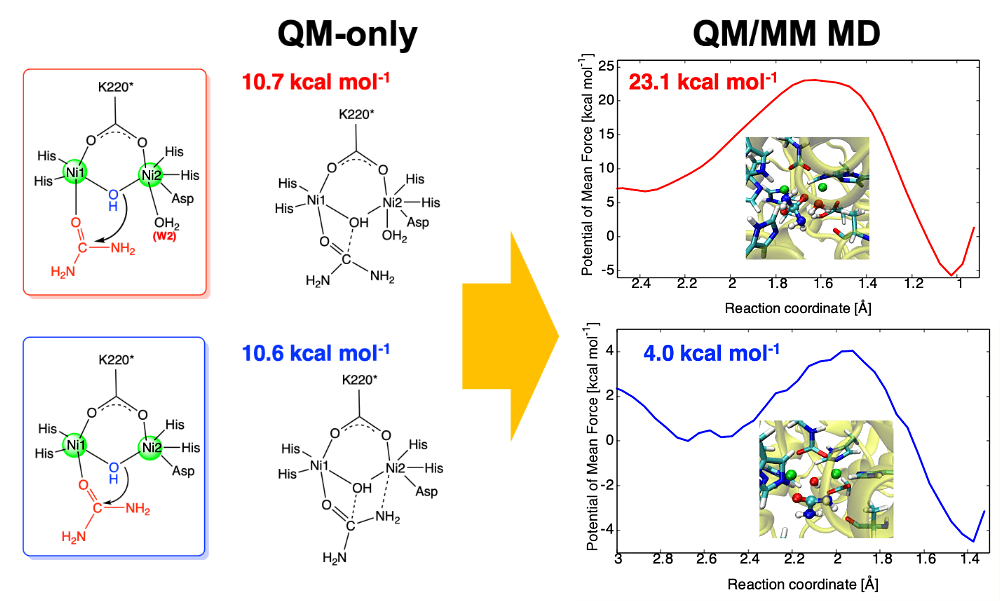
本研究では金属酵素ウレアーゼによる加水分解反応に着目しました。ウレアーゼはピロリ菌や土壌細菌が産生する金属酵素で、複核ニッケル活性部位が基質である尿素をアンモニアと二酸化炭素に分解します。酵素–基質複合体の結合様式として、単座と二座のどちらが適切か長年にわたって議論されてきました。活性部位をモデル化して量子化学計算を行うアプローチ(QM-only)では両者の反応性に大きな差が見られなかったためです。今回、タンパク質環境を考慮した量子/古典混合分子動力学(QM/MM MD)シミュレーションを実行することにより、二座配位の方が圧倒的に高い反応性を有することを明らかにしました。
YSA-05 森本 大智(京都大学)

この度は2022年度日本蛋白質科学会若手奨励賞をいただき大変光栄に存じます。本奨励賞を励みに、より一層研究に勤しみたいと思います。
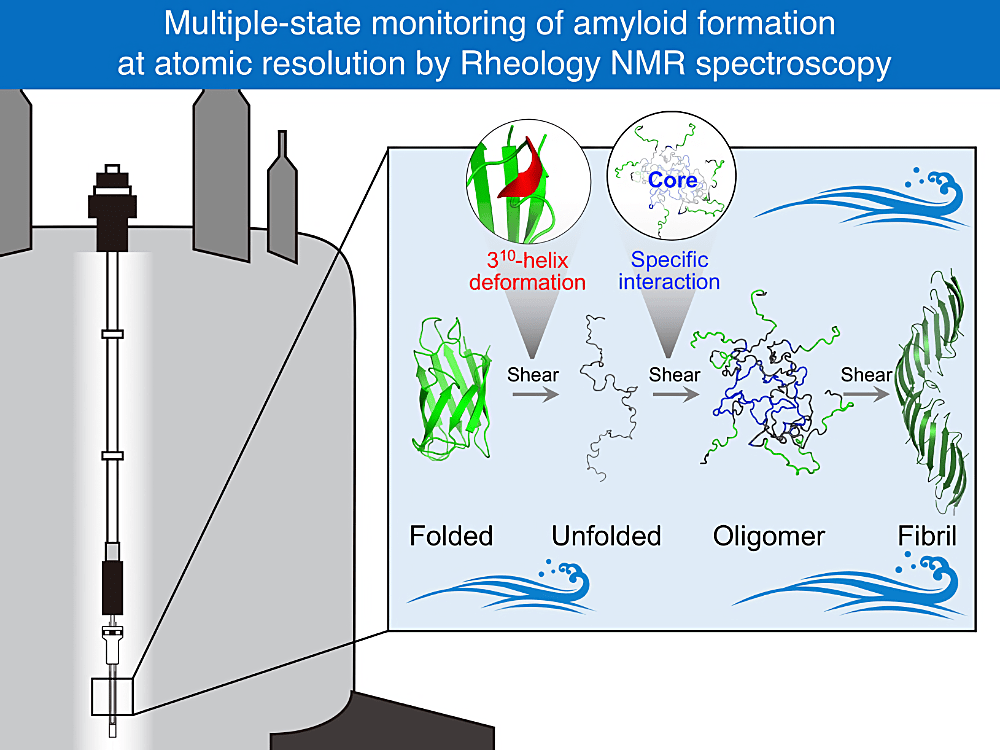
本研究の道のりは長く、2016年にドイツの Scheler 博士を訪れたことから始まりました。もともとタンパク質の異常凝集に興味を持ち、より深く理解したいと想いがありました。しかし、既存の方法論では、凝集の「その場」を高い分解能で観察することは困難な状況でした。そのような状況の中、撹拌しながら NMR 測定ができるレオロジー NMR 法がドイツのドレスデンで開発されていることを知りました。この方法であれば、凝集を誘導しながら凝集する様子を原子レベルで観察できると確信しました。幸運にも、Scheler 博士は快く我々の訪問を受け入れてくれ、共同研究の末、翌年2017年には、新たなレオロジー NMR 法を開発することができました。その後、最適な観察対象、最適な実験条件を探索することに時間を要したものの、2021年にはレオロジー NMR 法を用いて、ALS 関連タンパク質である SOD1 が異常凝集体を形成する「その場」を、複数の状態変化とともに原子レベルで捉えることに成功しました。
本研究を遂行するに当たり、京都大学の白川昌宏教授、菅瀬謙治教授、Erik Walinda 助教、卒業生の岩川直都博士、ドイツの IPF の Ulrich Scheler 博士、ブルカージャパン株式会社の山本昭彦様、エアープロ株式会社の保科好秀様をはじめ多くの方々にお世話になりました。心より感謝を申し上げたいと思います。
YSA-08 竹田 弘法(理化学研究所/現・奈良先端科学技術大学院大学)

この度は若手奨励賞をいただき、光栄に存じます。
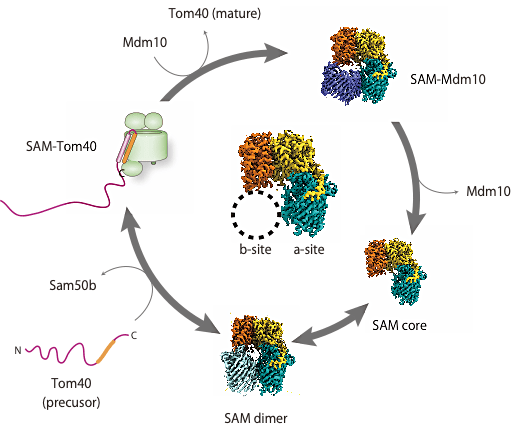
今回の発表では、ミトコンドリアにおけるタンパク質膜挿入装置 SAM 複合体がどのようにして基質タンパク質をβバレル構造へと整形し、補助装置 Mdm10 と協働して膜へリリースするのか、その詳細な分子メカニズムを紹介しました。
SAM 複合体の構造研究は激しい競争にあります。我々よりも先に SAM 複合体の立体構造を発表したのは、βバレル膜タンパク質の構造研究における第一人者である Buchanan lab です(Diederichs et al, 2020)。また、Ping Yin lab から2種類の SAM–Tom40 複合体の構造が発表されました(Wang et al, 2021)。しかし我々は、新たな状態の SAM 複合体に加え、いくつかの膜タンパク質複合体の構造を決定することに成功しました。これらの研究成果を来年の蛋白質科学会でご報告できればと思っております。これからもミトコンドリアにおける構造生物学を深めていくべく、研究に邁進していく所存です。
YSA-10 齊藤 恭紀(岡山大学)

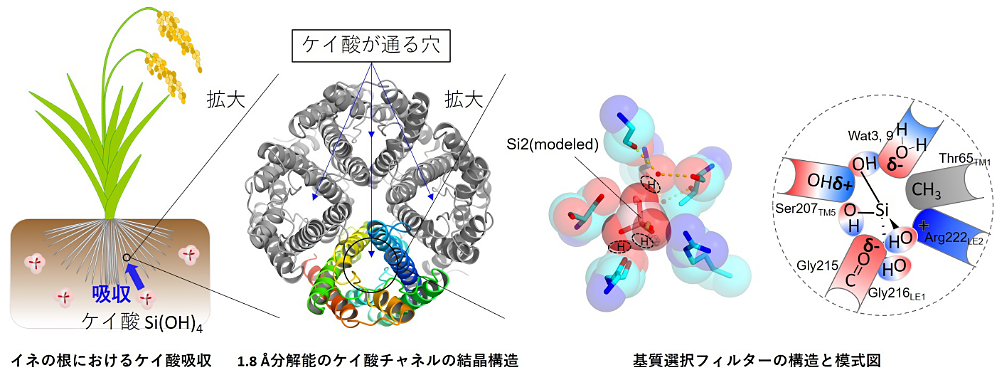
この度は第22回日本蛋白質科学会年会にて若手奨励賞をいただき大変光栄に思います。私は生体膜を介した物質・情報のやり取りの仕組みに興味を持って研究しております。受賞対象となった本研究は、イネの根がどのようにしてケイ酸を取り込んでいるのかという問いに対して、イネのケイ酸チャネルの構造基盤を提供し、その仕組みの一端を明らかにしたものです。
イネは我々にとって身近な植物でありますが、植物界の中ではケイ素を非常に良く “食べる” 変わった種です。イネはケイ素を根から取り込むことで頑健になるのですが、どのようにしてケイ素を取り込んでいるのか、その詳細はよく分かっていませんでした。我々はイネのケイ素取り込みに欠かせないケイ酸チャネルの構造を高分解能で解析し、そのケイ酸透過機構を機能解析と MD シミュレーションを駆使して明らかにしました。特に、チャネル内の基質選択フィルターが、タンパク質だけでなく特殊な水分子によっても形作られており、それがケイ酸選択性に重要であることを明らかにできた点はとても興味深いものだと思っております。しかしながら、イネのケイ酸透過機構は奥が深く、まだまだ明らかにしなければいけないことが沢山残っています。今後も膜タンパク質に着目して、興味深い生命現象を深堀りしていきたいと思っております。
なお、本研究成果は岡山大学の菅倫寛研究室、馬建鋒研究室、東京大学の石北央研究室との共同研究で得られたものであり、共著者の皆様、放射光施設のスタッフの方々にはこの場を借りて深謝申し上げます。