本年度第21回年会(オンライン)におけるポスター賞受賞者の方にコラムを寄稿いただきましたので、掲載致します(演題番号順)。
日本蛋白質科学会 役員会
1P-03 吉田 茉由(大阪府立大学)

この度は第21回日本蛋白質科学会にてポスター賞を頂き、大変嬉しく思います。審査員の先生方をはじめとした学会関係者の皆様、指導していただいた先生方に心より感謝いたします。
今回のポスター発表では、アロステリック型 ERK2 阻害剤の作用機序について報告させて頂きました。ERK2 は細胞外からのシグナル伝達によって活性化され、転写因子を活性化し、細胞増殖や分化など生命活動に重要な生物応答を引き起こすキナーゼです。そのため、がんや糖尿病などの創薬ターゲットとして注目されています。我々は、ERK2 高選択的阻害剤の創出を目指し、ATP 非拮抗なアロステリック阻害剤に着目しました。今回、アロステリック型 ERK2 阻害剤の X 線結晶構造解析を行い、その作用メカニズムを明らかにしました。
今後は今回得られた構造基盤を基に、計算化学を取り入れながらより強力な ERK2 阻害剤の創出を目指し、研究を進めていきます。
最後になりましたが、本研究を行うにあたりご指導を賜りました木下教授、および共同研究者の方々にこの場をお借りして、厚く御礼申し上げます。
1P-05 濱口 紀江(千葉大学)

この度はポスター賞をいただくことができ、大変光栄に思っております。この場をお借りして審査員の先生方をはじめとした学会関係者の皆様に心より感謝申し上げます。
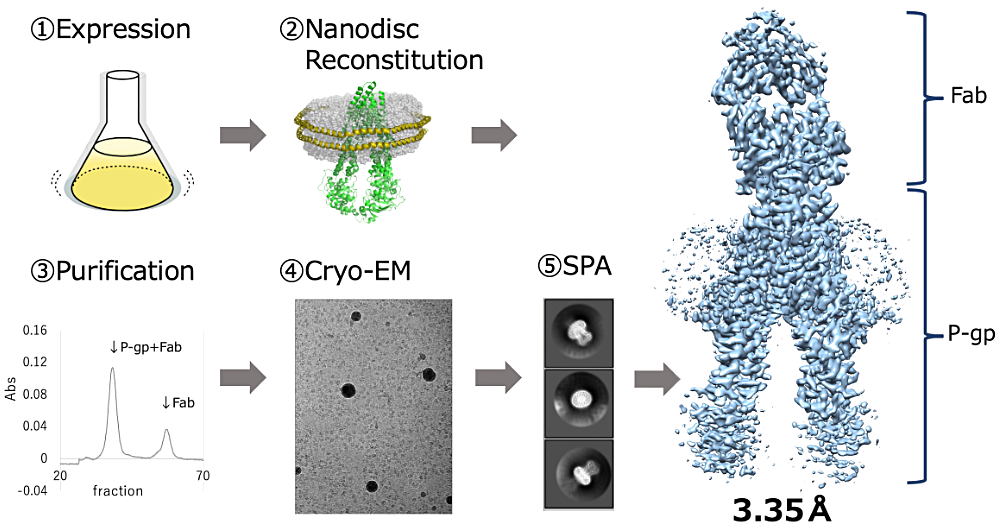
ポスター発表では、多剤排出トランスポーター P 糖蛋白質(P-gp)の構造解析について報告させて頂きました。P-gp は医薬化合物を排出することで薬物動態に寄与することが知られていますが、その化合物認識機構については未だ不明な点が多く、構造解析などを始めとした認識機構解明に向けた研究が行われています。本研究では、P-gp と化合物との複合体構造を得ることを目指し、まず動物細胞を用いた発現系・精製系の構築、また column 上での Nanodisc への再構成を達成しました。そしてクライオ電子顕微鏡での測定、単粒子解析を行うことによって、高分解能のマップを得ることに成功しています。今後はさらに複数の構造を解いて比較することで、化合物認識機構解明を目指していこうと考えております。
最後となりますが、日々研究のご指導をいただいております村田先生、小笠原先生、安田先生をはじめとする村田研究室の皆様、共同研究先である高エネルギー加速器研究機構物構研の先生方や製薬企業のみなさまに感謝申し上げます。
1P-09 前田 信太郎(京都大学)

この度は第21回日本蛋白質科学会年会ポスター賞を頂けたことを大変光栄に思います。指導していただいております岩田想教授、萩原正敏教授をはじめ、岩田研、萩原研の皆様、共同研究者の先生方にこの場を借りて感謝申し上げます。
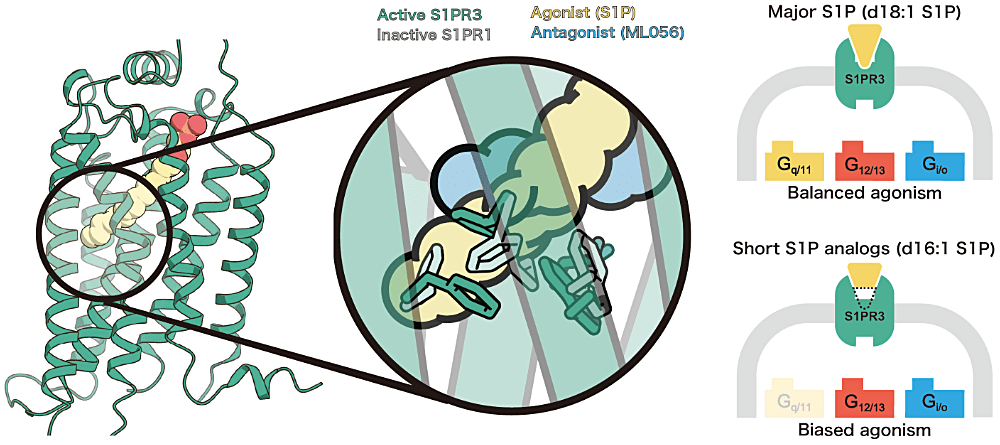
ポスター発表では、S1P というリゾリン脂質を認識する G 蛋白質共役受容体である S1PR3 の活性型構造について報告いたしました。S1P は S1PR3 を含む5つの S1P 受容体を活性化させて細胞内にシグナルを伝えることで免疫細胞の遊走や血管新生などを制御しています。これまで S1P がどのように S1P 受容体を活性化させているかは明らかにされていませんでしたが、今回私が報告した S1P の結合した S1PR3 の結晶構造から S1P-S1P 受容体のユニークな活性化機構が明らかとなりました。さらに、この特徴的な活性化機構から着想を得て、S1P の脂質鎖を短くすることで S1PR3 の共役する G 蛋白質の種類に偏りを生じさせられることを発見しました。
今後も、構造生物学とケミカルバイオロジーの両輪で、面白い生命現象の理解と制御を目指した研究を続けたいと考えております。
1P-32 篠 元輝(京都大学)

この度は、第21回日本蛋白質科学会年会におきましてポスター賞に選出いただき、誠にありがとうございました。大学院に進学して5年目、このような賞を頂くのは初めてですので、大変光栄でございます。
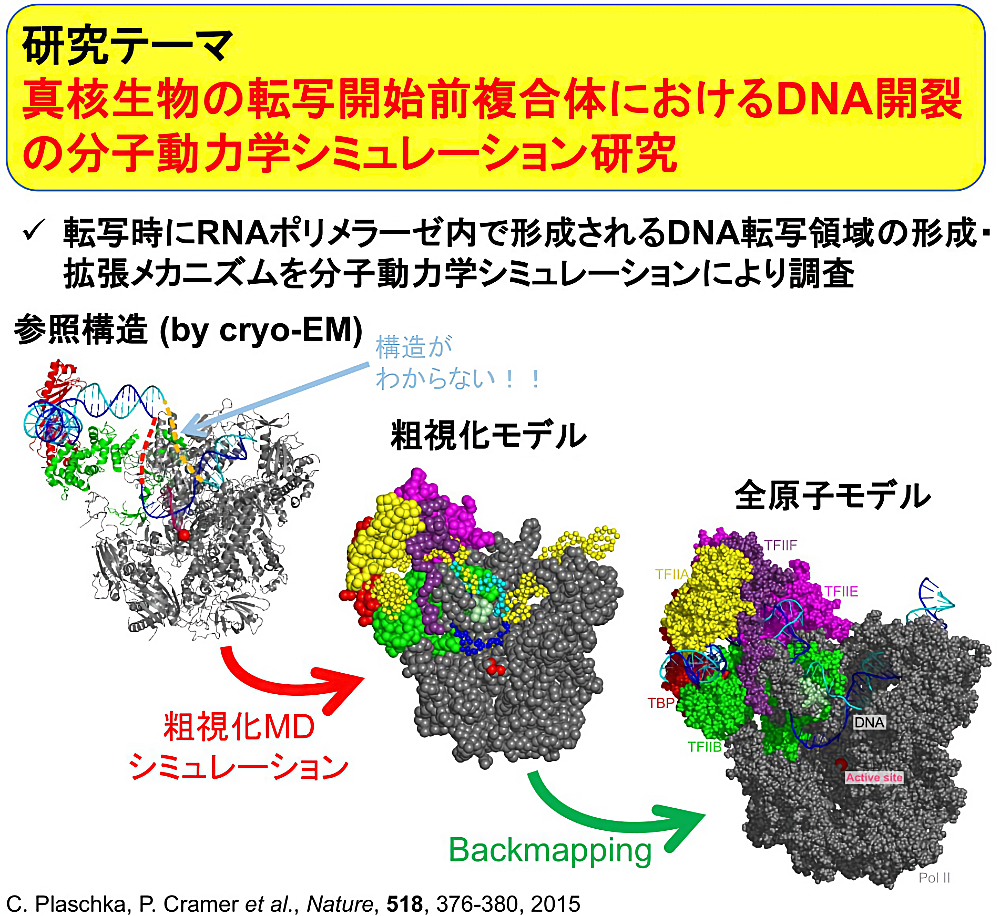
私は真核生物の転写開始段階で形成される転写領域、DNA 転写バブルの形成・拡張メカニズムを調査する研究をしています。真核生物では、RNA ポリメラーゼと複数の基本転写因子が DNA 上に集合することで複合体を形成し、転写因子の働きにより DNA2重らせんの一部がほどけることで、RNA ポリメラーゼ内に DNA 転写バブルが形成、そして拡張されます。しかし、1本鎖領域である DNA 転写バブルは極低温電子顕微鏡による構造解析では観測できておらず、どのような振る舞いをしているか詳細には判明しておりません。本研究では、分子動力学シミュレーションを用いることで完全な DNA 転写バブルを含む複合体の構造を得ることに成功しました。また、DNA 転写バブルの拡張過程において、先行研究では報告されていない中間体の存在を確認しました。この中間体から、DNA 転写バブルの拡張のキーとなるループ構造を特定し、拡張された DNA 転写バブルが RNA ポリメラーゼ内で維持される仕組みも推測できました。
最後に、本研究を行うにあたりご指導を賜りました高田彰二教授ならびに研究室関係者の皆様に、この場をお借りしてお礼申し上げます。
1P-47 山口 秀輝(東京大学)

第21回日本蛋白質科学会年会におきましてポスター賞を授与いただき、誠にありがとうございます。オンライン開催となった本会の運営にご尽力いただいた先生方、また、日々ご指導をいただいております齋藤裕先生に御礼申し上げます。
近年、機械学習技術は広範な領域に応用され、すでに産業・基礎研究の両面で必須となっています。蛋白質科学との関連も深まりつつあり、人間が用いる言語を解析する自然言語処理分野に端を発する protein language model(LM)のアプローチは、10億件規模で利用可能な公開蛋白質データからの情報抽出を可能とするため有望視されています。
この背景を踏まえ、本研究では、蛋白質工学的な観点での手法提案をしました。ある蛋白質への変異導入による機能改変(改善)効果を精度良く予測するため、相同配列を用い対象分子に特有の進化的情報を積極的に取り入れるための protein LM プロトコルを構成しました。これにより得られた予測器は実際にベンチマーク実験において良好な結果を示し、同時に、教師なしで三次構造に関する情報をも学習している可能性が示唆されました。
今後は、本研究で得られた知見を元に、生物学的な制約条件を加味した配列探索アルゴリズムを開発し、より高度かつ効率的な蛋白質設計ができるようにしたいと考えています。
1P-54 杉浦 雅大(名古屋工業大学)

この度は第21回日本蛋白質科学会年会よりポスター賞を賜りましたこと、大変光栄に存じます。また、審査員の先生方はじめ学会関係者の皆様には、この場をお借りして心より御礼申し上げます。
ロドプシンは発色団としてレチナールを結合する膜タンパク質として知られています。また、2005年に誕生した光遺伝学において最もよく使用されているツールであり、ここ10年で神経生理学をはじめとする様々な分野において革新をもたらしています。私の研究対象である酵素ロドプシンも光で細胞内シグナル伝達を制御可能であるため、次世代光遺伝学ツールとして期待されています。
光遺伝学では光で生体反応を制御しますが、そのツールには吸収波長のバリエーションが求められます。例えば、機能の活・不活性化を青・赤色光等で制御できれば、より使いやすいツールとなるためです。
本研究では、新たに発見された酵素ロドプシンの紫外可視分光測定を行い、吸収波長に違いがあることを発見しました。そこで、吸収波長に大きく寄与すると考えられるレチナール近傍のアミノ酸残基を比較することで、これまでに報告の無い未知の波長制御残基を見出すことができました。
今回、ポスター賞という形で本研究を評価していただいたことは非常にうれしく、モチベーションが向上いたしました。今後も日々邁進していく所存です。
最後に多大なご指導・ご鞭撻を賜った指導担当の先生方はじめ、研究室の仲間、関係者の方々に深く感謝いたします。
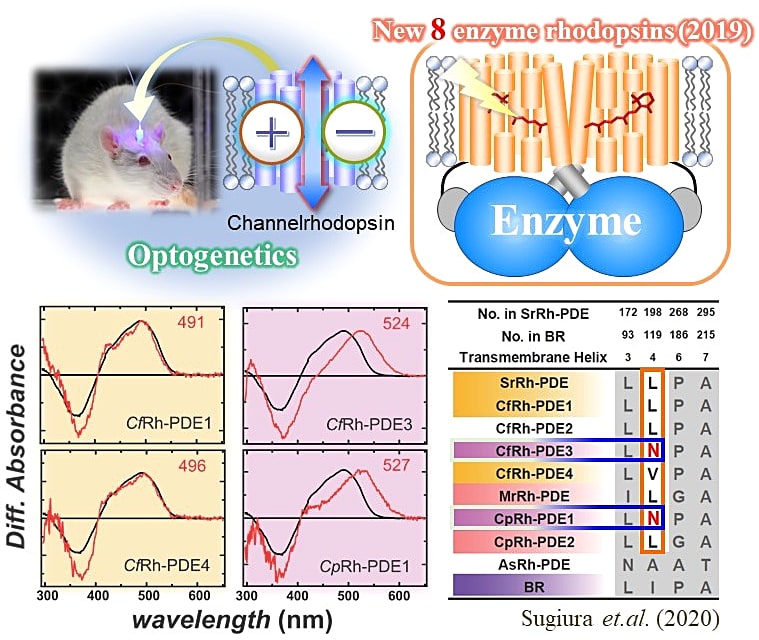
1P-60 渡邉 亮(東京大学)

この度は第21回日本蛋白質科学会年会にてポスター賞をいただき大変光栄に思います。
私の研究対象である F1-ATPase(F1)は、ATP 加水分解反応を駆動力とする回転分子モーターです。これまでに様々な種由来の F1 の回転特性が、1分子計測によって詳細に調べられてきました。その結果、異種間でその配列保存性が非常に高いにも関わらず、その回転速度・回転触媒機構が異なることが明らかになりました。「F1 のどの部分(残基・サブユニット・界面)がこの異種間の多様性をもたらすか」を明らかにすることは、分子モーター F1 の設計原理の理解、そして蛋白質デザインへの知見獲得に直結します。そこで本研究では、回転特性が全く異なる三種類の野生型 F1 についてサブユニットを混合して作製した八種類のハイブリッド F1 の回転特性を調べ、サブユニットが F1 の回転特性に与える影響を評価しました。現在は得られた結果のまとめや追加の解析を行いつつ、論文投稿の準備を進めています。
最後になりましたが、野地研究室の皆様はじめ、当会を通じて議論をさせていただきました方々、本研究に協力してくださった全ての方々に、この場をお借りして厚く御礼申し上げます。
2P-45 大岡 紘治(東京大学)

この度は第21回日本蛋白質科学科年会におきまして、ポスター賞を頂き大変光栄に思います。
本研究は、統計力学モデルを用いてタンパク質のフォールディング自由エネルギー地形を計算し、フォールディング反応機構の解析を行っております。タンパク質の構造に基づいた粗視化モデルである Wako-Saitô-Muñoz-Eaton(WSME)モデルに対し、我々は非局所的相互作用を導入した拡張型 WSME モデルを構築し、計算手法を確立しました。この拡張により、複雑なマルチドメインタンパク質についてモデルを適用することが可能となりました。
リゾチーム、α-ラクトアルブミンは類似した主鎖構造を有していますが、実験により、由来する生物種によってフォールディング機構が異なることが知られています。今回、5種類のリゾチーム、α-ラクトアルブミンについて、ジスルフィド結合に非局所的相互作用を適用することで、それぞれ実験と整合するフォールディング経路が得られました。さらに、疑似的な変異体計算を行い、得られた地形を解析することで、フォールディング経路の決定に重要なアミノ酸残基の同定に成功しました。このように拡張型 WSME モデルはフォールディング経路を予測できるだけでなく、詳細な反応機構の解明にも有用であることが示されました。
これからもタンパク質の振る舞いの解明に向けて果敢に挑んでいきたいと思います。
2P-59 稲田 祐貴(熊本大学)

この度は第21回日本蛋白質科学会年会におきましてポスター賞に選出していただき、まことにありがとうございました。まずはこの場をお借りして、学会関係者の皆様、日頃からご指導いただいている佐藤助教をはじめとする生命分析化学研究室の皆様、および共同研究者の方々に心から御礼申し上げます。
超高齢社会を迎えたわが国では、健康寿命を延ばすために、加齢性疾患の予防法の開発が強く望まれています。私は、加齢性疾患のひとつである ATTR アミロイドーシスの発症制御機構を解明することで、予防戦略の開発に貢献したいと考えています。本発表では、原因タンパク質であるトランスサイレチンのアミロイド形成が、細胞外のレドックス環境によって制御されることをお示ししました。また、詳細な解析から、トランスサイレチンが分子間でジスルフィド結合した二量体を介してアミロイド線維を形成することを見出しています。今後更なる解析を重ねて、本二量体の機能や病態発現機構を明らかにしたいと考えています。
私は、試行錯誤を重ねて未知の生命現象に出会い、人々の健康に貢献できることが、サイエンスの面白さであり、やりがいであると考えます。今回いただいた賞を励みに、今後も自身の探求心を大切にして、サイエンスを楽しみたいと思います。
2P-68 海田 新悟(総合研究大学院大学)

この度はポスター賞を頂き光栄に存じます。ご指導いただいた古賀グループの先生がた、本研究にご助力いただいた全ての方々、そして学会関係者の皆様にこの場をお借りして感謝申し上げます。
本研究のテーマは「様々な形状を有する対称タンパク質複合体の設計」です。タンパク質複合体の形状が自在に設計できるようになれば、望みの形状をもつケージやチューブといった構造体の作成や、新規機能を有する複合体の創出など様々な応用に繋がります。
これまでに報告されている対称複合体設計では、複合体形成にヘリックスバンドル間の相互作用が利用されていたため、複合体界面の形状が制限されて複合体の形状に多様性を出すことが困難でした。そこで本研究ではタンパク質表面の凹凸を噛み合わせた相互作用面を設計することで、多様な形状の対称多量体設計を目指しました。計算機を用いてモノマータンパク質表面の凹凸が噛み合わさった6量体の骨格を探索し、生じた複合体界面に相互作用のための残基を導入しました。このようにして設計したタンパク質を発現・精製したところ、デザインの1つが6量体に近い分子量をもつことが分かり、複合体設計の成功が示唆されました。
今後はさらに多様な複合体を作れるよう、研究を進めていく所存です。
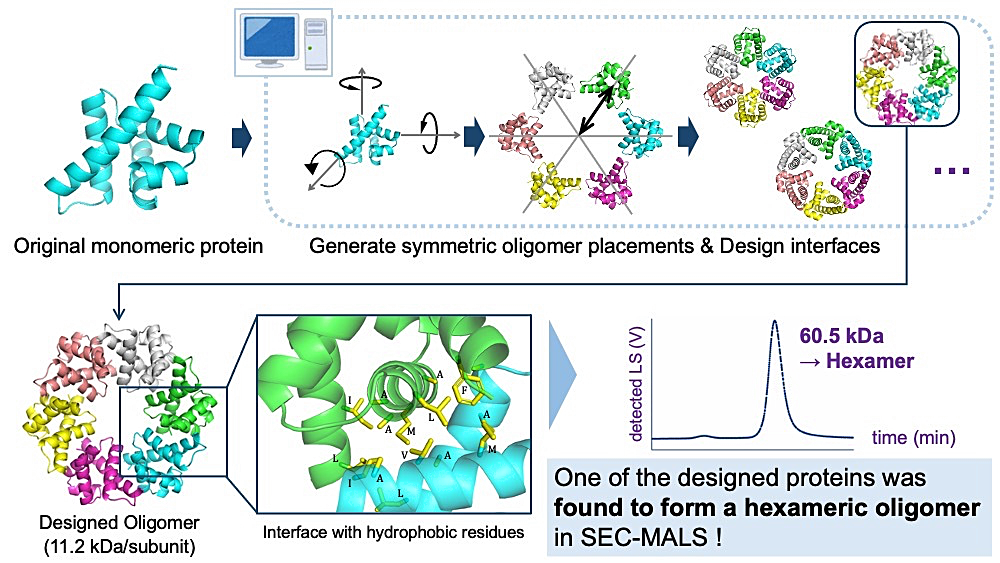
2P-75 岡崎 匡(熊本大学)

この度は第21回日本蛋白質科学会にて、ポスター賞を頂き誠に嬉しく思います。学会関係者の皆様に、心より感謝申し上げます。
私は MD 計算を用いて一本鎖抗体の変性起点領域を特定し、その領域を安定化することで一本鎖抗体全体の熱安定性を上げることを試みています。今回はトラスツズマブ由来の一本鎖抗体の熱安定性上げた変異体の設計について発表させてもらいました。
私は当研究室で MD 計算を用いた解析の立ち上げに携わってきました。最初は各ソフトウェアの使い方から勉強をはじめ、実際に計算ができるようになってからはどのように解析するかを試行錯誤してきました。元々 wet の研究室なので wet の視点を大事にしながら解析を行い、こうして発表できるまでになりました。今回の発表では MD 計算の専門家の方々とお話しさせていただき、今まで自分にはない新たな視点からの指摘をしていただきとても貴重な体験でした。また、MD 計算をやっていない wet の研究室の方々からも様々な質問をしていただき、興味を持っていただけたことは非常に嬉しいです。今回の経験を活かしてさらに成長していきたいと思います。
最後になりますが、これまで指導してくださった森岡弘志教授をはじめとする研究室の先生方ならびに関係者の方々に心から御礼申し上げます。
2P-87 三本 斉也(総合研究大学院大学)

この度は第21回日本蛋白質科学会年会のポスター賞に選出していただきましたことをとても光栄に思います。
今回の受賞はひとえに共同研究者の村田グループのみなさま、そしてご指導・ご支援いただきました古賀グループのみなさまのおかげと存じます。この場を借りて深く感謝申し上げます。
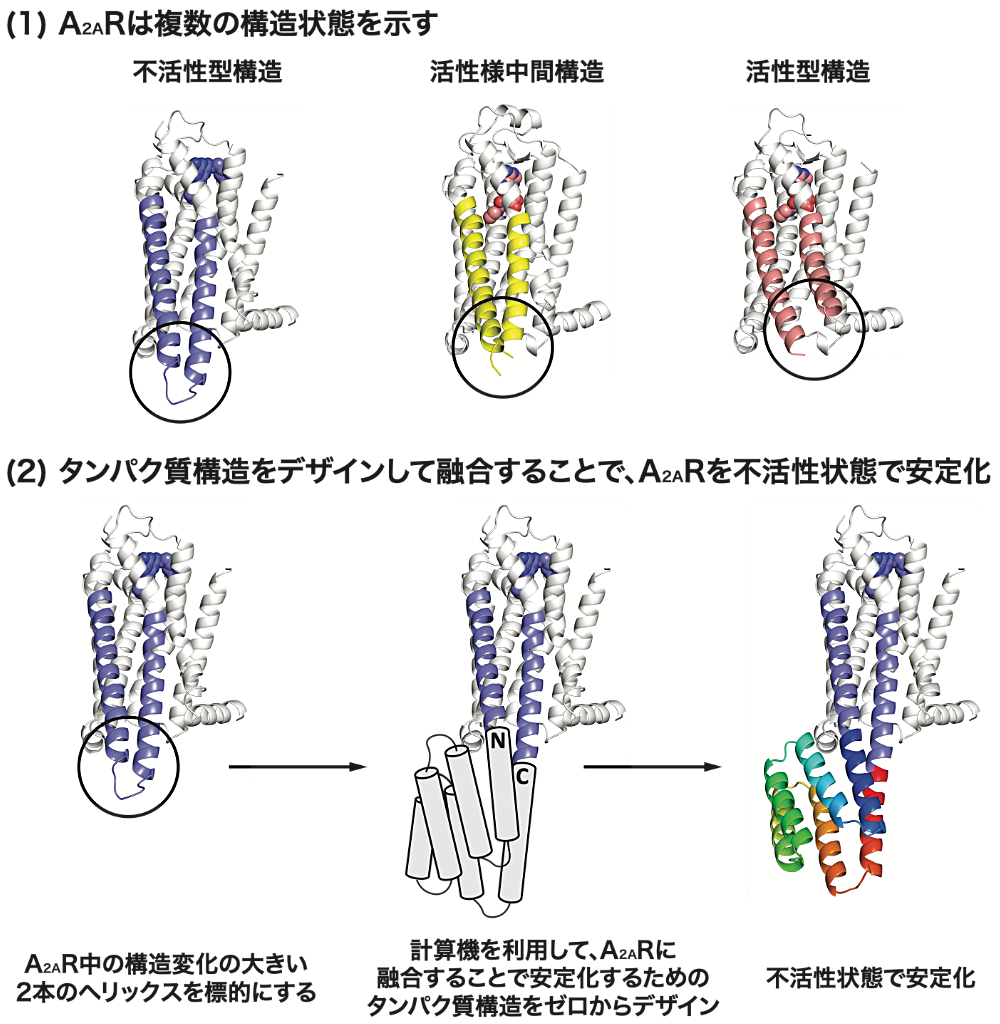
GPCR はヒトゲノム中最大の膜タンパク質ファミリーであり、承認されている医薬品のおよそ3割が標的としている創薬標的です。しかしながら一般に不安定なことが知られています。
そのため様々な安定化法が開発されてきており、よく用いられる方法のひとつに GPCR 中で不安定な領域として知られる細胞内第3ループを異種タンパク質ドメインで置き換える方法が取られてきましたが、融合に用いるタンパク質およびその挿入位置は実験により試行錯誤で適切なものを探索する必要がありました。また、この細胞内第3ループでつながれた2本のヘリックスは状態の遷移に伴って大きく構造変化することが知られています。
そこで我々はよく調べられている GPCR の一種、アデノシン A2A 受容体(A2AR)の不活性型構造を狙って安定化するための、超安定な融合パートナータンパク質を計算機を用いてゼロからデザインして融合することで、合理的に不活性状態を狙って A2AR を安定化しました。本手法はタンパク質を状態選択的に安定化する新たな方法を提案するものです。
受賞を励みにこれからも研究に努め、蛋白質科学および蛋白質工学に貢献できればと思います。