本年度第20回年会における若手奨励賞受賞者の方から原稿をいただきましたのでここにお知らせします(演題番号順)。
日本蛋白質科学会 役員会
YSA-03 島田 敦広(岐阜大学)

この度は若手奨励賞をいただき、大変光栄に存じます。
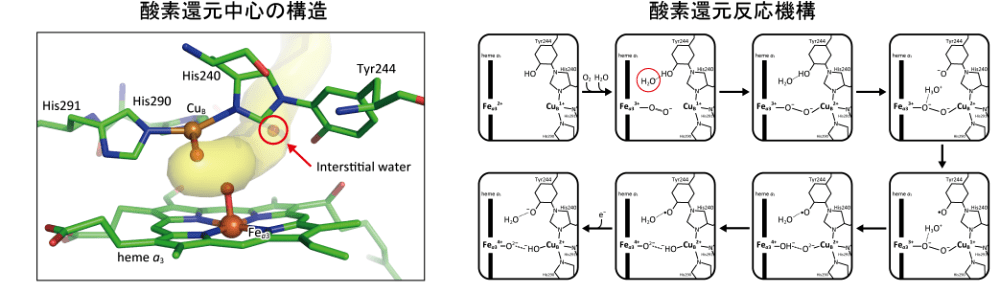
私たちのグループでは、ミトコンドリア呼吸鎖の末端酵素であるシトクロム酸化酵素(CcO)について研究を行なっています。CcO は酸素を水へと還元する反応と共役して、プロトンをミトコンドリアマトリクスから内膜外へと能動輸送します1995年にウシ心筋由来 CcO の X 線結晶構造が初めて 2.8 Å 分解能で報告されてから、現在では 1.5 Å 分解能を超える結晶構造や、X 線自由電子レーザーを用いた時分割構造も報告されるようになりました。しかし、CcO の反応機構にはいまだ多くの謎が残されています。その1つが、酸素還元過程で生まれる過酸化物(O22-)の迅速な分解機構でした。CcO の酸素還元中心は2つの金属イオン(Fea3 (heme a3), CuB)を持ち、結合した酸素は容易に2電子還元されると考えられてきましたが、その反応過程において O22- は全く検出されてきませんでした。本研究では、2つの CcO 反応中間体構造を 1.8 Å 分解能で決定することに成功し、酸素還元中心にアクセス可能な水分子の存在を初めて明らかにしました。この水を介することでプロトンが酸素へ迅速に供給され、O22- の存在を検出できないほど迅速に分解していることが示唆されました。今後、他の中間体構造も明らかとなることで、CcO の反応機構の理解を深める情報がさらに得られることが期待されます。
末筆ではありますが、本研究を遂行するにあたりご指導賜りました𠮷川信也教授(兵庫県立大学)、月原冨武教授(大阪大学)に心より感謝申し上げます。
YSA-04 出村 奏恵(東京大学)

この度は第20回年会におきまして日本蛋白質科学会若手奨励賞を頂き、大変光栄に存じます。札幌での現地開催は中止となってしまいましたが、代わりに web 開催という形で発表の機会を設けて頂き、ありがとうございました。
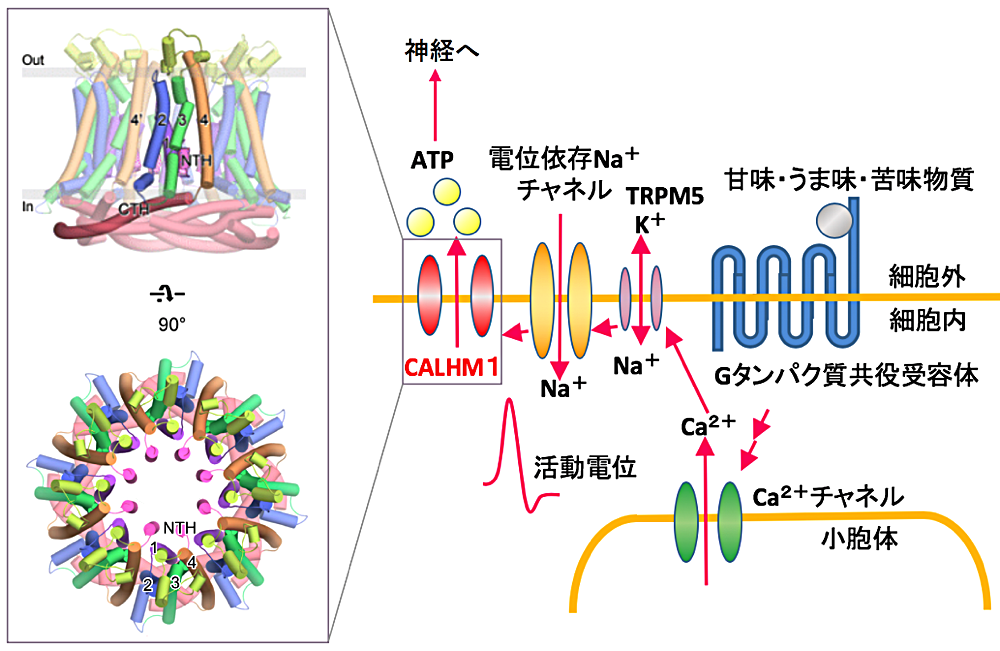
本研究では、甘味・うま味・苦味物質の認識に必須のチャネルである CALHM1 と、そのファミリーの立体構造をクライオ電子顕微鏡を用いた単粒子解析によって解明し、CALHM1 の ATP 透過機構および CALHM ファミリーの多量体化メカニズムを明らかにしました。
ヒトを含む多くの哺乳類は、甘味・うま味・苦味・酸味・塩味といった基本味を、舌に存在する味蕾を用いて認識しています。このうち、甘味・うま味・苦味は味蕾細胞の細胞膜に発現する G タンパク質共役受容体によって受容され、細胞内のシグナル伝達カスケードを活性化し、最終的に神経伝達物質である ATP がチャネルを通って細胞から放出されることで、味神経へ味覚情報を伝達します。この ATP 放出過程に必須となるのが、イオンチャネルの一つである CALHM1 です。
今回明らかにした CALHM1 の立体構造から、N 末端のαへリックスが ATP の放出において重要な機能を果たしていることが示唆されました。また、ホモログやそれらのキメラタンパク質の立体構造から、CALHM ファミリー間で異なる量体数が存在し、その量体数の規定には膜貫通ドメインでの相互作用が寄与することが明らかとなりました。
本研究を行うにあたりご指導いただいた濡木教授、西澤助教、草木迫助教、志甫谷特任助教をはじめとする濡木研究室の方々、及び共同研究者の方々に心より感謝申し上げます。本当にありがとうございました。
YSA-06 三輪 つくみ(東京工業大学)

この度は若手奨励賞を賜り、光栄に思います。
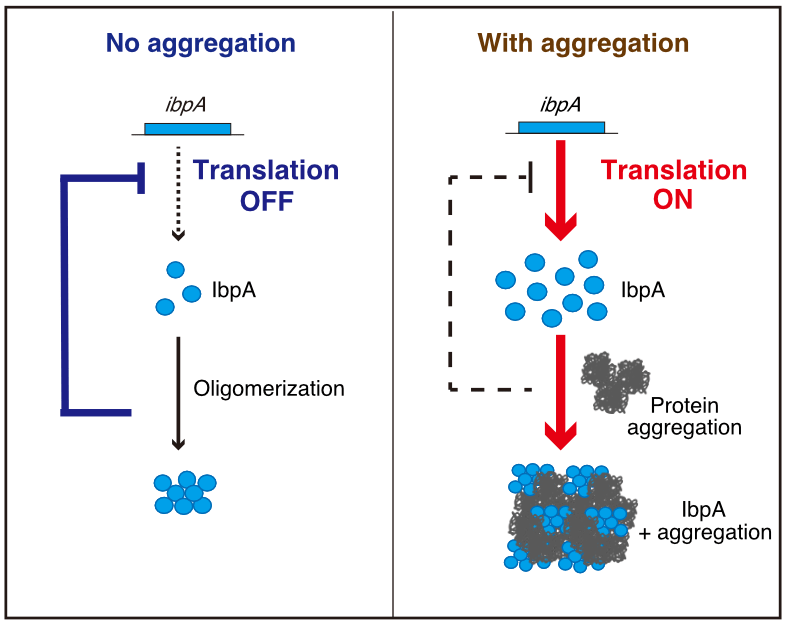
私の研究は、低分子熱ショックタンパク質(sHSP)の新しい発現制御を見出したというものです。sHSP は変性タンパク質と共凝集し、隔離されることで役割を果たす、触媒活性などを持たないシャペロンの一種です。これまでバクテリアの sHSP は高温依存的に翻訳が行われることが知られていましたが、本研究では大腸菌の sHSP である IbpA が、細胞内の凝集体蓄積を感知して温度非依存的にも翻訳が促進されるということを示しました。また、その制御は IbpA による自身の翻訳抑制が中心的機構であることが明らかとなり、このことから IbpA の変性タンパク質との共凝集は遊離の IbpA の枯渇を介して自身の翻訳抑制を解除し、不足した分を翻訳によって補うという制御モデルを提案しました。
本研究は IbpA の共凝集というシャペロンとしての機能が、自身の発現制御の鍵となっていることを示したものです。この新たに明らかとなった意外な役割について、今回の賞を励みに今後も解析を続けていくつもりです。
YSA-07 今村 比呂志(立命館大学)

この度は若手奨励賞に選考していただき、大変光栄に思います。そして COVID-19 によって通常の年会が出来ない中、オンラインで本賞の講演会を開催していただいたことにつきまして、学会の皆様に感謝申し上げます。
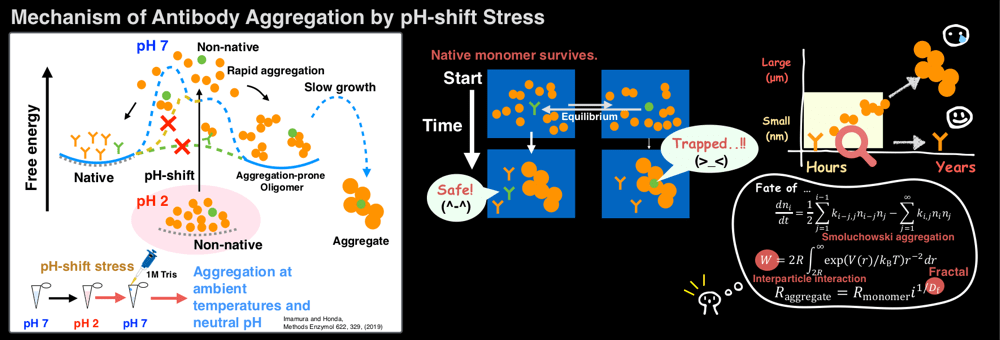
私は今回「Mechanism of Antibody Aggregation by pH-shift Stress」のタイトルで発表をしました。pH シフトストレス(pH を酸性から中性へ変化させる方法)を用いることで、加熱せずに中性の pH、室温付近での抗体の凝集を観測することができ、それがスモルコフスキー凝集式に従うこと、さらにバイオ医薬品の保管条件に近い条件での凝集を予測できることを紹介しました。
学生時代、産業技術総合研究所の本田真也博士が創製した人工蛋白質シニョリンの研究に感銘を受けました。幸運なことに2014年に本田グループに加わることができ、そこで参画したプロジェクトが抗体医薬品に含まれる異常構造(変性・凝集)分子の検出でした。本田グループでは異常構造抗体に選択的に結合するシニョリン骨格ベースの人工設計蛋白質の創製に成功しており、様々な検出系の開発を進めていました。しかし、検出する相手について「そもそも抗体はどのように変性し凝集するのか?」という点を理解していないと何をどう検出しているのかわからないということで、私がこれに取り組むことになりました。
抗体の凝集はアモルファスであり、ぐちゃぐちゃとしています。二十数年来、蛋白質凝集の研究はアミロイド線維形成メカニズムを中心に進められており、アモルファスのような不定形な凝集のメカニズムといっても何にどう取り組んでいいか初めはわかりませんでした。私は以前、千葉大学の西川惠子・森田剛研究室で石油の研究に携わったとき、石油に含まれる不純物のアスファルテンという凝集成分がフラクタルであったことを思い出しました [https://doi.org/10.1021/acs.energyfuels.5b01491]。フラクタルは樹木やリアス式海岸のように、小さな領域をみても大きな領域をみても相似性があるものをいいます。すなわち、一見ぐちゃぐちゃに見える凝集体もフラクタルの視点から共通性を見出せる可能性があります。実際、光散乱や電子顕微鏡観察から抗体の凝集がフラクタルであることを示すデータを得ることができ、メカニズムを知る大きな手がかりとなりました。
天然の蛋白質が自己凝集を避けることは「ふつう」のことですが、そのような人工蛋白質を作ることは容易ではないことから、とんでもなく難しい「ふつう」であり、分子進化の産物であると考えられます。凝集という現象は突き詰めると、二つの粒子が近づいたときに会合しやすいかどうか?ということです。これは分子間ポテンシャルで表現され、凝集の速度定数や溶液中の分子分布と関係付けられます。私はこの点に興味を持ち、以前より蛋白質の分子間ポテンシャルを小角 X 線散乱で観測する研究を進めていました [https://doi.org/10.1107/S0909049513022772]。抗体の凝集の速度がスモルコフスキー凝集式に従うことから、この理論式にフィッティングすることで、実験データから凝集速度定数、すなわち凝集しようとする分子間のポテンシャルの情報を得ることができます。これは凝集性を分子論的に議論する上で大変有意義ですし、凝集を予測するためのフレームワークにもなります。最近は分子間ポテンシャルの問題について、クジラが陸生から水生へ進化する過程で筋肉中に高濃度のミオグロビンを貯蔵できるようになったことがヒントになるだろうと、ミオグロビンの進化と分子間ポテンシャルの関係を研究しています [https://doi.org/10.1038/s41598-018-34984-6]。これらもバイオ医薬品の抗凝集性を向上させる方法論の構築につながっていくと考えています。
少し脱線してしまいますが、2018年の夏にポーランドのクラクフへ行く機会があり、スモルコフスキー博士のお墓参りをしようと考えました。ラコヴィツキ墓地は大変広く、一つ一つ墓標に “SMOLUCHOWSKI” がないかと見て3時間程歩き回りましたが見つからず、もう諦めようと出口に出たとき、著名人のお墓の位置を示す看板に “Smoluchowski” さんの名前と位置(34番)を見つけました。近くにはお花屋さんがあり、そこで無事、お花と感謝を届けることができたのが思い出です。
本研究は現在も続けており、思い入れのあるテーマとなりました。最後に、本研究のきっかけをくださった共同研究者の本田真也博士(産業技術総合研究所)に感謝申し上げます。また、この場をお借りしてこれまでお世話になりました皆さまに感謝をお伝えしたいと思います。