本年度第18回年会におけるポスター賞受賞者の方にコラムを寄稿いただきましたので、掲載致します(演題番号順)。
日本蛋白質科学会 役員会
1P-004 郡 聡実(横浜市⽴⼤学)

この度はポスター賞という身に余る賞を頂き、大変光栄に存じます。
我々の研究室では X 線結晶構造解析をはじめとする構造生物学的な観点から、エピジェネティクスの分子機構の解明を目指しています。特に DNA メチル化に着目して、その情報が分化した細胞で正確に継承されていく機構の解明を目指しています。DNA メチル化の維持に必須のタンパク質である UHRF1 の TTD ドメインは、ヒストン H3K9me3 を認識することが知られています。我々は近年、複製因子である DNA ligase1(LIG1)と TTD との結合が DNA 維持メチル化を制御する重要な相互作用であることを報告しました。メチル化された LIG1 は TTD と非常に強く結合しますが、この高親和性結合の構造基盤は不明でした。本ポスター発表では、TTD ドメインと LIG1 ペプチドとの複合体の結晶構造を決定し、立体構造情報を元にした変異体解析から、TTD と LIG1 の高親和性結合に重要なアミノ酸残基を同定しました。さらに、X 線溶液散乱や高速 AFM によって、メチル化された LIG1 の結合が UHRF1 の高次構造を変化させ、この高次構造の変化が UHRF1 の機能制御に重要であることを明らかにしました。
今回のポスター賞を励みに、今後も構造生物学の研究手法を駆使して、エピジェネティクスの継承の分子機構という重要な生命現象の解明に貢献していきたいと思います。最後になりましたが、指導教員である有田恭平准教授、また審査員の先生方をはじめとする学会関係者の皆様にこの場をお借りして御礼申し上げます。
1P-010 Ganasen Menega(兵庫県⽴⼤学)

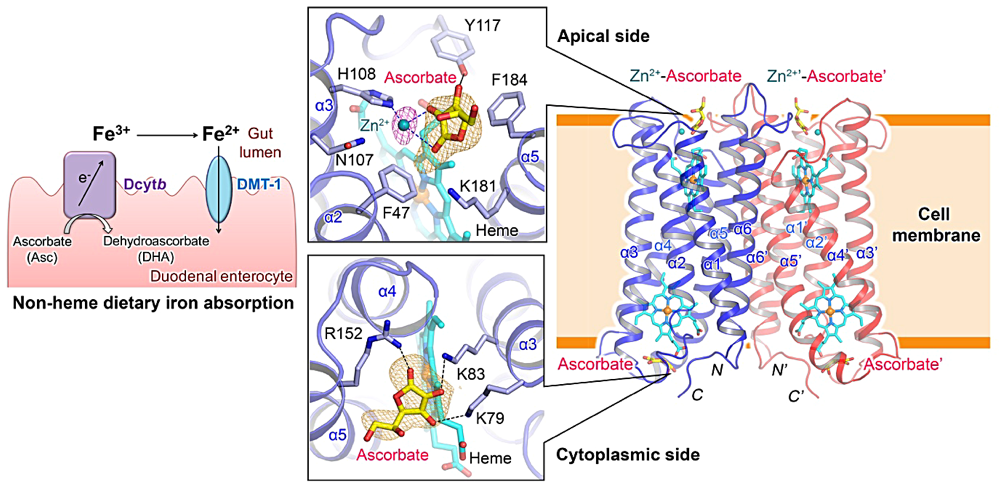
I am delighted upon receiving the poster award in the 18th Annual Meeting of Protein Science Society. In this meeting, I presented my poster entitled “structural insight into the dietary non-heme iron absorption in human duodenum”.
Human body losses 1-2 mg of iron every day, through desquamation and minor blood loss. This loss is maintained by 1-2 mg of daily dietary iron intake. The failure to compensate this loss lead to iron deficiency anemia, the most widespread micronutritional disorder worldwide today. I was particularly interested in understanding dietary iron absorption. Non-heme iron naturally occurs in the insoluble Fe3+ form, whereas Divalent Metal Transporter-1 (DMT-1), the metal transporter in human duodenum can only transport iron in the Fe2+ form. Hence, the reduction of Fe3+ to Fe2+ is the key step for efficient non-heme iron absorption. My research objective was to elucidate the mechanism of Fe3+ reduction by Duodenal cytochrome b (Dcytb). I solved the crystal structure of human Dcytb, an ascorbate-dependent Fe3+ reductase, in the ascorbate and metal ion bound form. The crystal structure revealed a unique binding of metal-ascorbate complex on the gut lumen side, where ascorbate acts as a metal chelator, thereby stabilizing the metal binding to Dcytb. Furthermore, in vivo yeast functional assay showed increase in Fe3+ reductase activity in the presence of other natural dietary iron chelators, like citrate and malate. These findings can facilitate the development of structure-based strategies for promoting the reduction of dietary iron and thereby improve dietary iron absorption.
Finally, I would like to thank my supervisors and all lab members for their support and encouragement throughout my research. This was definitely one of the most memorable moment.
1P-055 河出 来時(東京⼤学)

この度は第18回日本蛋白質科学会にて、ポスター賞を頂き誠に嬉しく思います。関係者の皆様、共同研究先のAbwizbio様、津本教授をはじめ、指導して頂いた先生方に、心より感謝申し上げます。
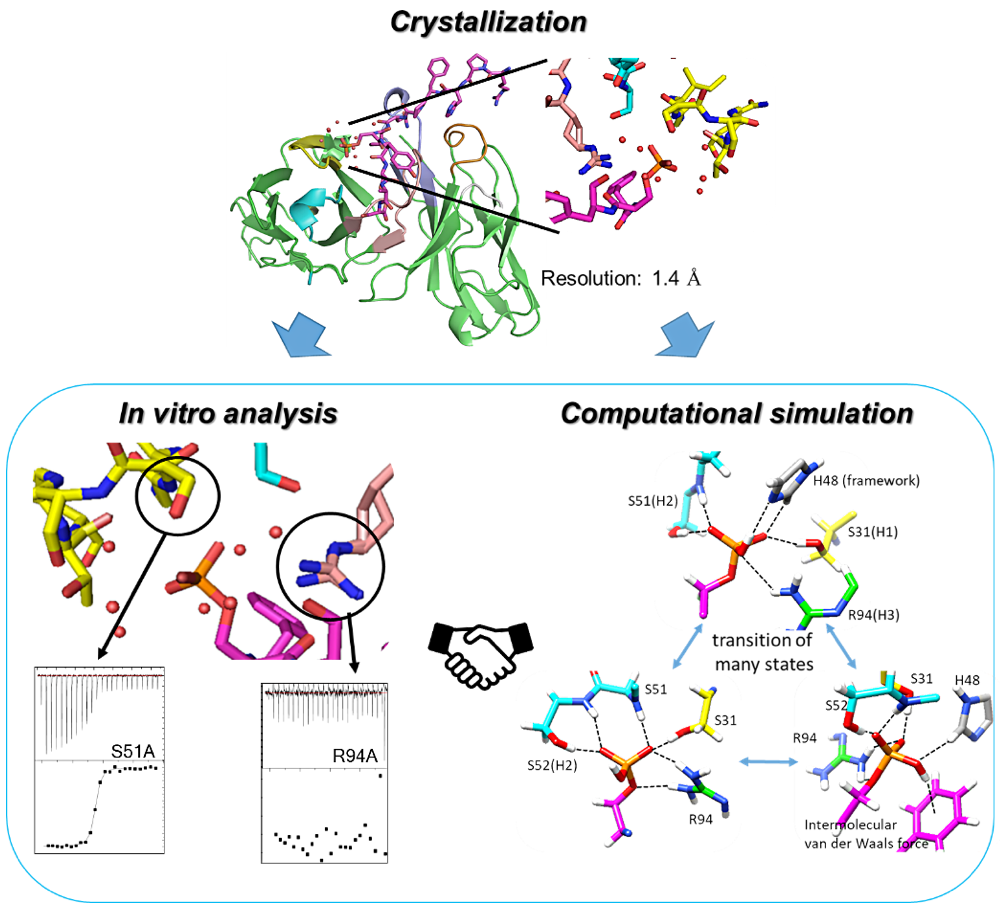
抗体は、その高い特異性と親和性から、研究試薬から分子標的医薬まで広く応用されています。一方、蛋白質のリン酸化は様々なシグナル伝達を制御する重要な翻訳後修飾の1つです。特定蛋白質のリン酸化の検出にも、しばしば抗体医薬が用いられます。しかし、高いリン酸基特異性を担保した抗体の作製は難しく、診断薬等に用いるまで磨くには、抗体のリン酸基認識機構を解明し、新たなデザイン設計指針の確立が必要になります。
私は、抗体のリン酸基の状態機構を、抗原複合体の X 線結晶構造解析・ITC による変異導入解析・分子動力学計算を用いて調べました。結果、結晶ではリン酸基に直接結合している残基は2つのみであったにも関わらず、シミュレーション中では6つもの残基が交代で結合する大規模な機構であることが示唆され、結晶では確認されなかった重要な残基(Hidden-HotSpot)を発見することに成功しました。更に、4つのリン酸基を認識する天然の蛋白質でも分子動力学計算を行ったところ、この大規模な認識機構は抗体固有なものであることが明らかとなりました。
今後は、本研究で明らかになった認識機構に基づき、リン酸基認識抗体の設計指針の探索を行っていく予定です。
1P-074 妹尾 暁暢(東京⼤学)

この度は第18回日本蛋白質科学会にてポスター賞を賜り、誠に光栄に思います。まずはこの場をお借りして、学会関係者の皆様、ご指導いただいている津本浩平先生、長門石曉先生、共同研究先の先生方、研究室の皆様に厚く御礼申し上げます。
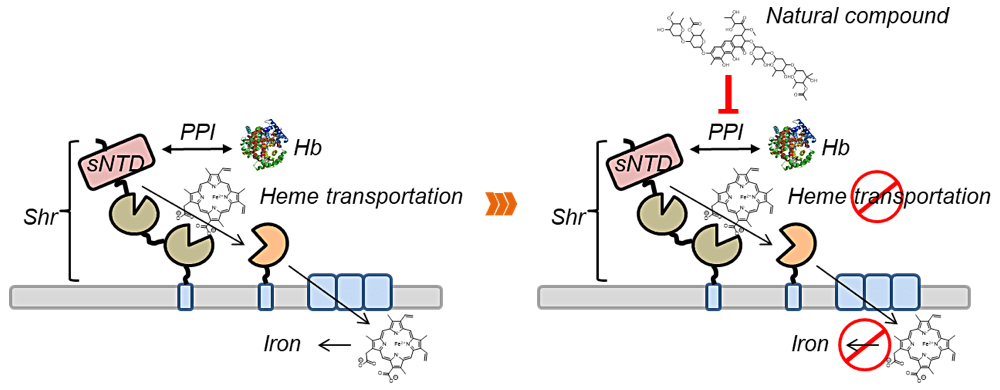
ポスター発表では、化膿連鎖球菌が宿主感染時に用いる鉄獲得システムの起点となる、細胞表層蛋白質 Shr とヘモグロビンの蛋白質間相互作用(Protein-protein interaction,PPI)を標的として、その PPI 阻害剤の探索に関する報告を行いました。今回は特に、「天然物化合物ライブラリーから SPR を活用して」というテーマを掲げ天然物化合物の PPI に対する作用を物理化学的に検証しました。その結果、様々な分子サイズ、骨格を持つ化合物が PPI 阻害活性を示しました。多様な構造を持つヒット化合物の阻害機構を考察することで、標的 PPI の結合様式、有効な阻害戦略が明らかになりつつあります。今後はヒット化合物の構造活性相関を追求し、より高活性な化合物の取得や抗菌剤としての応用も指向した抗菌試験を行う予定です。
私たちの研究対象である PPI は、細胞内外で綿密なネットワークを形成し、分化・生存・増殖・死と深い関わりを持っています。その PPI 制御剤の開発は、疾患関連蛋白質に対する分子標的薬のみならず、機能未知の蛋白質に対するプローブとしても応用できると言われています。私たちは今後も創薬基盤の構築を目指して PPI 制御剤の探索・最適化に関する研究を展開していきます。
1P-078 吉田 浩平(東京大学)

この度、第18回日本蛋白質科学会ポスター賞にお選び頂き、誠にありがとうございました。心より御礼申し上げます。
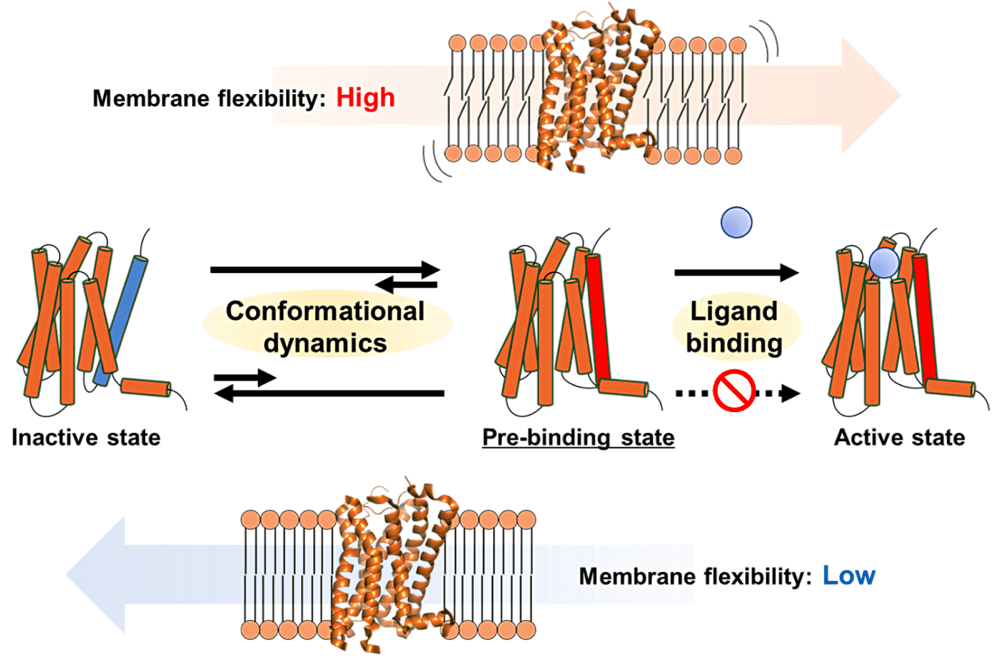
私共の研究は、GPCR の一種であるヒトセロトニン受容体 2B(5HTR2B)に対して Nanodisc 技術を駆使し、物理化学的な物性を詳細に議論することを試みております。本発表では、異なる脂質組成を用いて調製した 5HTR2B-Nanodisc に対する基質結合測定を SPR や MST を用いて行い、5HTR2B を取り囲む脂質の物性によって基質の結合活性に差が現れることを見出しました。さらに、私共はこの違いを詳細に議論するために MD シミュレーションを利用し、脂質膜中での 5HTR2B の構造的ダイナミクスが基質結合の際に重要であることを明らかにいたしました。本研究成果はこれまでの結晶構造から得られる静的状態の情報に加えて、基質結合に関わる遷移状態の重要性を強く示唆する内容と考えております。今後は本研究で得られた知見を活かすことのできる創薬展開を目指したいと考えております。
最後に、本学会関係者の皆様に心より感謝申し上げます。本学会において皆様と非常に有意義な議論を重ねることができ、貴重な経験を得ることができました。また、本研究を進める上で多大なご指導を賜りました津本浩平教授、長門石曉特任准教授にここに感謝申し上げます。
1P-090 平山 千尋(東北大学)

この度は2年連続でポスター賞を頂くことができ、驚きとともに大変光栄に思っています。自身の研究に対し多くの方に興味を持っていただき、そして熱い議論ができた結果、頂けた受賞だと思っています。今後とも自分の探求心を大切にしつつも、サイエンスを楽しみたいと思います。
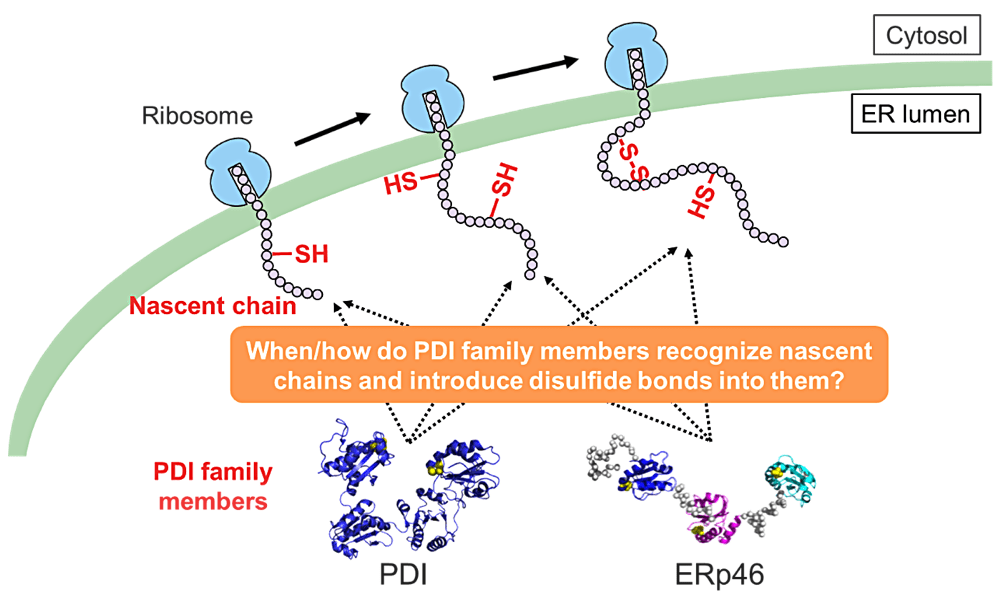
簡単に研究内容を紹介させていただきます。細胞内でのジスルフィド結合形成はリボソームによる翻訳合成および小胞体膜の膜透過とカップルして Protein Disulfide Isomerase(PDI)ファミリー酵素により触媒されることが明らかになりつつありますが、新生ポリペプチド鎖(新生鎖)の合成プロセスのどの段階でどのような作用機序のもとPDIファミリー酵素が触媒しているかは未解明です。そこで私は、自身が開発したジスルフィド結合導入モニタリングアッセイ系を用いて PDI ファミリー酵素である PDI と ERp46 が新生鎖にジスルフィド結合を導入する経時変化を観測することに成功しました。さらに、PDI と ERp46 が新生鎖と結合する様子を一分子レベルで可視化するために高速原子間力顕微鏡を用いた一分子観察を行い、重要な知見を得ました。今後はより深く研究を行うことで、両酵素の異なる新生鎖の認識機構、ジスルフィド結合導入能を明らかにしたいと考えています。
最後になりましたが、指導教員である稲葉教授をはじめとする稲葉研究室の皆様、共同研究先である兵庫県立大学の今高教授、町田助教、熊本大学の小椋教授、野井助教に、この場をお借りして厚く御礼申し上げます。
1P-096 尾山 博章(大阪大学)

この度は第18回日本蛋白質科学会ポスター賞を受賞でき、大変光栄に思っております。審査員の先生方、並びに年会の運営関係者の皆様にお礼申し上げます。
私は抗体医薬品の処方検討を合理的に行うことを目的として、抗体を溶液で保存する際の溶媒条件がどのように抗体へ影響を与えるかについて研究しています。抗体は凝集体を生成すると免疫原性を持ち副作用の原因となるため、抗体医薬品は凝集体の生成を抑えて安定に保存することが必要になります。
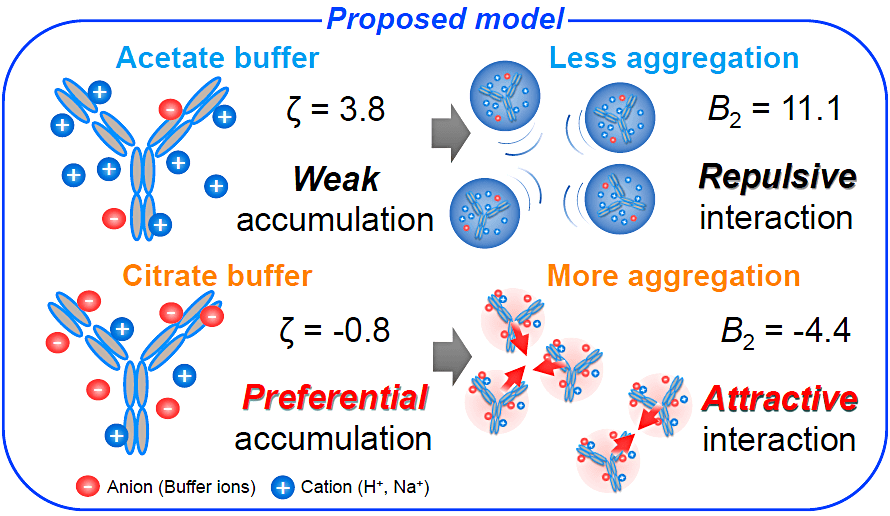
今回のポスター発表では実際の抗体医薬品でよく用いられる酢酸緩衝液およびクエン酸緩衝液を比較し、凝集性を左右する要因を抗体の分子メカニズムとしてまとめさせていただきました。クエン酸における抗体の高い凝集性は、クエン酸イオンの優先的な蓄積により抗体の持つ電荷が減少し、分子間に引力が作用した結果であるとわかりました。
今後の展開として、今回の緩衝液の比較だけでなく塩濃度や糖濃度を変化させたり、添加物を加えたり、またそれらを組み合わせたりと、より複雑な処方条件でも実験を行いたいと考えています。
最後になりましたが、日ごろから愛情こめて私にご指導いただいている内山進先生をはじめ、研究室の皆様にこの場をお借りして厚く御礼申し上げます。
1P-123 志賀 翔多(⼭形⼤学)

蛋白質の構造を初めて目にした時、とても綺麗だなと思いました。そんな蛋白質を、見るだけでなく、自分の手でいじってみたいとも思ったため、蛋白質デザインを専門とする真壁研究室を選びました。
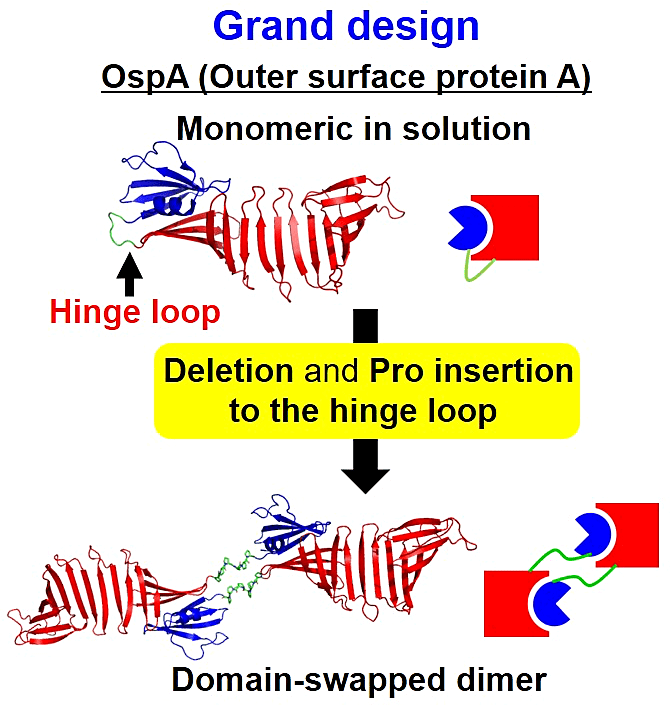
現在、私が行っている研究は、球状蛋白質のヒンジループのリデザインによるドメインスワッピング多量体の作製です。単量体として存在する蛋白質のヒンジループのリデザインによるドメインスワッピング多量体の作製は成功例が少なく、一般的なデザイン指針は確立されていません。今回私達は、溶液中で単量体として存在する Outer surface protein A(OspA)をモデル蛋白質とし、ヒンジループのデザインを詳細に検討しました。デザインの結果、C 末端ドメイン中のヒンジループの短縮とその短縮部位に対する数個のプロリンの挿入により、OspAの二量体化に成功しました。挿入するプロリンの個数によって生じる二量体の量が変化する事を見出しました。作製した二量体のいくつかについて結晶構造解析にも成功し、得られた二量体はドメインスワッピングしていることが分かりました。これらの結晶構造から、二量体が優勢に存在する変異体のポリプロリン部分が、ポリプロリン II ヘリックスを形成していることが分かりました。以上の結果から、単量体として存在する蛋白質のヒンジループの、ポリプロリン II へリックスへのリデザインにより、ドメインスワッピング二量体を合理的に作製出来る可能性を示すことが出来ました。
蛋白質は、私達の生活を豊かにする無限の可能性を秘めていると思います。今回の受賞を励みにし、蛋白質を自在にデザイン出来る世の中の実現に向けて、今後も研究を楽しんでいきたいと思います。
1P-125 渋江 怜(早稲⽥⼤学)

この度は第18回日本蛋白質科学会年会において、ポスター賞を頂くことができ、大変光栄に思っております。常日頃から真摯にご指導して下さる赤沼哲史准教授には、この場をお借りして厚く御礼を申し上げます。
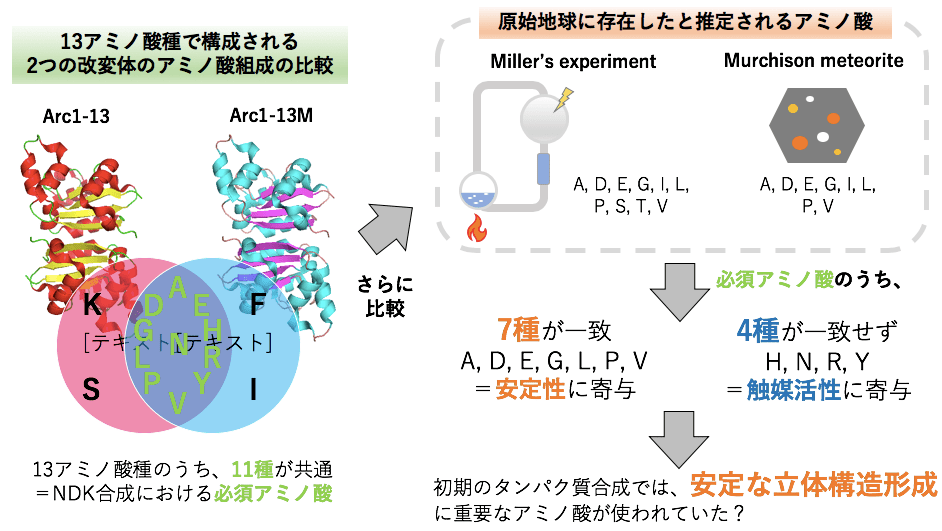
私は40-38億年前に地球上に誕生した生物の姿の推定を、タンパク質の復元と解析によって試みています。
現存の地球上のほとんどの生物は20種のアミノ酸を用いてタンパク質を合成していますが、初期の生物が何種類の/どのアミノ酸を用いてタンパク質を合成していたのかは判明していません。また、初期の生物は20種未満のアミノ酸を用いてタンパク質を合成していた可能性が指摘されています。
それゆえ、ヌクレオシド二リン酸キナーゼという酵素から、1種あるいは複数種のアミノ酸を欠損させ、20種未満のアミノ酸で構成された改変体を合成し、変性温度と比活性を測定しました。
最終的に、13アミノ酸種から構成されるものの、高い変性温度と有意な比活性を示した2つの改変体(Arc1-13、Arc1-13M)を得ました。そして、それら2つの改変体のアミノ酸組成を比較した結果、11アミノ酸種が共通しました。
その11アミノ酸種のうちの7アミノ酸種(Ala、Asp、Glu、Gly、Leu、Pro、Val)はタンパク質の安定な立体構造形成に寄与し、残りの4アミノ酸種(His、Asn、Arg、Tyr)は触媒活性に重要であることがわかりました。
さらに、安定性に関わる7アミノ酸種は、ミラーの実験およびマーチソン隕石から検出された、原始地球に存在したと推定されるアミノ酸種と一致したことから、本研究結果は「初期のタンパク質合成では安定な立体構造形成に重要なアミノ酸が用いられていたのではないか」という考えを支持するものとなりました。
今回の受賞を糧に、今後もタンパク質の研究によって、地球最古の生物の姿を明らかにすべく日々精進していく所存です。

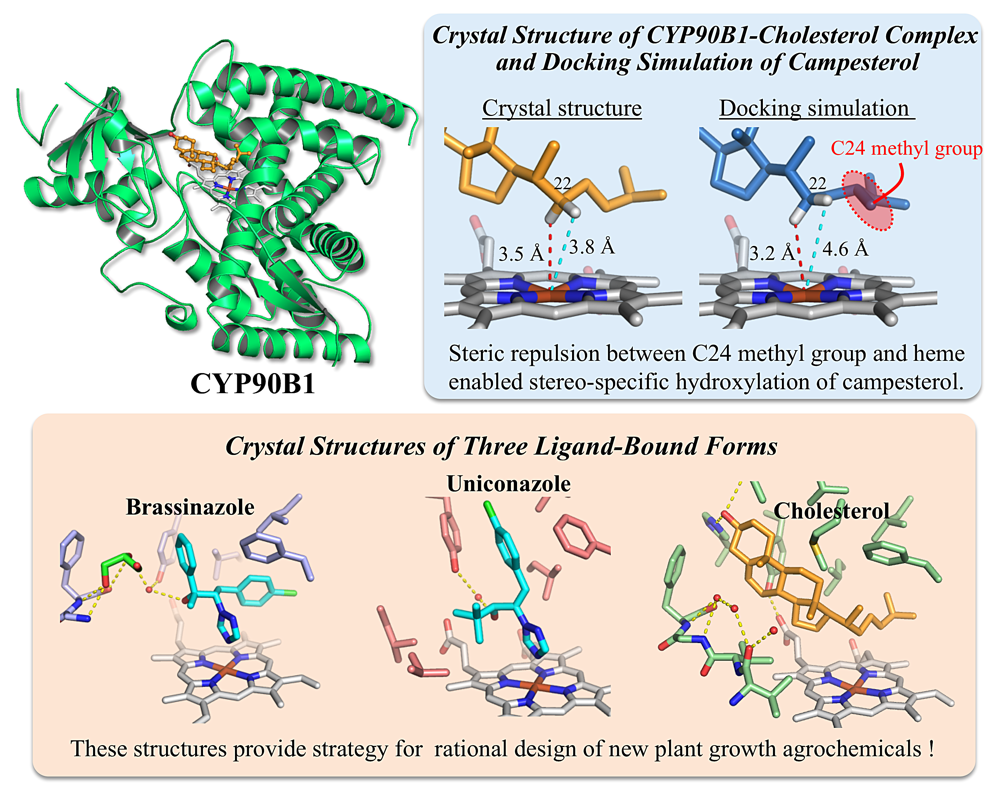
2P-015 藤⼭ 敬介(⿃取⼤学)

ブラシノステロイド(BR)は植物の伸長成長を促す重要なステロイドホルモンです。本研究対象の CYP90B1 は BR 生合成における鍵酵素であり、本酵素が触媒する位置・立体特異的な水酸化は植物生理学的に重要な反応であることが知られています。また、CYP90B1 の阻害剤は、植物の成長を制御できる農薬としての利用が期待されていますが、植物由来の膜結合型 P450 の立体構造の報告例がないため、安価で特異性の高い阻害剤の開発が難しい現状を抱えています。
本研究では、コレステロール結合型 CYP90B1 の結晶構造を決定し、ドッキングシミュレーションを実施しました。その結果、基質のカンペステロールでは、コレステロールにはない C24 位のメチル基とヘムとの間に立体障害が発生することで、位置・立体特異的な水酸化が起こることを明らかにしました。
また、本研究では2つの阻害剤結合型 CYP90B1 の結晶構造も決定し、詳細な阻害剤の結合様式を明らかにしました。しかし驚いたことに、2つの阻害剤の分子構造は類似しているにもかかわらず、その結合様式は異なっており、タンパク質の構造が大きく変化していました。今回明らかにした構造情報は、新規 BR 生合成阻害剤の開発に役に立つと考えられます。
今回頂いた賞を励みに、今後の研究に取り組んでいきたいと思います。
2P-086 ⾼瀬 安迪(奈良先端科学技術⼤学院⼤学)

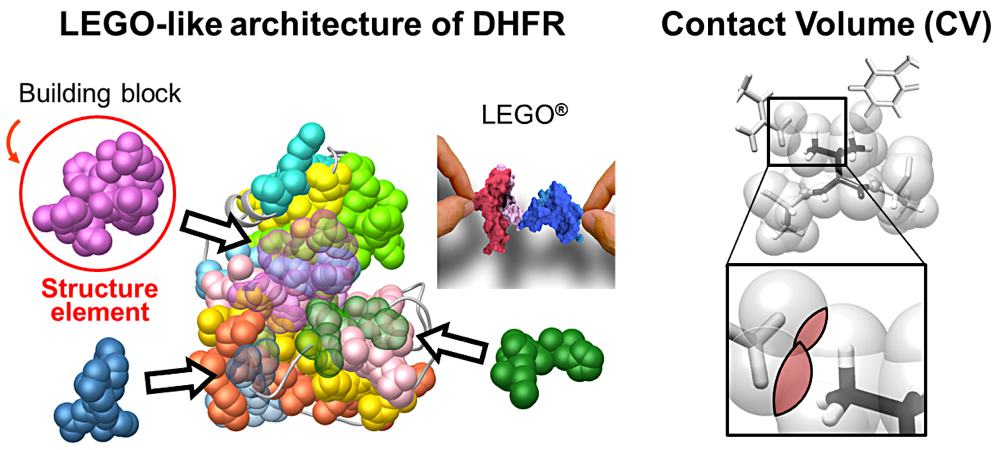
この度は、第18回日本蛋白質科学会年会においてこのような素晴らしい賞を賜り、大変光栄に思います。
所属研究室では、これまでにアミノ酸配列に記述された構造形成に関わる情報の抽出を目的として、網羅的アラニン挿入変異解析を開発してきました。本解析により同定された構造エレメントは立体構造形成に必須の領域であり、構造エレメントの同定によりアミノ酸配列中の構造情報の解読が進むと期待されます。しかし、本解析には膨大な時間を要するという問題がありました。そこで、本研究では短時間での同定を実現するため、立体構造中の残基間コンタクトに着目し、アミノ酸毎のコンタクトの多寡を周囲の残基との重複体積(CV)で表すことで、CV を利用した予測法の開発を行ないました。その結果、CV プロファイルの大きな値を示す領域が構造エレメントによく一致することを見いだしました。さらに、この事実から蛋白質の安定性は構造エレメント間のコンタクトによって規定されていることが明らかとなりました。この他、折り畳み初期に形成される構造領域とよい対応関係があることもわかり、構造エレメントが広く蛋白質の物性を決定していることを予見する結果となりました。
最後に、これまで親身にご指導くださった上久保先生、山崎先生、林先生に心より感謝いたします。これを励みに今後も研究に邁進し、構造エレメントがいかにして蛋白質の立体構造を規定するのかを解明したいと思います。