本年度第18回年会における若手奨励賞受賞者の方から原稿をいただきましたのでここにお知らせします(演題番号順)。
日本蛋白質科学会 役員会
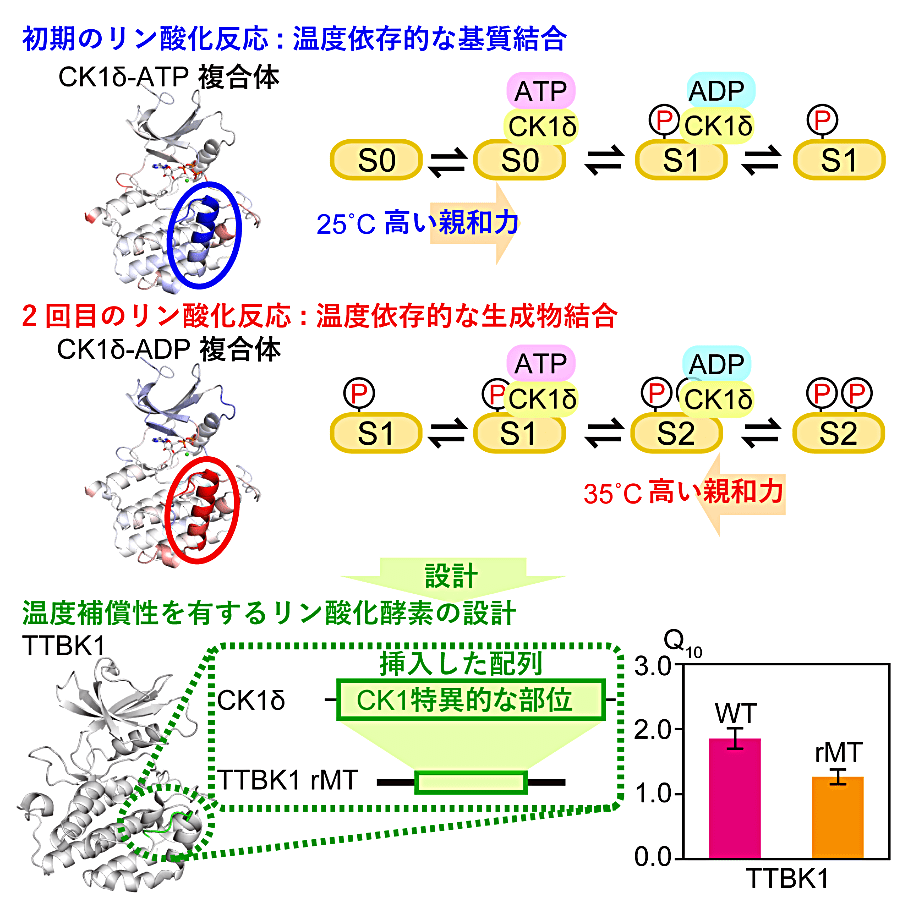
2SA-2 篠原 雄太(理化学研究所)

この度は若手奨励賞を頂き光栄です。
本研究では哺乳類概日時計の温度補償性の分子機構を明らかにしました。
温度補償性とは、概日時計の周期長が温度に依存せず、常に一定で約24時間周期を保持している生命現象です。一般的な生体内で起こる生化学反応は温度に依存して反応速度が上昇します。概日リズムも複数の生化学反応から構成されていますが、その周期長がなぜ温度に依存しないのかは大きな謎でした。
これまでにリン酸化酵素 CK1δ の時計タンパク質に対するリン酸化が、概日時計の周期長を決めており、温度に依存しないことが報告されていました。しかし時計タンパク質のリン酸化は多段階な反応を経由するため、温度に依存しないリン酸化機構の解析が難しいことが問題でした。そこで私は2つのセリン残基を含む基質を用いて、温度補償性されたリン酸化を解析できる実験系を構築しました。そして CK1δ の酵素モデルを確立して、酵素反応シミュレーションにより、温度補償されたリン酸化反応に重要な素過程を明らかにしました。さらに温度依存的なリン酸化反応をもつ酵素(TTBK1)に CK1 特異的なドメインを再構築することで、温度補償されたリン酸化反応を再構成することにも成功しました。
本研究は生体分子シミュレーション、構造生物学、ゲノム編集技術を専門とする多くの共同研究者の方々にサポートして頂きました。私一人では成し遂げられなかった結果ですので、共同研究者の方々に心より感謝申し上げます。
今後、生命現象を人工的に創ることで、原子レベルにおける作動原理の理解を個体の表現型に繋げた研究を目指していきたいです。
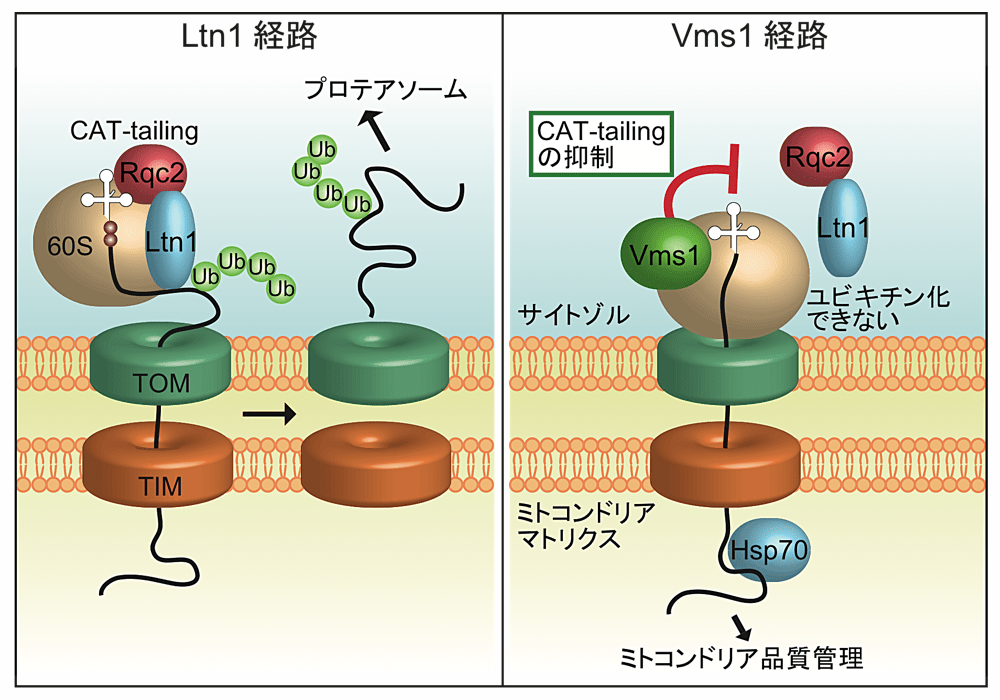
2SA-3 井澤 俊明(マックスプランク生化学研究所、ミュンヘン大学)

この度は、日本蛋白質科学会若手奨励賞を頂き、大変光栄に思います。本研究では出芽酵母を用い、真核生物に広く保存された Rqc2 というタンパク質がミトコンドリアにとって致命的な毒となることを見出しました。
Rqc2 は、サイトゾルにおいてリボソームが異常停止した時に新生ポリペプチド鎖の C 末端に複数のアラニンとスレオニンを付加する、CAT-tailing と呼ばれる反応を行う因子です。CAT-tailing は Ltn1 による異常新生鎖のユビキチン化、およびプロテアソームによる分解を促進すると考えられています。しかし、ミトコンドリアタンパク質の場合、サイトゾルにおける翻訳とミトコンドリアへの輸送が共役しているため、一部の CAT-tail 修飾を受けた異常新生鎖は分解を回避しミトコンドリアへ輸送されてしまいます。驚いたことに、ミトコンドリアへ輸送された CAT-tail タンパク質は、ミトコンドリア機能に必須のシャペロンやプロテアーゼを巻き込んで凝集し、ミトコンドリア機能不全を引き起こすことが分かりました。さらに、ミトコンドリアをタンパク質凝集から守るための CAT-tailing の阻害因子として Vms1 を同定することに成功しました。
興味深いことに、Rqc2 は真核生物だけではなくミトコンドリアが共生する前の祖先と考えられる古細菌にも保存されています。真核生物が誕生した際、Rqc2 の存在はミトコンドリアにとって大きな問題になったのではないでしょうか?Vms1 はミトコンドリア共生の過程で生じた不都合を克服するために現れたのかもしれません。
最後に、この仕事を完成させるまでサポートをしていただいた Walter Neupert 教授と Ulrich Hartl 教授にこの場を借りてお礼申し上げます。
2SA-4 ⽶原 涼(⼤阪⼤学)

この度は、若手奨励賞を賜り、大変光栄に存じます。
細胞は成長因子やアミノ酸などのシグナルに応じて自身を構成する成分の代謝制御を行っています。このような代謝では、Mechanistic Target of Rapamycin complex 1(mTORC1)が中心的な役割を担っています。mTORC1 はリソソーム膜上にて活性化され、Ragulator-RagA-C により膜上へのリクルートが制御されています。mTORC1 のリクルートには、5者複合体の Ragulator が RagA-C の足場として機能し、RagA-C の GTPase 活性の制御を行うことが重要となりますが、Ragulator による足場機能と活性制御についての詳細は不明な点が多いです。本研究では、Ragulator、および RagA-C の Roadblock ドメイン [RagA(RD)-C(RD)] との複合体のX線結晶構造解析を行い、機能解析により Ragulator 中の構成分子 p18 が複合体の形成と安定化に決定的な役割を担うことを明らかとしました。
研究を開始した当初は、なかなか結晶が析出しない、析出しても複合体が乖離した結晶であるなどの様々な問題がありましたが、複合体の安定性の改善を目指して発現コンストラクトの改良を行っていただくことで結晶化に至りました。決定した結晶構造中では、3種類のヘテロダイマー(p14-MP1,p10-HBXIP,RagA-C)が Head-to-Tail 様式で並んで配置され、外周を p18 がひも状に伸びた状態で絡みつくことで全体構造を安定化する特異な構造が明らかとなりました。機能解析の結果より、p18 の α1 ヘリックスと C 末端が Ragulator-RagA-C の構造安定化、特に RagA-C との結合に重要であることが示唆されました。そして、Ragulator-RagA-C 自体が他の GAPs(GTPase activating proteins,GTPase 活性化蛋⽩質)/GEFs(Guanine nucleotide exchange factors,グアニンヌクレオチド交換因⼦)や mTORC1 の足場として機能しているモデルの提唱を行いました。
最後に、本研究を遂行するに当たり、様々なサポートを賜りました中川敦史教授(阪大・蛋白研)と岡田雅人教授(阪大・微研)、また、高純度に精製された Ragulator と Ragulator-RagA(RD)-C(RD) の提供と機能解析実験を行っていただいた中井友和氏、中井昌弘氏、名田茂之准教授をはじめとする岡田研究室の皆様に、この場を借りて感謝と御礼申し上げます。
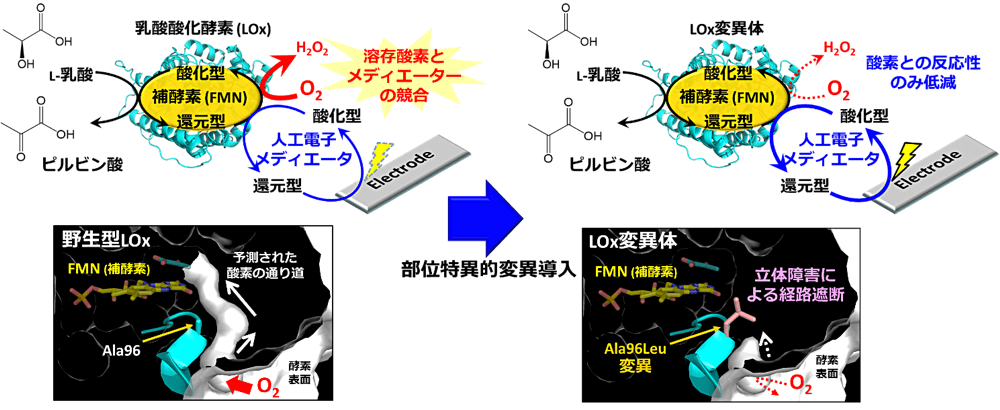
2SA-6 平賀 健太郎(東京農工大学)

この度は、日本蛋白質科学会若手奨励賞を賜り、大変光栄に存じます。
L-乳酸は医療、スポーツ、食品の品質管理などの分野において重要なマーカーとなっています。L-乳酸濃度を測定するため、乳酸酸化酵素(LOx)と人工電子メディエーターを用いた電気化学センサーが既に実用化されています。しかし、LOx の本来の電子受容体である酸素と人工電子メディエーターが LOx からの電子授受を競合し、応答電流値が変化してしまうという課題がありました。そこで私は、LOx の表面から活性中心まで達する酸素分子の移動経路を予測し、その経路を塞ぐような変異導入を行うことで、溶存酸素の影響を受けない LOx の開発を試みました。作製した変異体は LOx 本来の酵素活性を維持したまま、酸素との反応性の著しい低下が認められました。また、電極に LOx 変異体を固定し乳酸の電気化学的検出を試みた結果、溶存酸素の有無に寄らず同等の測定が可能であることが示されました。本 LOx 変異体を用いることで、より正確な乳酸センサーの開発が期待されます。
最後に、本研究を遂行するにあたり、ご指導いただきました早出広司先生(University of North Carolina at Chapel Hill)、東京農工大学 池袋・津川・浅野研究室の先生方、留学のご機会をいただきました Dr. Jeffrey La Belle、Dr. Chi-En Lin(Arizona State University)、留学をサポートしていただいたトビタテ!留学 JAPAN に深く感謝いたします。
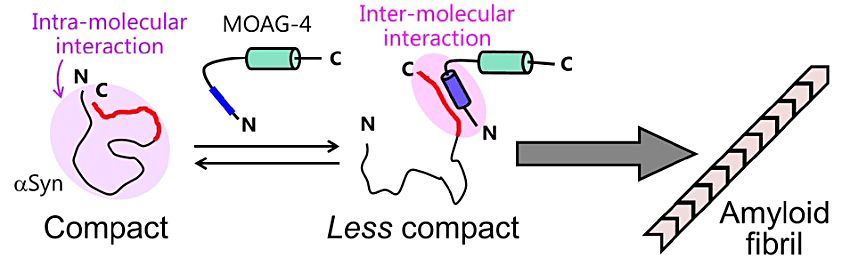
2SA-7 吉村 優⼀(オーフス⼤学)

蛋白質の異常凝集は神経変性疾患の原因となるため、凝集体形成の分子機構を解明することは重要な課題となっています。今回の研究では、α-シヌクレインのアミロイド形成を促進させる蛋白質 MOAG-4(modifier of aggregation 4)の構造動態および相互作用の NMR 解析をおこないました。解析の結果、α-シヌクレインと MOAG-4 との結合によって、分子内に隠れていたα-シヌクレインの疎水性領域が露出して、凝集しやすくなることが示唆されました。
現在は、広島大学大学院理学研究科の分子生物物理学研究室(楯真一先生)で、天然変性蛋白質の動的構造と機能相関の解明を目指して研究をすすめています。天然変性蛋白質の NMR 信号帰属手法については「蛋白質科学会アーカイブ e080(2015年)」に掲載されていますので、興味をお持ちの方はご覧ください。