本年度第17回年会におけるポスター賞受賞者の方にコラムを寄稿いただきましたので、掲載致します(演題番号順)。
日本蛋白質科学会 役員会
1P-006 陳 明皓(北海道大学)

この度第17回日本蛋白質科学会ポスター賞を頂き、驚きとともに大変光栄に思います。
私は今回、鉄硫黄クラスターに依存する新規な tRNA 硫黄修飾の反応機構について発表しました。
2-チオリボチミジン(s2T)修飾は一部の好熱性細菌の tRNA 上で発見された硫黄修飾の一種であり、高温環境下での生存に必要不可欠です。硫黄修飾酵素 TtuA 及び硫黄運搬タンパク質 TtuB は、s2T 修飾を行うことが知られていますが、それらの反応活性を in vitro で確認することができず、未知補因子が必要であると考えられていました。
今回私たちが、嫌気条件下で実験を行い、生化学、分光学及び結晶構造学の手法を用いて、TtuA が酸素感受性の [4Fe4S] 型鉄硫黄クラスターを持つことを確認し、このクラスターに依存的に s2T 修飾活性を in vitro で確認できました。このことから、鉄硫黄クラスターが長い間探索されていた未知補因子であることが証明されました。
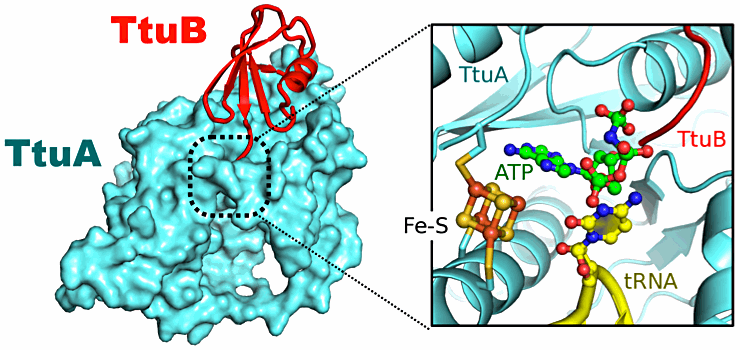
さらに、私たちは TtuA-TtuB の複合体の結晶構造の決定に成功しました。明らかになった結晶構造より、TtuB が硫黄原子を保持している C 末端ループを TtuA の活性部位に深く挿入して、鉄硫黄クラスターの近傍まで硫黄を運ぶことがわかり、TtuA-TtuB-tRNA-ATP の4者複合体モデルを構築できました(図)。
しかし、鉄硫黄クラスターが実際どのように硫黄転移に関わっているのかがまだ明らかになっていません。鉄硫黄クラスターが関与する新規な硫黄転移機構の完全解明へ向けて現在研究を行っております。
今回学会を通じて、たくさんの鉄硫黄クラスター専門家の先生のご意見を伺うことができ、また同世代の若い研究者の素晴らしい発表に刺激され、大変有意義な3日間を過ごすことができました。次の蛋白質科学会でより良い研究成果を発表できるように頑張っていきたいと思います。

1P-078 小林 稜平(東京大学)

この度は第17回日本蛋白質科学会年会にてポスター賞をいただき大変光栄に思います。審査員の先生方をはじめとする学会関係者のみなさまにこの場を借りてお礼を申し上げます。
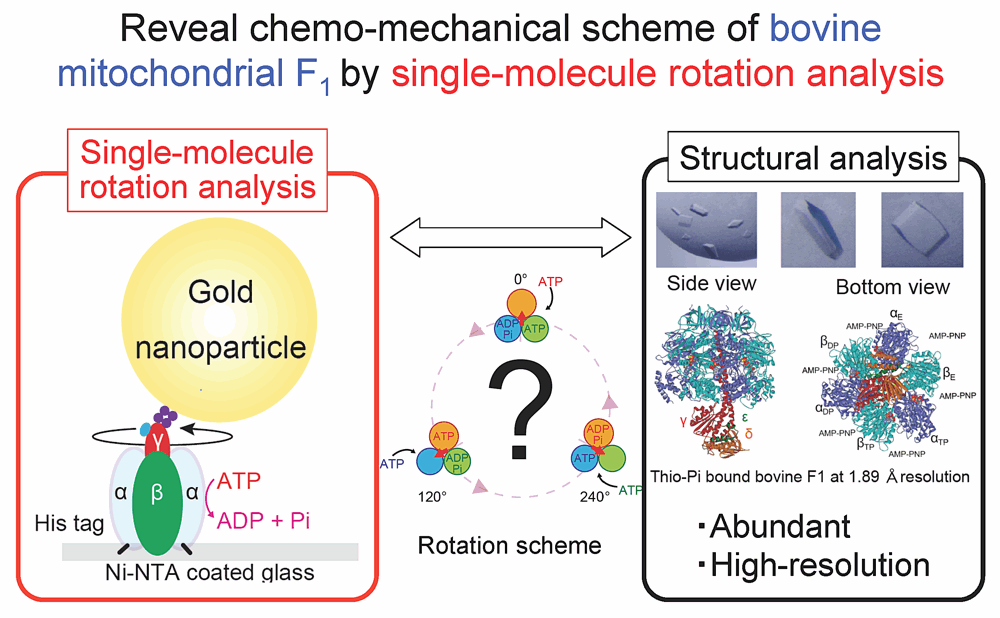
私の研究対象である F1-ATPase は反時計回りに回転しながら ATP を加水分解する分子モーターです。F1 の研究はこれまで主に好熱性 Bacillus 由来の F1(TF1)を用いた1分子計測と、ウシミトコンドリア由来のF1(bovine MF1; bMF1)結晶構造解析を両輪として著しい発展を遂げてきました。F1 の反応スキームも「バクテリア型とミトコンドリア型の反応スキームは同一」という前提のもと、ほぼ解明したと考えられていました。しかし近年、ヒトミトコンドリア由来の F1(human MF1; hMF1)の1分子計測によって、「バクテリア型とミトコンドリア型の回転スキームは同一ではない」ことが示唆され、今までの前提が大きく揺るがされています。そのため、同一の試料を用いて1分子計測と構造解析を進めることが急務となっています。そこで、本研究では bMF1 の回転運動を1分子解析することで、1分子計測と結晶構造解析を厳密に対応付けさせ、F1 の反応スキームの問題に決着をつけることを最終目的としています。現在は ATP 溶液、ATPγS 溶液中での回転停止と各素反応の対応付けを行っている最中です。今後は変異体・阻害剤を用いながら回転スキームの解明を目指します。
1P-112 Elza Firdiani Sofia(東北大学)

I am really grateful for the poster award I received during the Annual Meeting of Protein Science Society Japan 2017.
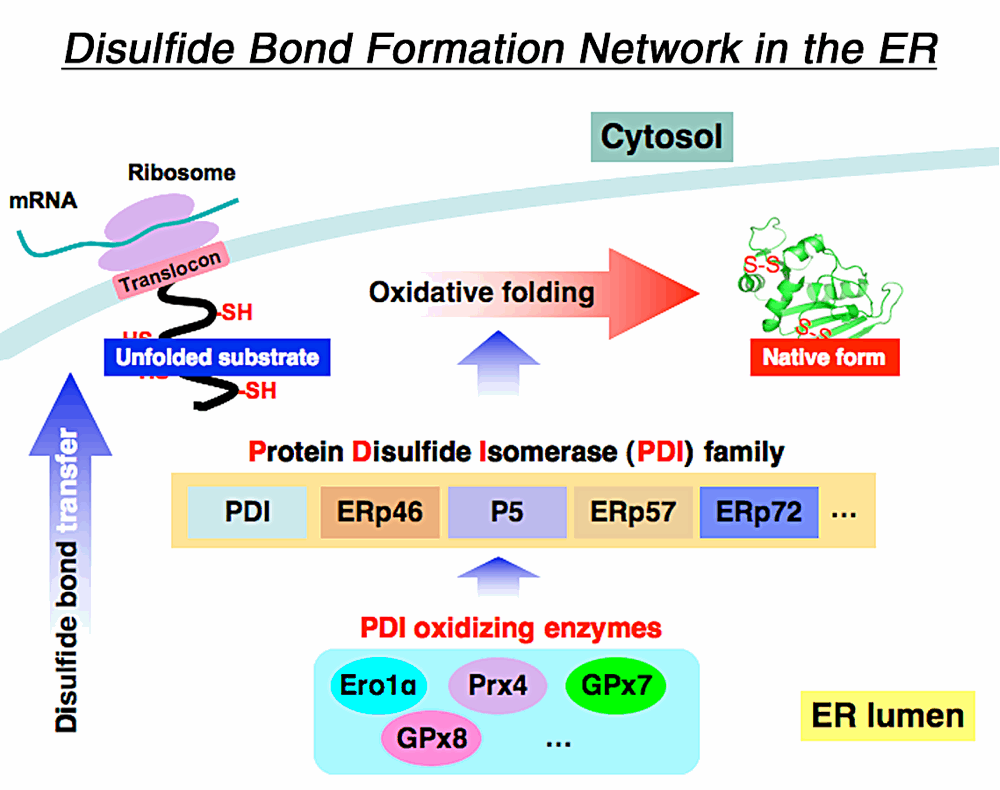
My current research focuses on disulfide bond formation network in the ER where PDI family enzymes and their oxidases play important roles. Unlike other PDI oxidases such as Ero1α and Prx4, GPx7 and GPx8 are not yet well-studied. GPx7/8 are capable of utilizing hydrogen peroxide as their source of oxidative power to oxidize PDI. There are already suggested models of how GPx7/8 catalyze the oxidation process, however the mechanistic details are still elusive; thus we aim to elucidate the mechanistic basis of PDI oxidation by GPx7/8.
Right now I am writing my undergraduate thesis based on this project. I will be graduating this September and continue my master’s at the same lab and university. So far, I’ve been enjoying the work and I am excited to investigate even deeper. Wish me the best of luck!
I would like to thank all members of Inaba Laboratory at Tohoku University for their kind help, especially Professor Kenji Inaba, Dr. Masaki Okumura, and Dr. Shingo Kanemura for their patience in guiding and teaching me.
1P-116 平山 千尋(東北大学)

この度はポスター賞をいただき、大変光栄に思っております。
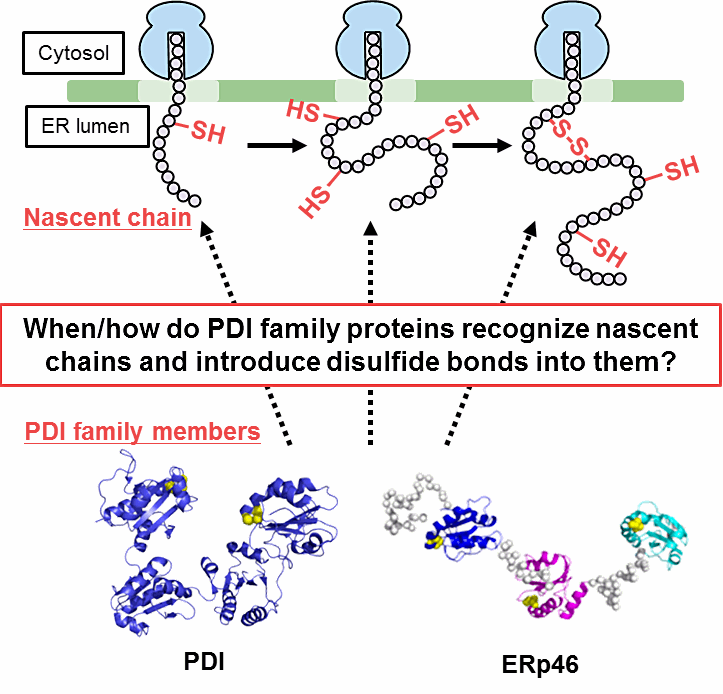
簡単に研究内容をご紹介しますと、近年小胞体において酸化的フォールディングを触媒する酵素として20種類以上もの PDI family が同定されてきました。これまでに全長の還元変性基質を用いた実験から、PDI family の1つである ERp46 が PDI に比べフォールディング初期に素早くランダムにジスルフィド結合を導入することを当研究室により明らかにしてきましたが、リボソームから伸長した新生鎖にどのように働きかけるかは不明でした。そこで私は、ヒト因子由来の cell-free システムを用いることにより、タンパク質合成途上の新生鎖にジスルフィド結合が導入される過程をモニタリングするシステムを開発しました。現在、このシステムを用いて新生鎖に対する PDI と ERp46 の分子認識を明らかにしようと考えています。
最後になりましたが、指導教員である稲葉教授をはじめとする稲葉研究室の皆様、共同研究先である兵庫県立大学の今高教授、町田助教、そして当会を通じて議論をさせていただきました多くの方々に、この場をお借りして厚く御礼申し上げます。
今回のポスター賞を励みに、今後もサイエンスを楽しみながらも、生命現象の神秘をひとつでも多く解き明かしていきたいと思います。
1P-138 岡 芳樹(東京大学)

この度は、ポスター賞を受賞させていただき、ありがとうございます。全ては、指導教員の新井宗仁先生をはじめ、林勇樹先生、そして、本研究の礎を築いてくださった、渡辺尚大先輩、澤田泰平先輩のおかげです。この場をお借りし、厚く御礼申し上げます。
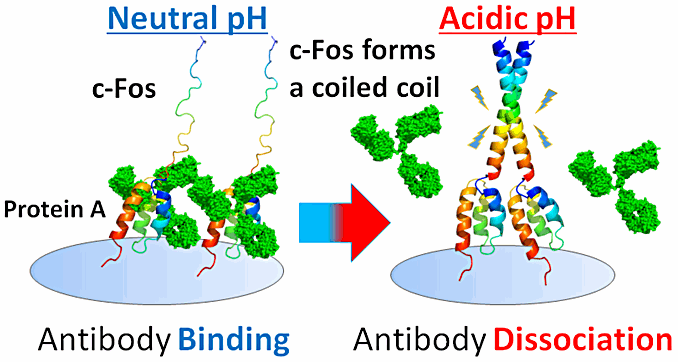
我々の研究は、抗体精製の場で活躍するようなタンパク質のデザインです。現在の抗体精製の主流は、プロテイン A などをアフィニティーリガンドとしたアフィニティーカラム精製です。しかし、この精製法では溶液を pH 2-4 の酸性条件にしなければならず、抗体の酸変性や凝集体形成といったリスクが懸念されます。一般にタンパク質の酸変性は pH 5.5 以下の条件で生じると考えられます。そこで我々は、 pH 5.5 以上での抗体精製を目指して、FPA という新規アフィニティーリガンドを開発しました。FPA(= c-Fos + Protein A)は、抗体と結合するプロテイン A の B ドメインに c-Fos のコイルドコイル領域を繋げたキメラタンパク質です。FPA の作用機構は下図の通りであり、中性 pH では c-Fos 領域は天然変性状態にあるため、プロテイン A 領域は抗体と結合できます(下図左)。一方、pH が低下すると c-Fos 領域がホモダイマーのコイルドコイル構造を形成し、それがプロテイン A 領域からの抗体の解離を誘導します(下図右)。我々は、中性に近い pH で c-Fos 領域がコイルドコイルを形成できるような FPA 変異体を合理的にデザインしました。その結果、pH 5.47 で抗体精製可能なカラムを作製することに成功しました。今後は、実用化に向けての検討を進めたいと考えております。
2P-009 五月女 美香(明星大学)

この度は、日本蛋白質科学会ポスター賞を頂きまして大変光栄に思います。
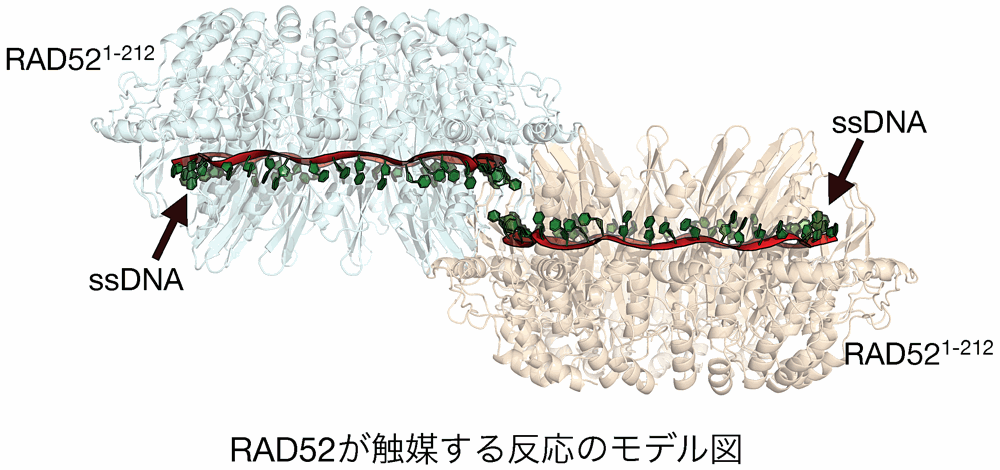
本研究では、相同組換えと呼ばれる相同染色体または姉妹染色分体の間で DNA が組換わる現象を明らかにするために原子レベルの解析を試みています。相同組換え反応は生殖細胞においては遺伝的多様性の獲得、体細胞においては損傷した DNA を修復するために使われている機構であることが知れられています。しかし、その詳細な分子機構については不明です。
私は現在、相同組換え反応の一端を担う RAD52 タンパク質の X 線結晶構造解析や生化学的解析によって、その反応メカニズムの解明を目指して研究を行っています。本年会では、これまでの解析で明らかになったデータをもとにして RAD52 が触媒する反応の分子メカニズムについての発表を行いました。
RAD52 は近年、乳がん細胞において機能することが示唆されている因子です。今回発表した研究内容が少しでも創薬に貢献できる基礎的研究となれば幸いだと考えています。
最後になりますが、ポスター発表を聞いてくださった全ての方々にお礼申し上げます。
2P-021 小倉 麻梨子(北海道大学)

私は細胞内で鉄濃度が一定に維持される仕組みについて研究しています。鉄は生命維持に必須な金属である一方、ラジカルを発生することから細胞を傷つける恐れがあり、その蓄積は様々な病態形成に関与していると考えられています。そのため、哺乳類では鉄制御タンパク質 IRP1 が、鉄の取り込みや貯蔵を担うタンパク質の mRNA に結合・解離することでその翻訳を制御し、細胞内鉄濃度の恒常性を維持しています。この制御機構において、細胞内鉄濃度が高い状態を IRP1 に伝え、標的 mRNA との結合を阻害する鉄濃度の伝達分子は明らかとなっていません。本研究室ではこの分子が鉄錯体ヘムであると予想し、IRP1 とヘムの相互作用解析を行ってきました。中でも私は、IRP1 とヘムの複合体結晶構造解析に成功し、一つのヘムの結合がドメインの相対配置を大きく変化させ、mRNA との結合を阻害する機構を提案しました。今後は、生化学的手法に加え、未だ謎多き細胞内のヘム動態も視野に入れ、ヘムを伝達分子とした鉄濃度制御機構の原理解明に取り組んで行きます。
私は研究を進めて行く中で、X 線結晶構造解析にときめきを覚えました。所属研究室で扱っていない手法でしたが、チャレンジしたいと熱望し、本当に多くの皆様にお世話になり、取り組むことができました。当日は、驚くほど多くの方が聞きに来てくださり、さらにポスター賞という形で私の研究を評価していただきましたこと、大変嬉しく、光栄に感じております。学会関係者の皆様、日々指導してくださっている先生方、共同研究者の皆様、研究室の仲間にこの場を借りて御礼申し上げます。
2P-047 武本 瑞貴(東京大学)

この度、第17回日本蛋白質科学会年会において、ポスター賞を受賞できたことを大変光栄に思います。
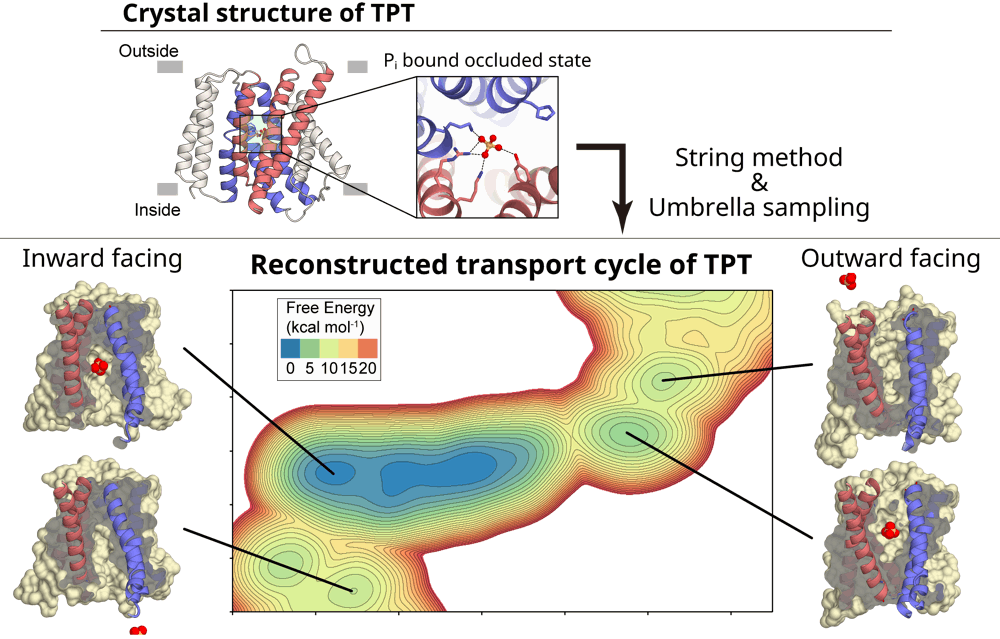
我々の研究室では生命現象を原子レベルで理解することを目的として、主に X 線結晶構造解析による解析を行っておりますが、得られたタンパク質構造のダイナミクスを解析するために分子動力学シミュレーションによる解析も行っております。本研究では当研究室で得られていた葉緑体上の膜輸送体、TPT をターゲットにし、その基質輸送メカニズムを原子レベルで詳細に解明することを目的としました。TPT の1つの結晶構造を出発点として、Steered MD や String method、Replica exchange umbrella sampling を効果的に組み合わせることにより、最終的に TPT が基質である無機リン酸を輸送する様子を再構築することに成功しました。この計算で得られた100万個の構造と自由エネルギーの情報を観察・解析することにより、基質の輸送メカニズムを原子レベルで詳細に解明することができました。
今後もこの賞を励みに、膜タンパク質のダイナミクス・メカニズムの解明を目指してゆきたいと思います。最後になりましたが、ご指導頂いている濡木理先生、石谷隆一郎先生をはじめ、研究室の皆様に御礼申し上げます。
2P-051 吉田 尚恵(日本大学)

この度は、第17回日本蛋白質科学会年会においてポスター賞をいただくことができ、大変光栄に思っております。
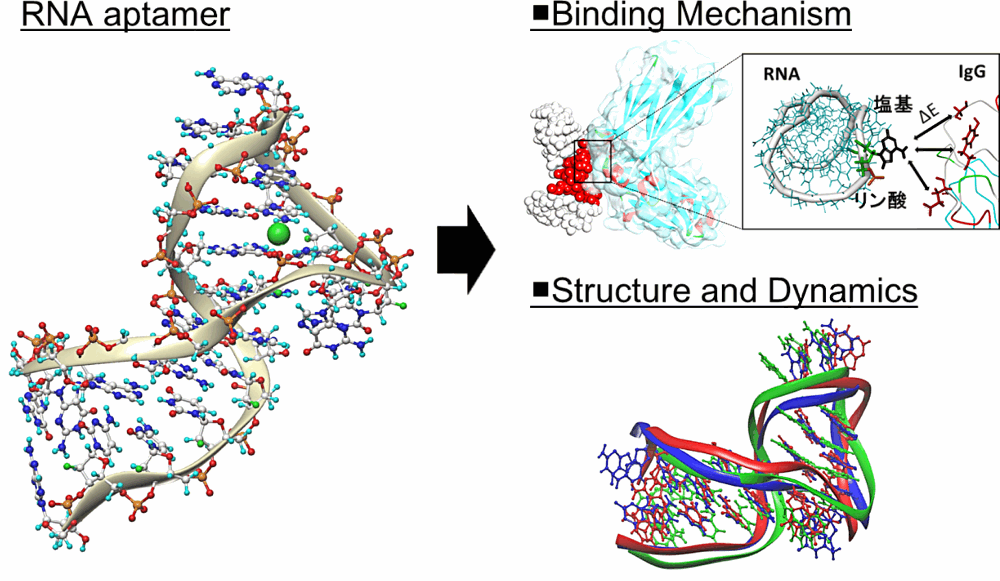
私は、計算化学を用いて RNA アプタマーの構造とダイナミクスについて解析を行っています。
RNA アプタマーは、約20〜80塩基程度の一本鎖の RNA 分子であり、標的タンパク質の表面構造を広く認識することで、標的タンパク質に対して高い特異性と親和性により結合することができます。また、RNA アプタマーは、抗体とは異なり、化学的に合成することも可能です。このことから、RNA アプタマーは、抗体に続く次世代の医薬品として期待されています。しかし、医薬品となるアプタマーを設計するためには、塩基配列を決定するだけでなく、各塩基に対して高度に化学修飾を導入する必要があり、アプタマーの設計プロセスの効率化が課題となっています。
そこで、まず私たちは、ab initio レベルでの分子軌道計算を、アプタマーとタンパク質との複合体構造に対して行い、アプタマーの特異的な分子認識メカニズムを明らかとすることを試みました。続いて、アプタマーに対する分子動力学計算から、アプタマーのダイナミクスについて解析を進めました。これらの解析結果を用いることで、計算化学からヒト抗体(IgG)に対して高い親和性を示す RNA アプタマーを設計することができました。
今回の学会で発表した RNA アプタマーは、抗体(IgG)に対するものです。今後は様々な標的タンパク質に対するアプタマーについても研究を進め、アプタマーの普遍的な構造構築原理を明らかにしていきたいと思います。
2P-076 四坂 勇磨(名古屋大学)

この度は、ポスター賞に選出していただき、大変光栄に思います。年会の運営関係者の方々、並びに審査員の先生方に厚く御礼申し上げます。
今回のポスター発表では、ヘム蛋白質を利用する細菌の増殖抑制法の作用機序について報告しました。この増殖抑制法は、細菌が増殖に必要なヘムを獲得するために利用する蛋白質のヘム結合部位に、合成金属錯体を取り込ませた、「人工蛋白質」を細菌に作用させるというものです。私は、ヘム蛋白質と特異的に相互作用してヘムを受容する細菌の膜蛋白質に着目し、ヘム以外の金属錯体を捕捉した「人工蛋白質」との相互作用を調べました。これにより、「人工蛋白質」が細菌にどのように作用して細菌の増殖を抑制するか、徐々に知見が得られてきました。今後もこの研究を継続し、より詳細な作用機序の解明を目指します。
一時間という発表時間の中でも多くの方々にポスターまで足を運んでいただき、大変有意義な時間を過ごすことができました。このポスター賞を励みにして、引き続き蛋白質研究に取り組んでいきたいと思います。
2P-121 山田 志歩(名古屋大学)

この度の学会でポスター賞をいただき、大変光栄に思っております。審査員の先生方はじめ学会の運営関係者の皆様、ポスターまで足を運んでくださった皆様にこの場をお借りして御礼申し上げます。
私たちは、緑膿菌が生存のために用いるヘム獲得システムの機構解明や、このシステムを騙し、逆に制菌や殺菌に利用する研究を行っています。緑膿菌の HasA というタンパク質は「ヘム獲得タンパク質」でありながらヘム以外の人工金属錯体も捕捉することができます。当研究室の先行研究により、光感受性物質であるガリウムフタロシアニンを捕捉した HasA を緑膿菌に添加すると、細胞にはダメージを与えない赤色光の照射により殺菌できることが示されました。私はこの光殺菌系のメカニズムの解明を目指した研究を行い、光殺菌が HasA と相互作用する緑膿菌の外膜レセプター HasR 特異的なものであり、HasA に捕捉された錯体が HasR を介して菌体内に近づくことが高効率な光殺菌に必要であることを見出しました。光殺菌系は従来の抗生物質依存ではない新たな殺菌法として、薬剤耐性緑膿菌の治療へ応用できるのではないかと期待しています。
今回の発表で、様々な方が自分の研究に興味を持って聞いてくださったことが大変嬉しかったです。今回のポスター賞を励みに、今後も「おもしろい科学を伝えたい」という気持ちを持って、研究に取り組んでいきたいと思います。
