本年度第17回年会における若手奨励賞受賞者の方から原稿をいただきましたのでここにお知らせします(演題番号順)。
日本蛋白質科学会 役員会
2SA-01 清水 将裕(京都大学)

この度は、若手奨励賞を頂き、大変光栄に存じます。
バクテリアのゲノム複製は複製起点での DNA 開裂から始まりますが、その分子メカニズムはまだ明らかになっていません。ゲノム複製開始時、複製起点には DnaA タンパク質や IHF タンパク質からなる複製開始複合体が形成しています。この複合体が直接二重らせん開裂に関わっているのか、そうでないのかが長い間議論されています。
私たちは、二重らせん開裂機構を明らかにするためには複製開始複合体の全体像を理解する必要があると考えました。そこで分子シミュレーションによる構造モデリングと生化学実験を組み合わせ、この柔軟な複合体の構造解明に取り組みました。生化学実験は共同研究者である九州大学の片山勉教授の研究室の皆様にお願いしました。研究の結果、この複合体が三つの領域に分かれていることを突き止め、原子レベルに近い解像度で複合体の構造モデルを得ることができました。
また、複製起点上の DnaA 結合サイトの間隔が複製開始複合体の形成や DNA ヘリケースの一本鎖 DNA 装着に重要であることも明らかになりました。
今後は今回得られた構造モデルに基づき、複製起点の DNA 開裂機構にさらに迫っていきます。
2SA-03 渡邉 宙志(東京大学)

このたびは、若手賞奨励賞を賜り光栄に存じます。今回の研究では、私は細菌の嫌気呼吸に関連するタンパク質 MtrF の分子構造と電子移動経路を計算機シミュレーションを用いて解析しました。
バクテリアの中には、細胞外の金属酸化物に電子を捨てることで、嫌気呼吸を行っているものがおります。その際に起こる長距離電子輸送の最後のプロセスを司っているのがシトクロムタンパク質であるMtrFのプロテインファミリーです。
数年前にこのプロテインファミリーの中で最初に MtrF の結晶構造が解かれました。それによると MtrF は4つのドメインから成り、ヘムを10分子結合しております。このヘムが電子移動を担っています。この結晶構造に基づき各ヘムの酸化還元電位を算出した先行の理論研究により、今まで MtrF の電子移動はヘムの配置に沿って双方向に起こると言われていました。しかし、今回の研究において私はこの結晶構造の誤りを発見しました。そこで、分子シミュレーションを用いて分子構造をモデル・リファインし、改めて各ヘムの酸化還元電位を算出しました。その結果、先行研究と異なり、一方向的に効率的に起こる電子移動が導かれました。また MtrF は周囲の酸化還元環境に応じて、電子移動経路を切り替えることで最適化するメカニズムを保有していることも示唆されました。
最後になりましたが、今回の賞を励みにして蛋白質シミュレーションの新しいステージを切り拓いていく所存です。
2SA-06 鈴木 和人(名古屋大学)

この度は日本蛋白質科学会若手奨励賞を賜り、非常に光栄に思っております。人生初の英語での口頭発表となり、隠し切れないほどに緊張したと同時に、得難い貴重な経験をさせていただきました。当会の運営に携わった方々、発表を通じ議論をさせて頂いた先生方に、この場を借りて厚く御礼申し上げます。
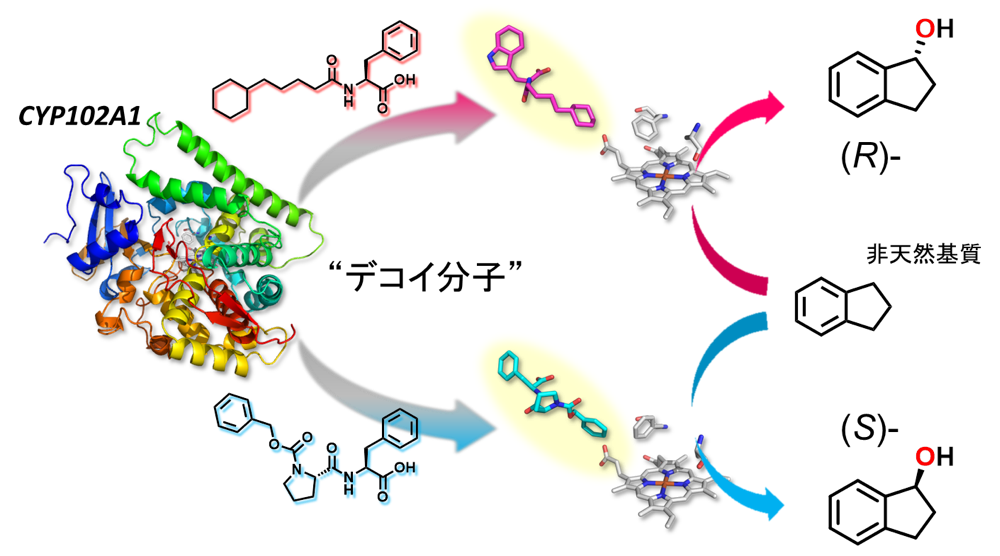
さて、私が所属している生物無機化学研究室(渡辺研究室)では、主に金属蛋白質をターゲットとし、その機能解析と応用を志向した、少し「変わった」研究が展開されています。その一つが、「外部添加物によるシトクロム P450 の基質特異性変換」です。P450 は、生体内で毒物の代謝などに携わる酵素として知られています。P450 が触媒する水酸化反応は産業的にも有用であり、その実用化が強く望まれています。しかし、酵素活性が高いことで知られる細菌由来の P450 は一般に基質特異性が高く、我々が望む反応へ利用することは難しいとされてきました。当研究室はこの基質特異性の高さを逆手に取り、天然基質に構造を似せた「囮の基質」(デコイ分子)を用いて P450 を「騙す」、というユニークなアプローチによって、P450 の基質特異性を変換することに成功しました。デコイ分子は P450 に「基質が結合した」と勘違いさせ、その誤作動を引き起こすので、本来は P450 が対象としない、非天然基質の水酸化反応が進行するようになります。本年会では、デコイ分子の化学構造を利用した、水酸化反応の立体選択性制御について議論させて頂きました。
当研究室では、他にも、ヘム獲得蛋白質を利用した病原菌の増殖阻害など、金属蛋白質を利用したユニークな研究が進行しています。興味をもった方は是非、ホームページを覗いてみてください。
2SA-07 浴本 亨(横浜市立大学)

日本蛋白質科学会若手奨励賞を頂き、大変光栄に存じます。本研究は、分子動力学シミュレーション(MD)と X 線小角散乱(SAXS)実験を相補的に連携させる事で、未知であった、溶液中のビタミン D 受容体リガンド結合ドメインのアポ体、及び、アンタゴニスト複合体の様子を、原子レベルで初めて解明した研究です(Anami et al., J. Med. Chem. 59, 7888 (2016))。SAXS 実験は、低分解能ながら、蛋白質の溶液構造情報を得られる有力な実験手法なのですが、分子概形を議論するには、高分解能な構造情報が必要です。本研究では、高分解能構造情報として、MD から得られる溶液構造モデルを用いました。MD を実行すると、力場の範囲内ではありますが、溶液中で安定な溶液構造モデルを得る事ができます。MD 中の構造は、立体構造に基づいて、構造的な根拠を持って出現しますから、構造変化のメカニズムにも迫る事ができます。ただし、シミュレーションできる時間スケールが短いので、MD から得られた溶液構造モデルが、実験で観測された構造や実験事実と矛盾がないか妥当性を評価してやる必要があります。我々は、溶液構造モデルの理論 SAXS プロファイルを、実験プロファイルと比較してやる事で妥当性を確認しました。このように、SAXS と MD を相補的に用いる事で、実験的な根拠があり、かつ、物理的に無理のない溶液構造モデルを得る事に成功しました。
本研究は、池口満徳教授(横浜市大)、山本恵子教授(昭和薬科大)、清水伸隆准教授(高エネ研)、伊藤俊将准教授(昭和薬科大)の温かいサポートとご指導ご議論、また、実験を担当された山本研究室の穴見康昭博士(現テキサス大)との詳細な議論を頂いた結果、達成できた共同研究です。感謝申し上げます。私にとって、今後の発展が期待できる大事な仕事になりました。MD を用いたビタミン D 受容体の活性調節機構や機能発現メカニズムのさらなる理解、及び、MD-SAXS 相関構造解析手法のアンサンブル構造版への発展や他の蛋白質への適用に取り組んでいきたいと考えています。
2SA-08 滝沢 由政(沖縄科学技術大学院大学)

この度は、日本蛋白質科学会若手奨励賞を頂き、大変光栄に思っております。
本研究は、クロマチン高次構造の1つであるヘテロクロマチンに焦点をあて、ヒト HP1 タンパク質によるヘテロクロマチンの基本構造を、明らかにすることを目指し、私の古巣である早稲田大学胡桃坂研究室との共同研究として進めて参りました。私の米国留学で学んできたクライオ電子顕微鏡単粒子解析技術を生かし、結晶化が難しいヘテロクロマチン基本構造の三次元構造解析に挑みました。当初、ヒト HP1 クロマチン複合体は、非常にフレキシビリティが高く、解析が困難であると思われましたが、クライオ電子顕微鏡用の新型位相板を使用し、画像コントラストを上げることで、それを克服することができました。これにより、ヒト HP1 タンパク質によるヘテロクロマチン基本構造を、世界で初めて、三次元構造として明らかにすることに成功しました。この構造を用いると、クロマチンリモデリング因子のヘテロクロマチンへのアクセスや、ヘテロクロマチン複製開始メカニズムが議論できるようになり、クロマチン高次構造の理解に大いに貢献できることが期待されます。今後は、更にクライオ電子顕微鏡を使い、クロマチンを含めた生体超分子の三次元構造解析を行っていきたいと考えております。
最後に、本研究を遂行するに当たり、多くの助言を頂いた現所属研究室の Dr. Matthias Wolf、高純度に精製されたヒト HP1 クロマチン複合体を提供して下さった、胡桃坂先生、町田博士を始めとする胡桃坂研究室の方々に感謝と御礼申し上げます。
2SA-09 野島 達也(東京工業大学)

日本蛋白質科学会若手奨励賞を受賞でき、嬉しく思います。
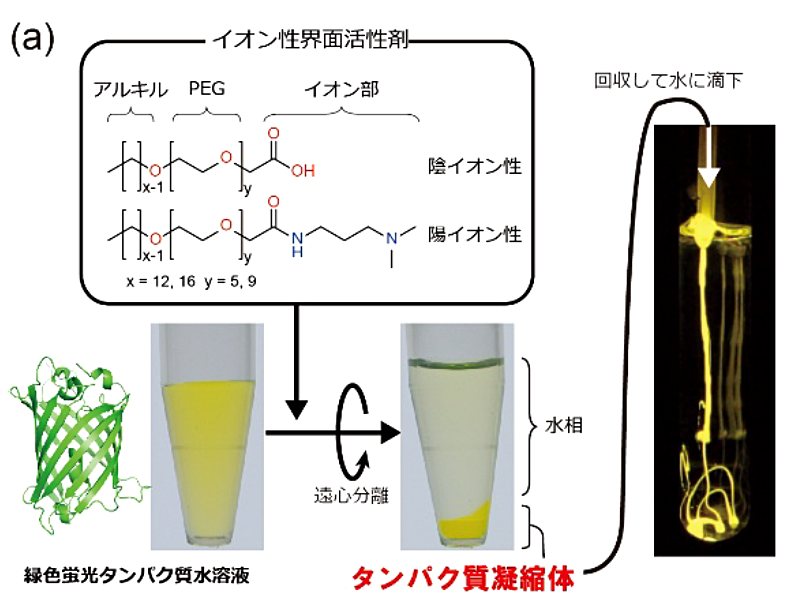
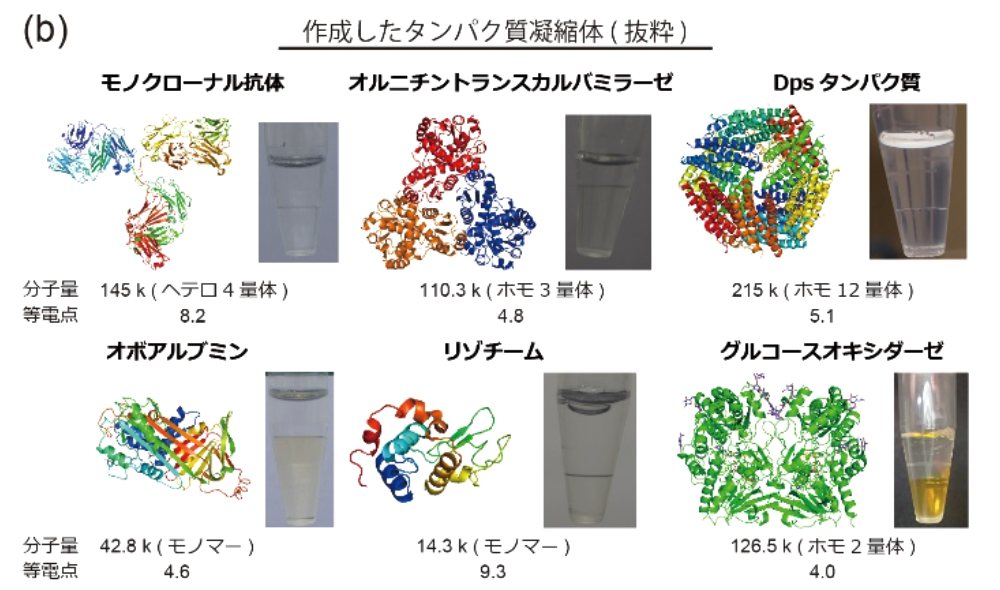
本研究では、界面活性剤によって誘起されるタンパク質の自己集合により形成される、水相から相分離した液状物質「タンパク質凝縮体:Protein Condensate」を開発し、その形成機構と構造解析、応用利用について報告しました。「秩序だって高度に凝縮したタンパク質を含む液状物質」という怪しいタイトルでの発表でしたが、話を聞いていただけた人にはまったくもってタイトル通りの研究であることが理解していただけたことと思います。
私の研究は蛋白質科学会の中でおそらく最も他の研究と関連が無いものでしたでしょうが、タンパク質の新たな物質状態を発見した意味において蛋白質科学会で発表する意義が非常に高いものであったと思っています。
また、本手法は様々なタンパク質に汎用的に応用が可能であり、目に見える実用的なスケールでの物質創成ができるという点で、実用応用的な価値が高いと考えています。
今後は基礎・応用の両面からタンパク質凝縮体研究を発展させていきたいと思います。
本研究は JST-ERATO 彌田プロジェクトにおいて遂行しました。研究の進展を厳しくも辛抱強く見守っていただきました彌田智一総括に感謝いたします。