本年度第15回年会の若手奨励賞優秀賞受賞者の3名にご自身の研究などについて自由に書いていただきました。
フェムト秒 X 線レーザーを用いた光化学系 II 複合体の1.95 Å 分解能での無損傷結晶構造解析
菅 倫寛(岡山大学)

私のタンパク質研究の始まりは大阪大学蛋白質研究所の月原冨武教授の研究室に配属希望者への説明を受けに行った日までさかのぼる。以来、分子量の限界にとらわれることなくタンパク質の世界を原子のレベルで理解することのできる結晶学に魅力を感じ、これまで研究を続けてきた。私が月原研究室に配属された当時、研究室のメインテーマであったチトクロム酸化酵素の結晶構造解析においては X 線還元による活性中心への影響が問題視されており、この問題を解決するためにひとつの結晶から一枚の回折写真だけを測定して、気の遠くなるような数の結晶を使用して構造解析が可能なデータを得ようとしていた。私の卒業研究のテーマはこれらの回折写真の処理条件の検討で、研究室の先輩が作成したソフトウェアを用いて、リファレンスデータとの比較することで部分反射のパーシャリティーを決定し、パーシャリティーから逆算して完全反射の強度を求めるというものであった。
あの頃から約10年が経った。放射光よりも100兆倍の輝度を持つ光を発する X 線自由電子レーザー施設の登場は“試料が壊れる前に回折現象が起こる(Diffraction before destruction)”と称されるこれまでとは全く異なる原理に基づく結晶構造解析を可能とした。さらに検出器の高速化により、数十ヘルツで記録したイメージのうちから回折現象が起こったものだけを選出して、それらにモンテカルロ法的なアプローチを行うことで(あるいはポストリファインメントなどを行って)構造解析が可能な回折データを得るという、シリアルフェムト秒結晶構造解析法が確立しつつある。このように X 線結晶解析についてはパラダイムシフトが起きたわけだが、放射線損傷の無い構造を見たい、すなわち、“機能する、天然状態での構造を見たい”と思う研究者のモチベーションは10年前とちっとも変わってはいないと思う。蛋白質科学会の若手奨励賞での発表内容である「フェムト秒 X 線レーザーを用いた光化学系 II 複合体の1.95 Å 分解能での無損傷結晶構造解析」は X 線自由電子レーザー施設 SACLA を用いて、放射線損傷の全く無い、巨大な膜タンパク質複合体の結晶構造を高い分解能で決定したものである。その内容について簡単に紹介したい。
はじめに
光化学系 II 複合体は20個のタンパク質サブユニットと多数の補欠因子から構成される700 kDa の巨大な膜タンパク質複合体であり、その“心臓”部分である酸素発生中心においては文字どおり水分子が水素原子、酸素原子、電子へと分解され最終的に酸素分子が発生する。2011年、光化学系 II 複合体の 1.9 Å 分解能での X 線結晶構造解析が成功し、酸素発生中心の正体が“ゆがんだイス型構造”の Mn4CaO5 クラスターであることがつきとめられた。この酸素発生中心の構造は水分子を含む詳細な構造情報を提供し水分解反応の理解を大きく進展させたが、これまで報告されていた X 線吸収微細構造を用いて決定された Mn-Mn の距離と比べると0.1~0.2 Å 長くなっており、シンクロトロンの X 線を用いて決定した結晶構造は放射線による損傷の影響をうけている可能性を否定できなかった。とくに、Mn4CaO5 クラスターの5つの酸素原子のうち、O5 とよばれる酸素原子はそのまわりの Mn との結合距離がきわめて長く、このような長い結合距離が放射線による損傷に由来するのか、あるいは、本来の特徴を示しているのか不明であった。この放射線損傷の問題を排除するため、我々は X 線自由電子レーザーを使用して光化学系 II 複合体の結晶の無損傷構造解析を行った。
酸素発生中心の構造
X 線自由電子レーザーにより得られた酸素発生中心の全体構造はこれまでに報告されていたシンクロトロンの X 線を用いて得られた構造と非常によく似ていたが(図1a)、MnMn の距離および Mn-O の距離に顕著な違いがみられた。Mn-Mn の距離は Mn1-Mn2 が2.7 Å、Mn1-Mn3 が3.2 Å、Mn1-Mn4 が5.0 Å、Mn2-Mn3 が2.7 Å、Mn2-Mn4 が5.2 Å、Mn3-Mn4 が2.9 Å となっており、すべての Mn-Mn の距離がシンクロトロンの X 線による構造と比べ0.1~0.2 Å 短くなっていた(図1b)。これらの距離は X 線吸収微細構造により報告されていたものともよく一致しており、X 線自由電子レーザーにより放射線損傷のない構造が得られたことが支持された。
シンクロトロンの X 線により得られた酸素発生中心の構造においてもっとも特徴的な点は、O5 がほかの酸素原子と比べ異常に長い結合距離をもつ点であった。シンクロトロンの X 線による構造では、O5 と Mn1、Mn3、Mn4、Ca との結合距離は2.4 Å から2.7 Å であり、換言すると、O5 は周囲との結合がとくに弱く不安定な状態で存在していた。X 線自由電子レーザーにより得られた酸素発生中心の構造では、Mn3-O5 が 2.2 Å、Mn4-O5 が 2.3 Å、Mn1-O5 が2.7 Å、CaO5が2.5 Å となっており、Mn3、Mn4、Ca との結合は0.2 Å短くなり、Mn1 との結合は逆に0.1 Å 長くなっていた(図1c)。これまでのシンクロトロンの X 線による構造解析では、長い結合距離をもつ O5 の性質は放射線損傷によるアーティファクトである可能性が否定できなかったが、X 線自由電子レーザーによる構造解析によりこの性質が酸素発生中心に固有のものであり、したがって、O5 が水分解反応の基質分子として反応機構に深くかかわっていることがあらためて示された。
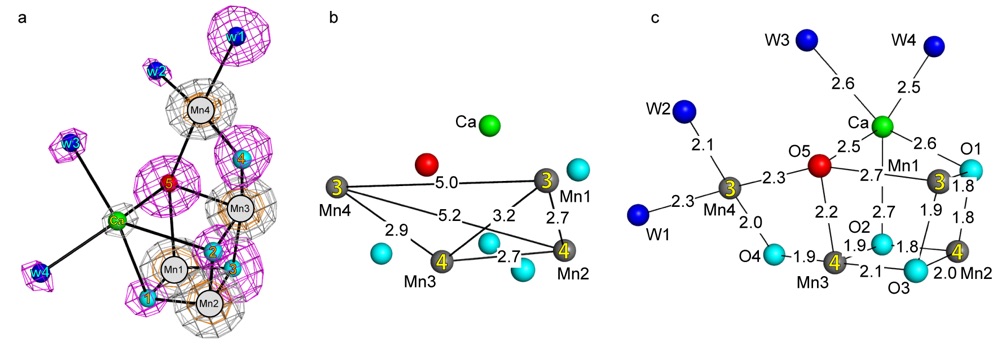
(a)電子密度マップおよび酸素発生中心の全体構造。
(b)Mn-Mn の距離。
(c)Mn-O、Mn-H2O、Ca-O、Ca-H2O の距離。
Mn を灰色、Ca を緑色、O1~O4 を水色、O5 を赤色、水分子を青色で描いた。Mn の球の上の数字は価数。
水分解の反応機構
X 線自由電子レーザーを用いて決定された水分解反応の開始状態の構造にもとづき、O5 を基質分子のひとつとする水分解反応の機構を提唱した(図2)。まず、S1 状態においては Mn1 および Mn4 が同じ +3 の価数をもち、さらに、Jahn-Teller 効果により Mn1-O5 と Mn4-O5 は長い結合距離をもつ。電子がひき抜かれ S2 状態になると Mn1 あるいは Mn4 のいずれかが +4 の価数をもつことになり、O5 は一方の Mn の正の電荷が高くなったこと、および、Jahn-Teller 軸の消失により、+4 の価数をもつ Mn の側にひき寄せられる。このとき、Mn4 の価数が +4 になれば O5 は Mn4 の側にひき寄せられ Mn3CaO4 のキュバンの部分は開いた構造をとり、その結果、Mn1 の側にスペースができる(O5 の右にスペースができるので右型構造とよばれる)。逆に、Mn1 の価数が +4 になれば O5 は Mn1 の側にひき寄せられキュバンの部分の閉じた左型構造になる。つづく S3 状態および S4 状態では、この開いたスペースに新しい水分子が入り O5 と O=O 結合を形成する。生成された酸素分子は排出され酸素発生中心は S0 状態にもどり、新たな水分子が O5 の位置へと取り込まれる。S0 状態から S1 状態への遷移にともない、水分子からプロトンが抜き取られることにより O5 は OH– になり、S1 状態へもどる。これらの一連の反応機構は理論計算の結果、および、最近の電子スピン共鳴による結果とも大方で一致していた。
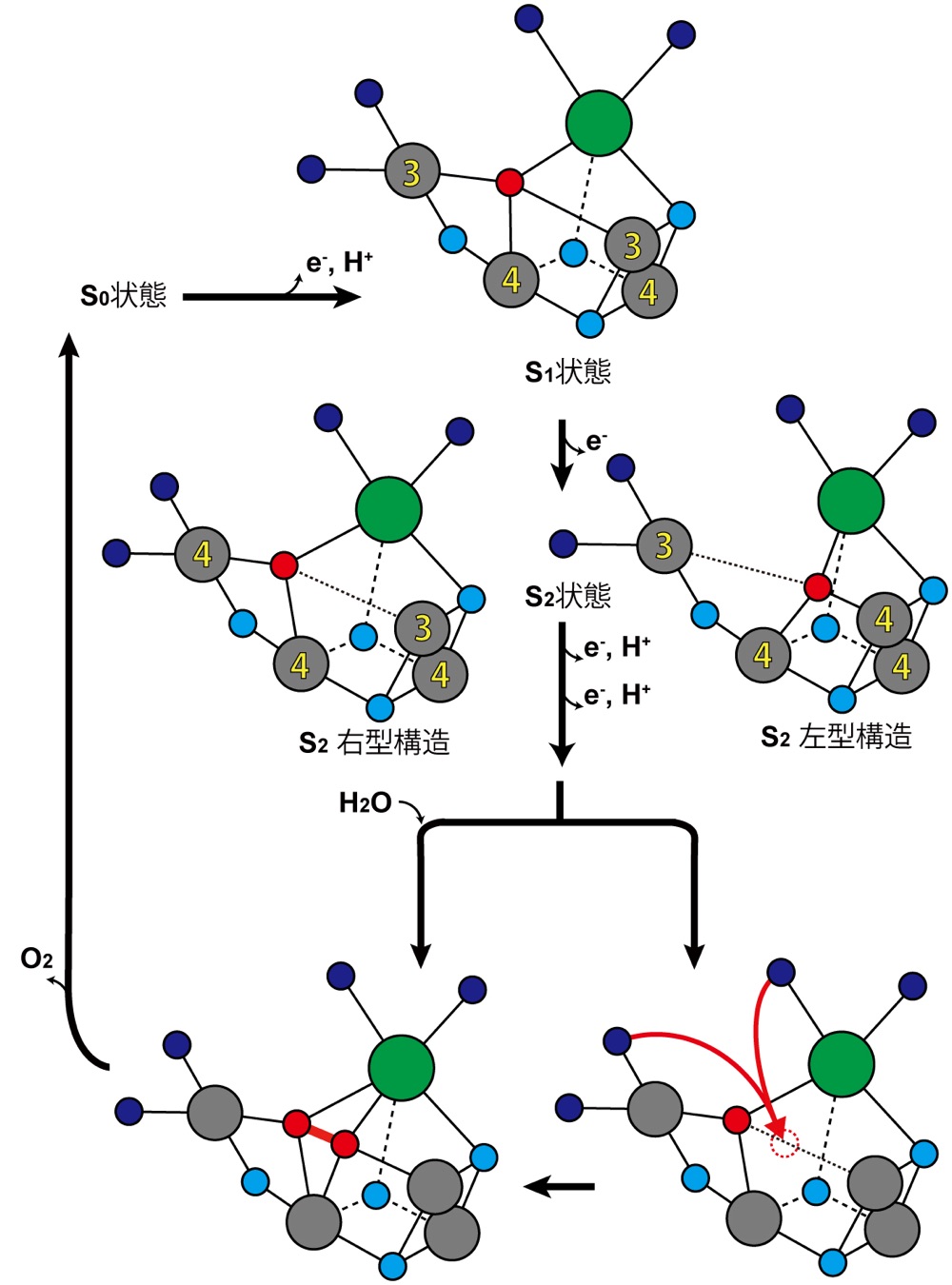
S3 状態および S4 状態において新たに挿入される水分子については、Mn4 および Ca のリガンドとして存在する O5 の近傍の水分子なのか、まったく別の水分子なのか、現時点では不明であるため、両方の可能性を示した。
おわりに
この研究により、水分解反応を触媒する酸素発生中心の天然状態における構造が明らかになり、その構造にもとづき、O5 が OH– であることだけでなく、O5 を基質分子のひとつとする水分解反応の機構を提唱した。これらの知見は、水分解反応の基本原理を提供し、人工光合成を行う触媒のデザインのためのモデルテンプレートとなることが期待される。しかしながら、今回、決定されたのは水分解反応の開始状態の構造であり、基質分子となるもう1つの水分子がどこから供給されるのか、O5 を中心とする反応機構が本当に機能しているのか、H+ の放出場所はどこかなど、解明すべき点は多く残っている。反応機構の全貌を解明するためには、光化学系 II 複合体の中間状態での高分解能の構造情報が必須である。X 線自由電子レーザーの真髄は放射線損傷の無い原子構造をフェムト秒領域という超高速で捉えることが可能となるところにある。今後は X 線自由電子レーザーを用いた動的な構造解析により、中間状態の構造を明らかにしていきたい。この研究は岡山大学の秋田総理博士、中島芳樹氏、清水哲哉博士、沈建仁博士、理化学研究所の吾郷日出夫博士、平田邦生博士、上野剛博士、村上博則博士、山下恵太郎博士、山本雅貴博士との共同研究である。この場を借りてお礼申し上げる。
脱窒にみられる効率的な一酸化窒素分解システムの構造基
當舎 武彦(理研・SPring-8)

「當舎さんって若手なの?」年会のホームページをみた知り合いや、学会会場で会った何人かの知人からこのような質問がありました。蛋白質科学会における若手奨励賞への応募資格は、「発表当日に40歳未満のもの」とあります。私の誕生日は11月。あと、半年もしないうちに40歳になります。「若手なの?」と質問された方々の目は正しく、まさに、ぎりぎりでの受賞でありました。写真は、懇親会後に研究室のメンバーで飲みに行ったときのものです。若手にはみえないか…。
私は、2009年2月に、理研・SPring-8 の城研究室に参加し、今回の講演の主役である膜結合型一酸化窒素還元酵素(NOR)の研究に加わりました。NOR は、ヘム鉄と非ヘム鉄からなる活性中心において、NO の還元反応を触媒する膜タンパク質です。私は、それまでも NOR と同様に、鉄などの遷移金属を活性部位に持つタンパク質の構造・機能に関する研究に携わってきましたが、膜タンパク質を扱うのは初めてのことでした。研究室内外の方々に教えをこいながら、膜タンパク質の取り扱い方を学び、NOR の構造解析に関する研究を進めることができました。
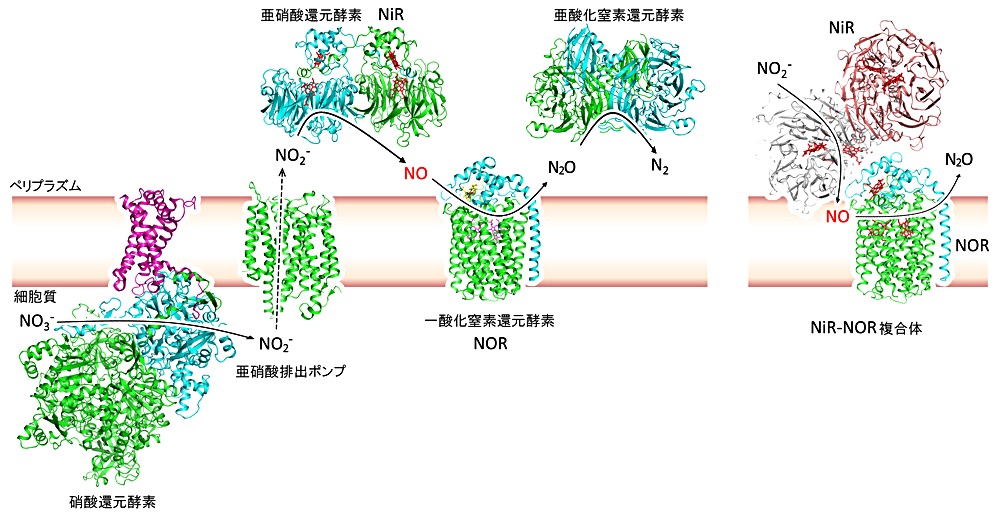
NOR は、細菌が嫌気下で生きるためのエネルギーを得るために行う脱窒という過程に関わる酵素です。脱窒では、硝酸が段階的に窒素分子にまで還元され、その中間生成物として細胞毒性の高い NO が合成されます(図1)。私は、NOR の研究の過程で、細菌が生きていくために積極的に細胞毒 NO を合成している点に興味をもちました。いわば、命がけで生きるためのエネルギーを作っているわけです。そこで、なぜこのような細菌は、自身が合成した NO によって細胞損傷を受けることなく生育できるのだろうと考えるようになり、今回の講演につながる研究がスタートしました。本稿では、発表ではふれなかった話も交えながら、研究内容について紹介します。
脱窒において、NO を合成するのは、亜硝酸還元酵素 NiRで、NO を分解するのが NOR になります(図1)。NiR によって合成された NO が NOR によって直ちに分解されなければ、NO が細胞内を拡散してしまいます。このことから、直感的に NiR と NOR が相互作用して、NO の受け渡しをしているのでは?と考えました。NiR と NOR が相互作用するのか調べようともしたのですが、もう始めてしまえ!と思い、NiR と NOR を混合し、結晶化のスクリーニングを開始しました。発表ではきれいな茶色の単結晶を示しましたが、最初のスクリーニングで得られたのは、厚みがなく、エッジも明確でない結晶(のようなもの)でした。厚みがないせいで色が薄く、楽観的にみると NiR の緑色と NOR の赤色を混ぜた茶色っぽい色をしているけど…、と思いながら SPring-8 でのビームタイムにのぞみました。X 線をあててみると回折点がみられ、結晶であることがわかり、分解能は6.5 Å 程度でしたが、データセットをとりました。得られた回折データを処理し、NOR と NiR を用いて分子置換を行ったところ、解が得られました。興奮しながら結果をみてみると、低分解能ですが、それらしい構造にみえました。すると解析を手伝って下さった杉本宏研究員が「NOR と NiR の鉄原子の部分に強いポジティブの電子密度がみえてるでしょ。これ、多分あってるよ。」と言ってくれました。よし、これはいける!と思い、結晶化条件を展開することで、茶色のきれいな単結晶が得られるようになり、分光学的にも NiR と NOR を含んだ結晶が得られていることが示されました。デハイドレーションや氷晶防止法を検討することで、最終的に分解能3.2 Å で NiR-NOR 複合体の構造を決めることができました(図1)。
結晶構造解析に加えて、NOR と NiR が本当に相互作用するのか?その複合体形成の意義は?という問いに答えるための実験にも着手しました。そこで、まず表面プラズモン共鳴法を利用して、NOR と NiR の相互作用の検出を試みました。しかし、NiR がセンサーチップそのものと相互作用しやすく、NiR と NOR の相互作用を正確に調べることはできませんでした。等温滴定熱測定にも挑戦しましたが、試料の調製が難しく、満足な結果を得ることができませんでした。困ったなぁ、と思っていたときに、緑膿菌の研究をされている東京大学農学部の新井博之先生と知り合う機会を得ました。城研究室の研修生が NOR の大腸菌での発現に関する発表をしていたのを聞いた新井先生が声をかけてくれたのです。新井先生が構築された緑膿菌での NOR の発現系を用い、緑膿菌内で、NOR の NiR 結合部位の変異体を発現させ、緑膿菌の生育度合をみる、という実験系を考えました。もし、NiRと NOR の相互作用が NO の細胞内での拡散を防ぐために重要ならば、NOR の変異体を発現させた緑膿菌では、NO が細胞内に蓄積してしまい、生育が悪くなるはずです。実験の結果、期待通り NOR の変異体を発現させた緑膿菌の生育が悪くなるという傾向がみられました。つまり、NiR-NOR の複合体形成は、細胞内でも起こっており、この複合体形成が NO の迅速な消去に寄与していることを示せたわけです(図1)。今後は、細胞内において、NiR と NOR の複合体形成が常に起こっているのか?離合集散しているものなのか?調べたいと思っています。
最後になりましたが、本研究に協力してくださった皆様には、本当に感謝しています。一緒に実験をしてくれた城研究室の皆様の協力なくしては、本研究を進めることはできませんでした。NiR-NOR 複合体の結晶構造が解けたのは、城研究室研修生の寺坂瑛里奈さんの頑張りのおかげです。また、東京大学農学部の新井博之先生には、緑膿菌での NOR の発現系を提供していただき、それまで不可能であった種々の実験ができるようになりました。この場をおかりして深く感謝申し上げます。
Asymmetric and cooperative recognition of histone post-translational modification by two antigen-binding sites of an antibody
服部 峰充(The Univ. of Chicago)

本学会は、私にとって修士課程1年のころから参加している特別な学会である。若手奨励賞・ポスター賞制度が始まった2008年にはポスター賞を受賞し、当時の喜びはいまでも忘れない。その7年後に若手奨励賞優秀賞を受賞できるとは思ってもおらず、今回の受賞は大変光栄であり、今後の研究活動の大きな励みになる。
私はこれまで、進化分子工学を駆使した抗体の機能改変、及び新規抗体の開発を行ってきた。学生時代、東北大学・熊谷 泉教授の下で抗体工学を学び、博士号を取得した。その後、私はシカゴ大学の小出研究室に留学し、抗体の標的抗原の中でも最も難易度が高い「タンパク質の翻訳後修飾」に特異的に結合する抗体の作製に取り組んできた。奨励賞シンポジウムで発表した内容は現在論文投稿中であるため詳細を記載することはできないが、ここでは私がこれまでシカゴ大学で行ってきたヒストン翻訳後修飾に特異的な組換え抗体の作製について紹介したい。
エピジェネティクス分野における抗体の低特異性、低再現性問題
クロマチンの基本構造となるヌクレオソームを構成するヒストンタンパク質は、N 末端もしくは C 末端領域内の様々な箇所においてメチル化やアセチル化、リン酸化などの翻訳後修飾を受ける。それら一つ一つの翻訳後修飾が DNA 配列に依存しない転写・翻訳の制御、すなわちエピジェネティクスに関与し、近年では、エピジェネティクス機構の異常により、癌や疾患が引き起こされる例も報告されている。エピジェネティクス分野において抗体は必須の研究試薬であり、Immunostaining や Western blot、そしてクロマチン免疫沈降(ChIP)と次世代シーケンサーによる DNA 配列解析を組み合わせた ChIP-Seq などの解析手法に用いられている。一方で近年、抗ヒストン翻訳後修飾抗体の多くにおいて、オフターゲット、すなわち標的以外の配列や修飾基に結合するといった特異性の問題があることが報告された。さらに市販抗体のほとんどがポリクローナル抗体であり、ロット間で抗体の結合特性が異なることが、再現性の高い結果を得る上で足枷となっていた。我々は、抗ヒストン翻訳後修飾抗体の特異性を定量的に評価するため、ChIP を模倣した Peptide IP assay を開発した(1)(図 1A、1B)。これまで抗ヒストン翻訳後修飾抗体の特異性は、Western blot や Dot blot など定性的な方法でのみ評価されてきたが、我々が開発した手法では、結合曲線から解離定数 KD を算出することで定量的に抗体の特異性及び親和性を評価できる利点を持つ。Peptide IP assay により市販抗体の結合評価を行った結果、そのほとんどが低特異性もしくは低親和性を示し、さらにロット間での結合特性が異なっていた(1)(図 1C)。この抗体の特異性問題は、ヒストン翻訳後修飾が、抗体にとって特異的に認識することが難しい抗原の一つであるためと考えられる。すなわち、Lys 残基のモノメチル化、ジメチル化、トリメチル化に見られるような修飾基間の高い類似性や、修飾箇所付近の高い配列相同性(図1A)、さらに翻訳後修飾を受ける領域の柔軟性に起因する結合エントロピーロスにより、高い特異性と親和性を持つ抗体を取得することが難しいためであると考えられる。
(1) Nishikori, S. Hattori, T. et al., J. Mol .Biol., 424, 391–399, 2012
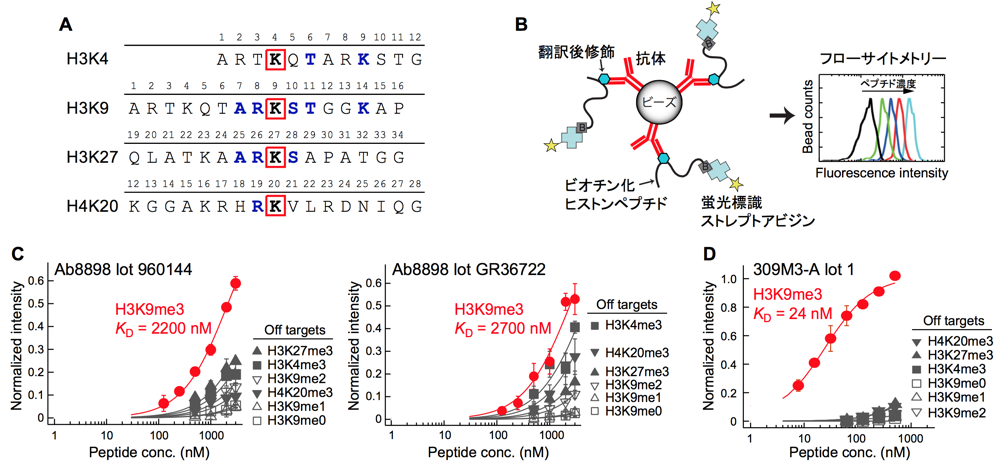
(A) Peptide IP assay に使用したヒストンペプチドのアミノ酸配列。翻訳後修飾を受ける Lys 残基を赤枠で示す。その Lys 残基を中心として H3K9 配列と共通するアミノ酸残基を青文字で示す。
(B) Peptide IP assay の概念図。抗体をビーズに固定化後、ビオチン化ヒストンペプチドと混合し、ビーズを洗浄する。その後、蛍光標識したストレプトアビジンを加え、再度洗浄し、フローサイトメトリーにて蛍光強度を測定する。ペプチド濃度に対して蛍光強度をプロットし、解離定数 KD 値を算出する。
(C, D) Peptide IP assay による抗 H3K9me3 抗体の結合評価。同一のカタログナンバーであるが、異なるロットの市販抗体 (C) と我々が作製した組換え抗体 (D)。
(A-C) は Nishikori, S. Hattori, T. et al., J. Mol .Biol., 424, 391–399, 2012 より改変。
(D) は Hattori, T. et al., Nat. Methods, 10, 992–995, 2013 より改変。
ヒストン翻訳後修飾特異的な組換え抗体の作製
我々はこれら抗体の低特異性・低再現性の問題を根本的に解決するため、進化分子工学を用いた組換え抗体の作製を試みた。組換え抗体は、遺伝子配列が同定されているベクターを用いて組換えタンパク質として生産されるため、それらの特性は高い再現性を持ち、普遍的に利用可能な研究試薬となる。我々はまず、ヒトの未免疫抗体ライブラリーからトリメチル化 Lys 残基に特異的な抗体を単離した(2)。さらにタンパク質の機能に関わるアミノ酸残基を網羅的に同定することが可能であるショットガンスキャニング法により、単離した抗体のトリメチル化 Lys 結合に重要なアミノ酸残基を同定した。我々は、その情報を元にライブラリーを設計し、ファージ提示法を用いてスクリーニングを行った結果、ヒストン H3 のトリメチル化した Lys9(H3K9me3)及び Lys4(H3K4me3)それぞれについて、高特異性、高親和性を示す抗体の取得に成功した(2)(図1D)。これらの抗体は、ChIP や Western blot などの解析手法において、ロットに関わらず高い再現性で機能し、エピジェネティクス分野に貢献しうる研究試薬の開発に成功した。我々は、これらの抗体について特許を出願し、企業との連携により商品化にも至っている。これらヒストン翻訳後修飾特異的な組換え抗体は、その普遍的な結合特性を生かすことで、基礎研究に限らず、エピジェネティクスを標的とした医薬や診断薬開発にも応用可能であると考えられる。
(2) Hattori, T. et al., Nat. Methods, 10, 992–995, 2013
おわりに
我々は、進化分子工学を駆使することで、高い分子認識を必要とする標的に対して特異的かつ高親和性を示す抗体の作製に成功した。この経験を生かし、私は今後、医薬としてはもちろん、基礎研究や生命現象の解明に役立つツールとして、また検出・診断薬としての抗体の開発を行い、基礎科学及び医療分野の発展に貢献していきたい。最後に本プロジェクトのグループリーダーを私に任せてくださり、叱咤激励とともに研究のアドバイスをくださったシカゴ大学・小出 昌平教授に深く感謝する。
