本年度第15回年会における若手奨励賞受賞者の方から原稿をいただきましたのでここにお知らせします(演題番号順)。
日本蛋白質科学会 理事会
2SA-2 (2P-118) 有森 貴夫(阪大・蛋白研)

この度は、若手奨励賞をいただき大変光栄に思っております。
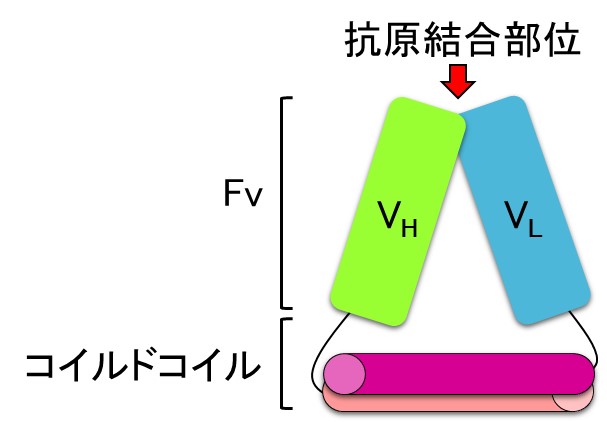
蛋白質科学会の会員の方の多くは、何らかの形で抗体を使用したことがあるのではないでしょうか。今や抗体は、研究や医療の分野において欠かせない存在となっています。しかし、一般的に抗体の産生には動物細胞を必要とするため、抗体の取得にはコストがかかることが問題となっています。そこで私は、大腸菌発現系を用いて産生できる新規のフラグメント抗体フォーマット“Fv−clasp”を開発しました。抗体の Fv 領域は VH と VLの間の相互作用が非常に弱いため不安定なのですが、Fv−clasp は、抗原結合を阻害することなく Fv 断片の二量体構造を安定化させるため、抗原結合部位から離れた VHと VLの C 末端同士を逆平行のコイルドコイル構造で繋いだ設計になっています。これまでの研究で、フラグメント抗体として最もよく用いられている単鎖抗体(single-chain Fv)と比べ、Fv−clasp は大腸菌発現系による生産効率、安定性、抗原親和性の保持などの点で優れており、極めて有用性が高いことが示唆されています。現在、Fv−clasp がより理想的なフラグメント抗体になるようにさらなる改良を試みているところですが、将来、この Fv-clasp がフラグメント抗体の定番のフォーマットとして多くの人に利用され、研究・医療の分野において広く応用されることを期待しています。
2SA-3 (2P-039) 丹治 裕美(東大院・薬)

このたびは若手奨励賞を頂き、大変光栄に思っております。学会に関わってくださった先生方に感謝申し上げます。
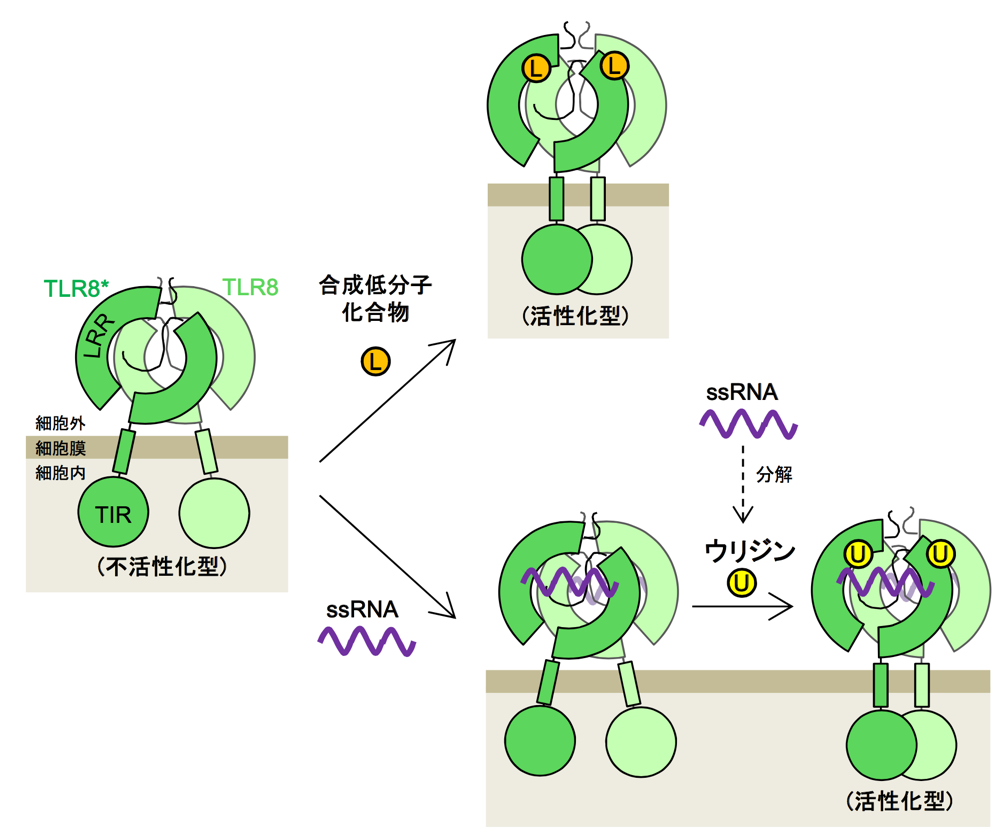
本研究の対象である TLR8 は、ウィルス由来の一本鎖 RNA を認識して自然免疫を活性化させるⅠ型膜貫通蛋白質ですが、合成低分子化合物によっても活性化されるという特徴を有しており、性質が異なるこれらのリガンドがなぜ TLR8 を活性化できるのかは謎でした。私は TLR8 とこれらのリガンドの複合体の構造生物学的研究を行い、その結果、TLR8 には、低分子化合物やウリジンを認識する 1st site と、RNA を認識する 2nd site の2か所のリガンド結合部位が存在することを明らかにいたしました。最終的に、TLR8 の RNA 認識における真のリガンドは RNA の分解産物のウリジンであり、2か所のリガンド結合部位の協調的な効果によってシグナル伝達が行われていると結論付けました。TLR8 はウィルス感染や自己免疫疾患などに関わっていることが示唆されており、本研究結果は、これらの疾患の治療薬の開発に貢献すると考えています。
最後に、指導教員である清水教授、研究を指導して下さる大戸博士をはじめとする研究室の皆様、共同研究先である東京大学医科学研究所の三宅研究室および首都大学東京の磯邉研究室の皆様に、この場を借りて御礼申し上げます。
2SA-4 (2P-072) 木村 哲就(理研)

タンパク質が発現する機能の分子機構を解明するためには、機能発現に伴うタンパク質の化学状態変化および反応そのものを実時間で観察することが最も重要なアプローチの一つである。そこで、私はこれまでマイクロ流体デバイスを用いた新規時間分解分光装置の開発を行い、時間分解能の向上と測定に要する試料の抑制に挑戦してきた。
本発表では、①ケージド化合物の光誘起反応、②レーザー分光法、③ナノリットル送液システムを組み合わせた新規の時間分解可視吸収および赤外吸収分光装置を紹介した。これによって、マイクロ秒の時間分解能で膜タンパク質の化学状態変化・機能発現を追跡することが可能になり、膜タンパク質である一酸化窒素還元酵素が担う還元反応に装置を適用したところ、2分子の NO が活性中心に配位した後に分子内反応で N2O が形成されることを初めて明らかにしたことを報告した。
今後も実時間観察にこだわって、ダイナミックに動くタンパク質分子およびそれらが集合して構築される生体分子システムの反応を、化学的に理解する研究を展開していきたいと考えている。
最後に、受賞に当たって城研の皆さん、特に城先生、久保専任研究員、賞レースのライバルでもあった當舎専任研究員に深く感謝の意を表します。
2SA-7 (2P-046) 西 羽美(東北大・院情報科学)

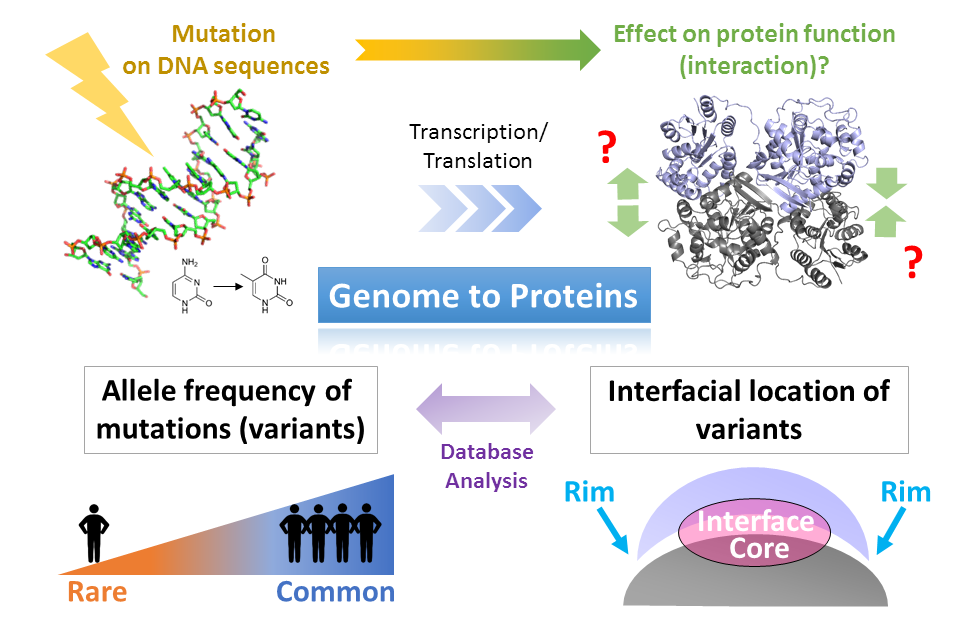
この度は日本蛋白質科学会若手奨励賞を頂き、大変光栄に存じます。今回受賞した研究は、ヒトゲノム中の一塩基変異がどのようなアミノ酸置換をもたらし、どの程度タンパク質同士の相互作用、複合体形成に影響し得るのかについてデータベース解析を行い、変異の頻度と変異の相互作用面上での位置に関して一般的な傾向を述べたものです。実は私は2008年にはポスター賞も頂いているのですが、そのときの演題は「タンパク質の相互作用面形成――アミノ酸置換と会合状態変化」で、やはり複合体の相互作用面とアミノ酸置換の関係をデータベース解析により議論したものでした。この7年の間、特に博士を取得後は対象を複合体からリン酸化、細胞内シグナル伝達へと徐々に変え、出来る限り学生時代のテーマから離れるように努めてきたつもりでしたが、ここに来て久しぶりに手掛けた、自分にとっては「ベタな」複合体の仕事でうっかり受賞してしまい、言葉は悪いですが相互作用面上のアミノ酸置換に対し腐れ縁のようなものを感じています(?)
さて、タンパク質はアミノ酸からなるポリペプチド鎖であることは間違いありませんが、その背後には配列情報を抱える DNA や細胞内の環境、そして進化の淘汰圧が控えています。今回の研究発表でも「例外」として、タンパク質構造だけからでは変異の影響を完全には推定しきれないケースを紹介しました。タンパク質を取り巻く全ての事情を考慮に入れることはたやすいことではありませんが、こうした要素をできるかぎり踏まえつつ、これからも生体内の立役者であるタンパク質のありようをバイオインフォマティクスによってとらえていきたいと考えています。
2SA-8 (2P-089) 茶谷 悠平(東工大・生命理工)

タンパク質は、細胞内装置リボソームによって合成されます。この合成過程は、タンパク質研究においては大前提として無視されがちです。しかし実際には、成熟タンパク質の機能を充分に発揮するための、重要なステップであることが明らかになってきました。例えば、一部のタンパク質では、合成途上で局所的な速度低下を経験することで、翻訳共役的なフォールディング、あるいは膜局在化が効率的に行われることがわかっています。
今回私達は、こうした翻訳の速度調節がどれだけの規模で行われているのか、またどのようなメカニズムで行われているのかを明らかにするため、大腸菌の翻訳伸長過程について、網羅的な解析を行いました。その結果、1. 翻訳の滞り(pause)は大腸菌遺伝子の80%以上に見られる普遍的な生命現象であること、2. pause の60%はリボソーム機能が抑制されて発生していることを見出しました。リボソーム機能の抑制は、合成途上の新生ポリペプチド鎖(新生鎖)とリボソームトンネル間の相互作用によってリボソーム構造が歪められ、発生しているものと考えられます。今後は個々の pause の発生と解除メカニズム、生理学的意義について解析を進め、遺伝子発現についての新たな研究領域「新生鎖の生物学」の発展に寄与していきたいと考えています。
