本年度の若手奨励賞受賞者の2人にご自身の研究などについて自由に書いていただきました。
電位依存性プロトンチャネル(VSOP)の静的状態の結晶構造から考察する膜電位センサーの動作原理
竹下 浩平(大阪大学)

本学会は第一回年会から参加している思い入れの強い学会の1つでもあります。その第一回大会の会場が大阪大学だったのですが、今回、大阪大学に所属する身分で本学会の若手奨励賞を頂けたことは大変光栄であり感慨深いものです。
「機能的なタンパク質を創る」
私が研究の分野に入ったきっかけは、そのような蛋白質工学研究を行っておられた九州大学の井本泰治先生の研究室で研究活動を開始したことであります。Ph. D. 取得後、免疫学・細胞生物学の研究室をポスドクとして過ごし、生体では多種多様なタンパク質分子が厳密に制御され機能していること、そして生体に重要なタンパク質が次々と発見されることに壮大な世界観を感じ、一方で分子が織りなす現象よりも、その分子機構の原理に研究の興味がうつり、現在は X 線結晶構造解析を主とした構造生物学研究を行うに至っています。生化学・細胞生物学の研究分野から、本格的に、X 線結晶構造解析という研究分野へ移ることは容易ではなかったのですが、幸運なことに、現所属の中川敦史教授が酵母を用いたタンパク質の大量発現の経験を持つ人を探しているという話を聞き、偶然にも私はそのような経験があったため、お互いのニーズが合ったことで、X 線結晶構造解析の研究を開始することができ、今日に至っています。

今回、受賞の理由となった研究は電位依存性プロトンチャネルの結晶構造解析から、膜電位センサーの作動機構における2つのブラックボックスを明らかにしたことであります。その1つ目は、これまでに構造解析された電位依存性イオンチャネルの膜電位センサーの結晶構造はすべて活性化状態の構造であり、VSOP の結晶構造は静的状態のものとしてはじめてであったこと、2つ目は、一般に膜電位センサーは二価の金属イオンにより活性化が阻害されることが知られていますが、今回の VSOP の結晶構造には亜鉛イオンが結合した状態のものであったことは、膜電位センサーの活性化が二価の金属イオンによって阻害されている構造としてもはじめてであったことです。したがって、今回の VSOP の結晶構造は、分子として新規の構造であったと同時に、膜電位センサーの長年の構造学的なブラックボックスである静的状態の構造基盤の一端を明らかにしたものであるといえます。詳細は日本語レビューも公開されていますので、そちらを参照して頂ければと思います。また、この分子は大阪大学医学系研究科統合生理学の岡村康司教授が2006年に同定した分子であり、日本で分子同定から原子構造決定までを行った研究でもあります。
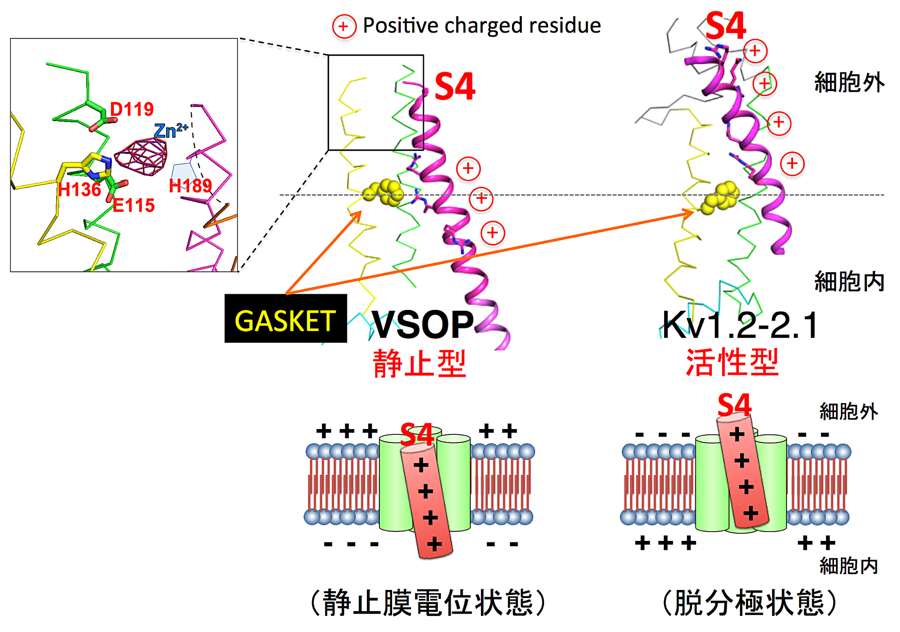
論文が受理されて間もなくサンフランシスコで開催された 58th Biophysical meeting でポスター発表を行う機会があったのですが、その発表のなかで、分解能が低く議論が難しいところは少し謙虚に説明していたのですが、発表を聞きにこられていたプロトンチャネル研究者でラッシュ・メディカル大学の Thomas DeCoursey 教授から「マッキノンでもできなかったことだから自信を持ちなさい」との励ましの言葉を頂いたことが印象強く、また成し遂げた研究の重みをあらためて実感しました。また、ポスター掲示時間の午前8時ごろから昼過ぎまで多くの研究者がポスターを見に来てくれ、これまでで最も長い学会発表でもありました。
今回の受賞は多くの方々の御指導や御協力の下に成り立っていると深く感謝しています。この結晶構造を決定するまでには長い年月がかかったのですが、自分を信じてくださった中川敦史教授や岡村康司教授に深く感謝致しております。また、共同研究者の皆様、教育職として従事している大阪大学博士教育リーディングプログラム・生体統御ネットワーク医学教育プログラムの皆様、中川研究室の皆様にも感謝したいと思います。最後に、X 線結晶構造解析の経験が全く無かった私に、結晶の取り扱い方、結晶学、構造解析ならびに構造研究に対する姿勢などを教えてくれた中川研究室の山下栄樹先生には、この場をお借りして(先生というよりは先輩に近く、直接伝えるのは恥ずかしいので)心から感謝したいと思います。
NMR によって明らかにするトリガーファクターシャペロンの分子機構
斉尾 智英(ラトガース大学)

私が NMR によるタンパク質研究を始めたのは2005年、学部4年生として北海道大学 稲垣冬彦教授の研究室に配属されたときであった。当時 NMR 法によるタンパク質の立体構造解析は分子量上の制約のために対象が ~20 kDa 以下の小さなタンパク質に限定され、精度・スピードも X 線結晶構造解析法に及ばなかった。しかしタンパク質を溶液状態で観測する NMR 法は弱く過渡的な相互作用系の解析に優れ、他の手法では得られないユニークな情報を与える。高分子量タンパク質に対しても高精度な解析が可能になれば、NMR 法はより強力な手法になる。その信念のもと、これまで私は NMR によるタンパク質研究を行ってきた。
高分子量タンパク質の NMR 構造解析において問題となるのは、(I)立体構造情報の不足、特に長距離間での情報の不足、(II)信号の幅広化とそれにともなうスペクトル分解能の低下と低感度化、である。これらを改善するために、これまで私は稲垣教授のもと(i)常磁性ランタニドプローブ法を用いた構造解析法の確立に取り組み、その後アメリカ ラトガース大学 Prof. Kalodimos の研究室へと留学し、(ii)メチル基選択的安定同位体標識法を用いた高分子量タンパク質の立体構造解析に取り組んだ。今回は、第14回蛋白質科学会若手奨励賞での発表の主体となった(ii)について、特に100 kDa の二量体として存在する分子シャペロン Trigger Factor(TF)と変性状態の基質の複合体構造解析について紹介したい。
シャペロン–基質複合体の構造解析
分子シャペロンは変性タンパク質の凝集を防ぐことによって、タンパク質の折り畳みや品質管理などにおいて重要な機能を果たす。特にリボソームによって合成されたばかりの新生鎖は立体構造を持たず、本来はタンパク質のコアを形成すべき疎水性領域が露出しているため特に凝集の危険にさらされる。ここで細胞質中に存在する TF、DnaK、DnaJ、GroEL などの分子シャペロンによる凝集抑制、折りたたみ補助が重要になる。これまでの結晶構造解析によってこれらの主要な細胞質内シャペロンの単体構造が解かれているが、機能上最も重要である変性状態の基質との相互作用についての知見はいずれのシャペロンについても乏しかった。ダイナミックで過渡的なシャペロン–基質間の相互作用が複合体での結晶化を困難にし、分子量上の制約のために NMR 法の本格的な応用はなされていなかった。我々はメチル基選択的安定同位体標識法や methyl-TROSY などを駆使した最新の NMR 法によって分子量の制約を乗り越え、TF と変性状態の基質との複合体構造を決定した。
TF シャペロンの NMR 解析
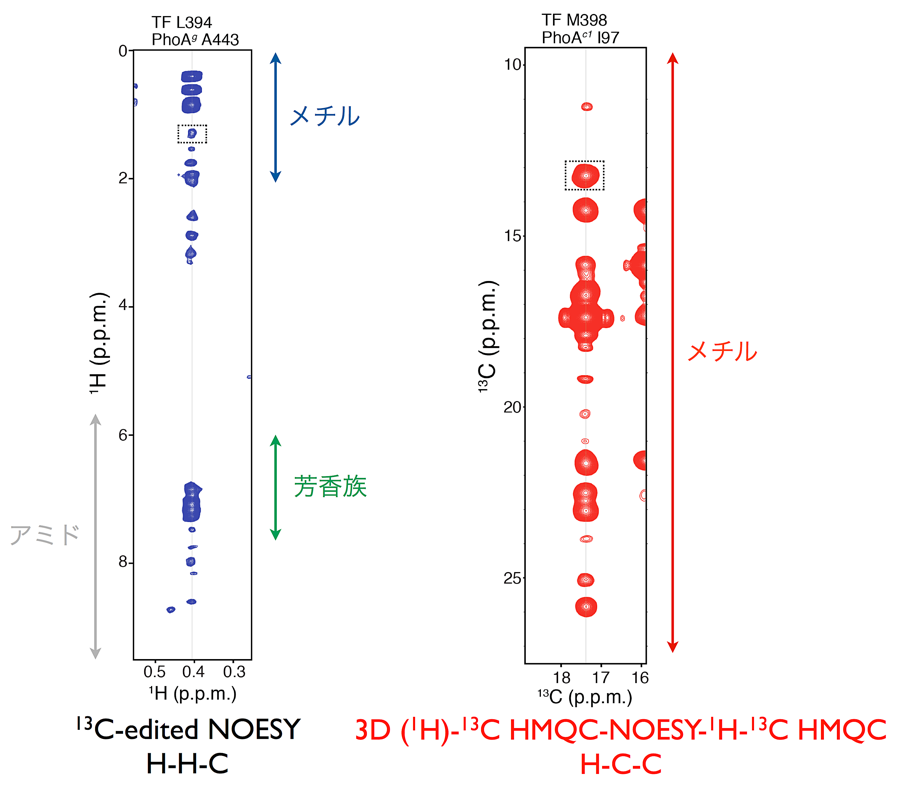
Ile、Leu、Val、Met、Ala、Thr に含まれるメチル基を選択的に 13C1H 標識し、他を重水素化するメチル基選択的安定同位体標識法によって数百 kDa のタンパク質に対しても良好な NMR スペクトルを得ることが可能になる(Sprangers, R. et al. (2007) Nat. Methods 4, 697–703)。これらの標識可能なメチル基は TF 分子中に豊富に存在するため、これらを選択的に標識することによってスペクトルを簡素化し高感度化しながらも重要な情報を失わずに解析することが可能となる。信号帰属や立体構造情報取得において鍵となったのが、HMQC-NOESY-HMQC などの NMR 測定法である。一般的な H-H-C タイプの NOESY はメチルとアミドや芳香環との相関をとるのに適しているが、メチル基のプロトン軸の分散が限られているために分解能が低く、メチル間の NOE の観測が困難になる(図1)。しかし、HMQC-NOESY-HMQC 測定によって NOESY 軸を 13C の化学シフトで展開させることで、メチル間の NOE を高分解能で観測し、精度の高い解析が可能になる(図1)。選択的ラベルによって全体の観測信号数は減少するが、このような測定法によって一つの信号から得られる情報の質と量を高めることで補うことが可能である。
TF と基質の構造解析・相互作用解析
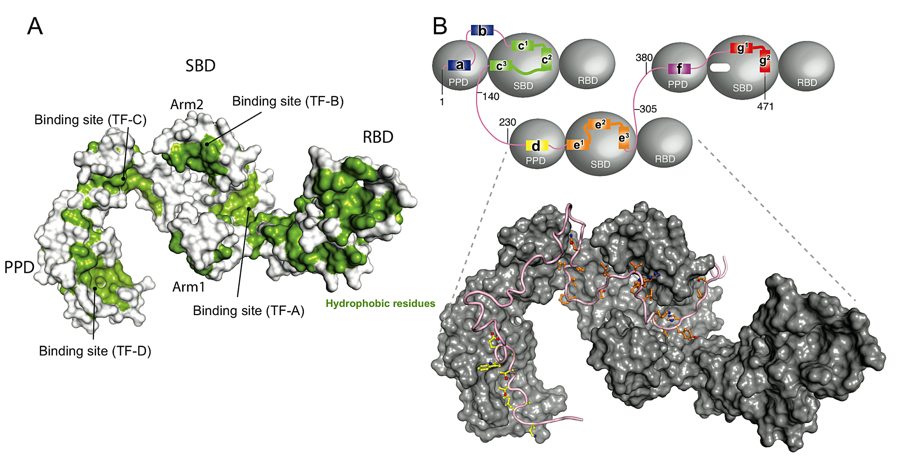
変性状態の基質として alkaline phosphatase(PhoA)を用い、TF との相互作用を NMR と ITC により詳細に調べた。その結果、TF は4カ所の独立した領域によって基質を認識し、PhoA 全長(1–471)の7カ所の疎水性領域と相互作用することが明らかになった。基質フラグメントが長くなるにつれてより親和性の高い特異的なコンフォメーションをとり、より交換の遅い安定な複合体が形成されることがわかった。しかし長いフラグメントであっても kex ~1500 s-1 とダイナミックな結合・解離の交換があることが明らかになった(Saio, T. et al. (2014) Science 344, 1250494)。このダイナミックな結合・解離がタンパク質の折り畳みを補助するという TF シャペロンの機能上重要であると考えられる。立体構造解析の結果、3分子の TF が全長 PhoA と結合し、TF 上の4箇所の独立したサイトが基質 PhoA の疎水性領域を認識し、TF の cavity 内部に PhoA が格納されていることが明らかになった(図2)。このように TF は基質の疎水性領域を互いに引き離した状態で保持することによって、基質の凝集とミスフォールディングを防いでいることが明らかとなった。
おわりに
TF のシャペロンとしての機能の解明に最も重要である変性状態の基質との複合体の立体構造は、これまで長い間明らかにされていなかった。変性状態の基質との弱くダイナミックな結合、高分子量などが妨げとなり、X 線結晶解析・NMR 両者の解析を困難にしていた。我々は高分子量タンパク質に特化した安定同位体ラベル法や測定法によって NMR における分子量の制約を乗り越え、TF と変性基質の複合体の立体構造を決定した。動的な分子や弱く過渡的な相互作用の解析に元来優れている NMR が高分子量タンパク質に対して応用できるようになった今、NMR は TF のみならず他の多くのシャペロンタンパク質の分子機構解明に最も強力なツールの一つであると言えるだろう。シャペロンの本格的な立体構造研究はまだ始まったばかりである。今後 NMR によって、特に常磁性ランタニドプローブ法を取り入れた新たなアプローチによって、シャペロン分子の動的な分子メカニズムを明らかにしていきたい。
