本年度第14回年会におけるポスター賞受賞者の方から原稿をいただきましたのでここにお知らせします(演題番号順)。
日本蛋白質科学会 理事会
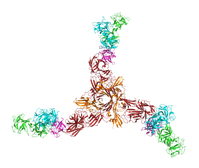
1P-004 阿松 翔(大阪大学 微生物病研究所 感染細胞生物学)

ボツリヌス神経毒素複合体は神経毒素、NTNH、ヘマグルチニン(HA)の3つのタンパク質により構成されています。本毒素複合体の中で、HA は “運び屋” の役割を担う分子であり、HA を保有した毒素複合体は保有しないものに比べて経口毒性が約700倍高くなることが知られています。本毒素の小腸からの吸収を促進する重要な分子である一方で、分子量470 kDa の巨大分子であることに加えて、複数のサブコンポーネント(HA1、HA2、HA3)から構成されており、構造解析が困難とされていました。本研究では、HA の構造基盤の構築を目的とし、X 線結晶構造解析の手法によりHAの立体構造を3.5 Å分解能で決定しました。HA は三脚巴(トリスケリオン)様の三量体を形成しており、単量体では “y” 字型の構造であることが明らかとなりました。HA は複数の機能を有し、ボツリヌス神経毒素の宿主侵入機構に深く関わるタンパク質であることから、その全容を捉え、構造基盤を構築することができたことは意義深いと感じています。
1P-009 西川 亮汰(横浜国立大学大学院 工学府機能発現専攻)

この度、第14回日本蛋白質科学会年会においてポスター賞を賜り、大変光栄に思っております。審査を担当してくださった先生方、運営委員の方々に深く感謝いたします。私はレチナールを発色団とする光受容膜蛋白質であるロドプシンの研究を行っています。ロドプシン類の中でも、私の研究対象である ppR が属する光センサー系蛋白質の研究は、試料調製の難しさなどの理由から、活性発現メカニズムにおいて解明されていない部分が多くあります。ppR は、紫外光を受容して細菌の鞭毛回転を調節し、忌避応答させる蛋白質です。本研究では、機能発現に重要と考えられているアミノ酸残基とレチナールに選択的 13C 安定同位体標識を施した蛋白質試料を精製し、13C スピン拡散 2D 固体 NMR 法を用いて測定を行いました。これにより、ppR の活性発現には、基底状態におけるレチナール–タンパク質間相互作用が重要であることを示しました。近年、光センサー系蛋白質の活性発現メカニズムの解明が、光によって細菌の運動を制御できるツールの開発(オプトジェネティクス)にも繋がると考えられており、非常に興味深い研究対象であると感じています。また、固体 NMR は膜蛋白質をネイティブに近い状態で解析できるという点で、この研究に適した分光法であるといえます。今後も、この受賞を更なるモチベーションとし、固体 NMR を用いて研究に励んでいきたいと思います。最後に、指導教員である内藤先生、川村先生、研究室のメンバーにこの場を借りて御礼申し上げます。
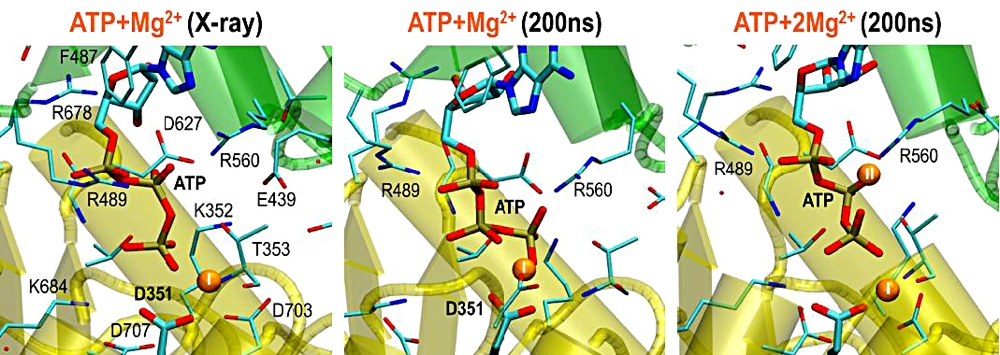
1P-050 小室 靖明(中央大学大学院 理工学研究科 物理学専攻/理化学研究所 杉田理論分子科学研究室)

第14回日本蛋白質科学会にてポスター賞を戴き、学会に携わる皆様に深く御礼を申し上げます。私は、中央大(蛋白質一分子実験)と理化学研究所・杉田理論分子科学研究室に在籍し研究を行っています。カルシウムポンプは P 型の ATP 加水分解酵素であり、筋小胞体膜に存在する膜蛋白質です。1個の ATP を加水分解し2個の Ca2+ を細胞質から小胞体内腔へ能動輸送することで筋肉の収縮弛緩を司ります。これまで X 線結晶構造解析によって輸送サイクルに含まれる複数の反応中間体の立体構造が決定され、カルシウムポンプは大規模な構造変化によりイオン輸送を実現していることが明らかになりました。私は加水分解とリン酸化前後の ATP/ADP がどのようにカルシウムポンプと安定に結合し相互作用をしているのかを解明するため、分子動力学計算と量子化学計算を用いた解析を行いました。得られた結果から、配位する Mg2+ の個数が ATP の結合安定性に重要な役割を果たしていることが示唆されました。今後は、カルシウムポンプの局所的な分子機構だけでなく、大規模な構造の遷移を分子動力学計算によって実現し、詳細な構造解析と自由エネルギー変化量を求める方針です。
1P-078 小佐野 由貴(東京工業大学大学院 生命理工学研究科)

大腸菌において形成されたタンパク質凝集体は、細胞の両端(極)に局在化することが明らかになっています。しかし、凝集体の形成と局在化がどのように進行するのかについてはよくわかっておりません。そこで本研究では、顕微鏡下で生きた大腸菌を経時的に観察する系を構築し、ミスフォールドタンパク質の凝集と局在化の過程を1細胞レベルで時間的、空間的に明らかにすることを目的としています。
凝集体を評価するためにスプリット GFP を、ミスフォールドしやすいタンパク質として GroEL/ES 依存基質を、顕微鏡下で大腸菌を生育するために寒天培地を用いました。この系を用いて、生きた大腸菌における凝集体の形成と局在化を経時的に観察することに成功しました。また1細胞レベルでの輝点の蛍光強度の経時変化を解析し、時間とともに凝集体のサイズが大きくなるようすを定量的に捉えることができました。さらに解析の結果、凝集させるタンパク質の種類の違いで凝集体形成が起こるタイミングに違いがあることが示唆されました。
今後は凝集体の局在化とシャペロン・プロテアーゼとの関係性や、FCS(蛍光相関分光法)やFRAP(蛍光退色後回復法)を用いて凝集体の形成と細胞質での凝集性タンパク質の動態を明らかにしたいと考えています。
まだまだ未熟者ではありますが、ポスター賞受賞を励みにこれからも精進していきたいと思います。
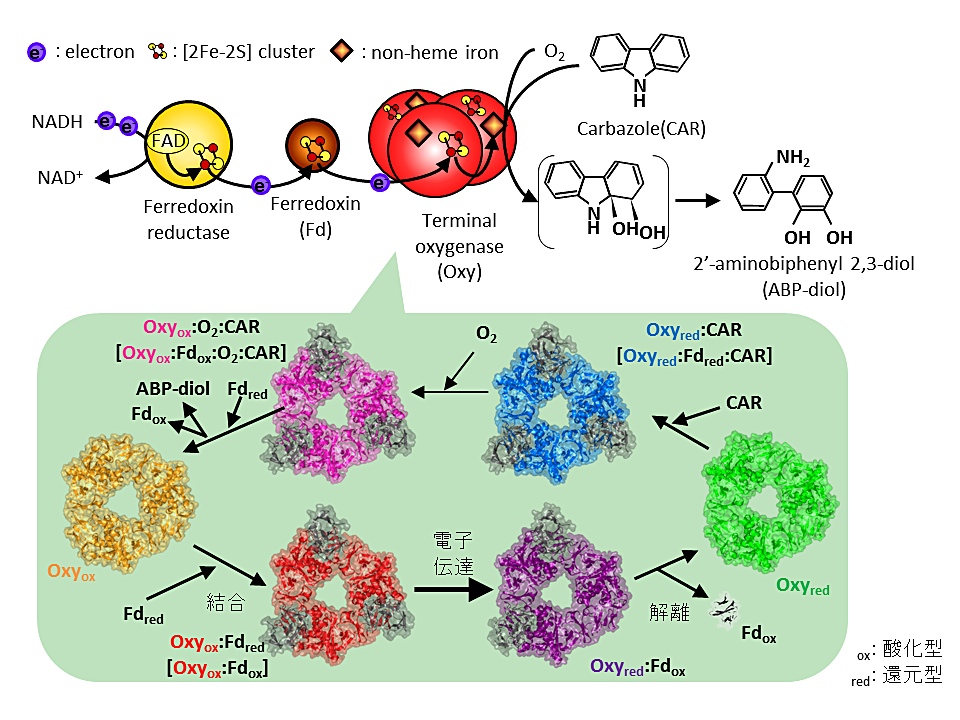
1P-080 松澤 淳(東京大学 生物工学センター)
コンポーネント間での電子伝達は酸化還元に関わる反応で良くみられ、呼吸や光合成の過程にも含まれる重要な現象である。コンポーネント間での効率の良い電子伝達を行うためには、電子伝達前のコンポーネント間では親和性が高く、一方で電子伝達後には親和性が低下していることが望ましい。しかしその重要性とは裏腹に、電子伝達によって変化する各コンポーネントの酸化還元状態を制御して電子伝達現象を解明してきた例はあまり多くない。
当研究室では、含窒素芳香族化合物 carbazole(CAR)の細菌による代謝反応における初発酸化酵素である CAR 1,9a-dioxygenase(CARDO)について長年研究してきた。CARDO は CAR の1位と 9a 位に2つの水酸基を cis 型に添加する酵素であり、terminal oxygenase(Oxy)、ferredoxin(Fd)、Fd reductase の3つのコンポーネントから構成される。類似の酵素群の中で CARDO は唯一 Oxy:Fd 複合体の構造が明らかになっており、これより両コンポーネントの相互作用部位が明らかにされていた。私の研究では嫌気チャンバーを用いて各コンポーネントの酸化還元状態を厳密に制御して構造解析を行い、電子伝達前後の相互作用の変化をもたらす構造因子の解明を行っている。今回の発表では還元型 Oxy:酸化型 Fd 複合体や還元型 Oxy の構造を取得して酸化還元依存的な構造変化などを明らかにし、生化学的な解析によってその機能を証明した。今後は CARDO で明らかにしたコンポーネント間電子伝達機構の一般性を検証するため、類似酵素における電子伝達機構を解明していく予定である。
1P-091 白濱 亮(東京工業大学大学院 生命理工学研究科)

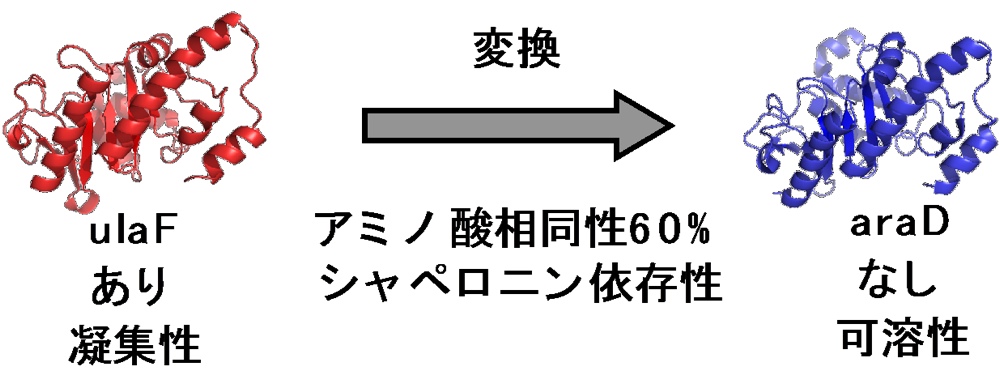
タンパク質はフォールディングに失敗すると凝集体を形成してしまい、本来の機能を発揮できなくなります。凝集体の形成はタンパク質を扱う上で障害となっており、凝集性タンパク質を可溶性に変換する方法論の確立が望まれています。
本研究では、大腸菌のシャペロニン GroEL において、細胞内 GroEL 依存性基質が非常に凝集しやすいことに着目をし、GroEL 依存性を変換することによる凝集性の変換を目指しています。もし凝集性のタンパク質を可溶性に変換するための方法論を見出すことができれば、今まで扱いの難しさから目をそらされてきた凝集性のタンパク質の研究が活発に行われるようになり、タンパク質科学の発展、さらには生命の理解が大きく進歩する可能性もあります。壮大で荒唐無稽な研究テーマかもしれませんが、今回のポスター賞受賞はそのような “夢” に近づいた一つの証なのではないかと考えております。今後、GroEL 依存性さらには凝集性の本質とは何なのかを明らかにすべく、研究に邁進していきたいです。
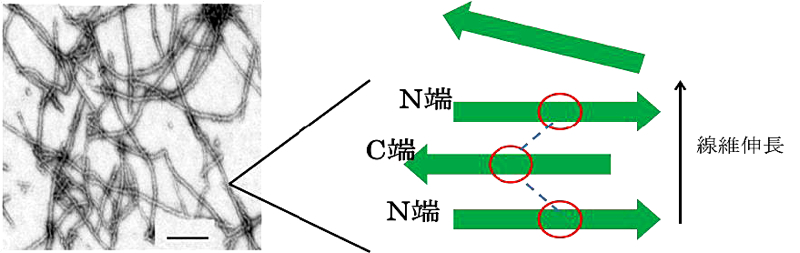
1P-102 豊田 修平(横浜国立大学大学院 工学府機能発現工学専攻)

ヒトカルシトニンは人体の甲状腺より分泌される32残基ペプチドホルモンです。骨にある破骨細胞に作用し、骨からの Ca の放出を抑制する働きがあります。このホルモンは骨粗鬆症の薬として使用されていたのですが、高濃度や中性条件下において容易にアミロイド線維を形成することが明らかになりました。このアミロイドは線維形成過程で破骨細胞に対して不活性になったり、また線維中間体には細胞毒性も疑われているため、人体に対して悪影響を及ぼすことが考えられます。本研究ではこの線維形成を阻害する手掛かりを探るために、固体 NMR の REODR 法により特定の 13C–15N 核間の距離を調べることで、線維構造の解析を行いました。その結果、線維は [1-13C]F16 と [15N]F19 が1残基ずれた場所に存在する逆平行βシート構造をとっていることが明らかになりました。
さらに、MD シミュレーションによってペプチド側鎖間に生じる相互作用を調べたところ、π–π相互作用など芳香環を利用した相互作用が線維の構造を安定化させている事も分かりました。これらの結果は、今後ヒトカルシトニンや他のアミロイド線維形成メカニズムを知るために非常に有用な情報であると思われます。
2P-004 森田 純子(東京大学大学院 理学系研究科 生物科学専攻)

私は真核生物の細胞外酵素を対象としたX線結晶構造解析を行っています。コリンはヒトの必須栄養素であり、神経伝達物質のアセチルコリンや生体膜を構成するホスファチジルコリンの成分となります。Enpp6 は in vitro でリゾホスファチジルコリンなどのコリン含有ホスホジエステルを加水分解する細胞外酵素であり、生体内でコリン代謝に関わっていることが示唆されていますが、これまで Enpp6 のコリン認識メカニズムは明らかになっていませんでした。
そこで私はマウス Enpp6 と、その加水分解産物であるホスホコリンの複合体構造を1.8 Åの分解能で決定しました。今回のポスターでは得られた Enpp6 の構造に基づいた、Enpp6 のホスホコリン認識機構について議論を行いました。今後もタンパク質の構造をもとに、生命現象を支える分子が機能するメカニズムを明らかにする研究を進めていきたいと考えています。
最後に、日々ご指導を賜っている濡木先生はじめ研究室のみなさま、特に妥協のない研究指導で私を今日まで大いに刺激し奮い立たせてくれた西増先生と加藤一希さん、また共同研究先であり常に親身で適切なアドバイスをくださる東北大学の青木研究室のみなさまに、この場を借りて厚くお礼を申し上げます。
2P-012 平林 佳(大阪大学大学院 理学研究科 生物科学専攻)

この度は、ポスター賞を頂くことができ大変光栄に思っております。この場をお借りして皆様に御礼申し上げます。ここでは、私の研究内容について簡単に御紹介させて頂きます。
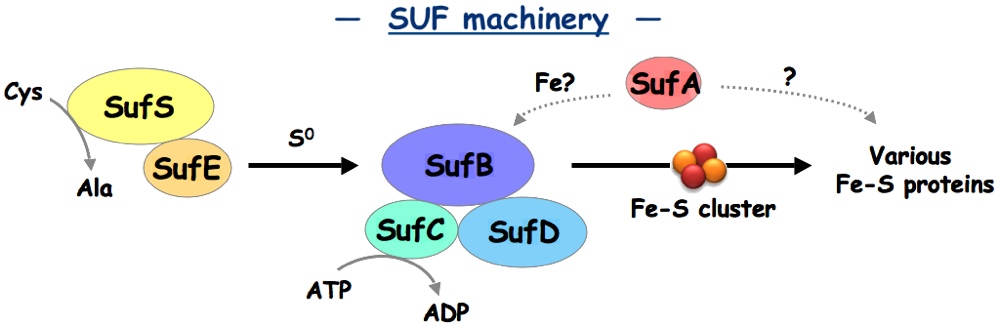
私達が扱っているのは「Fe-S クラスター」と呼ばれる蛋白質のコファクターです。聞き慣れない方も多いかもしれませんが、我々ヒトを含むほぼ全ての生物が持ち、主要な生体反応で活性中心として働いています。私達は、このFe-Sクラスターが、生体内でいかに作り上げられているのか、その生合成系についての研究を行っています。
これまでの研究から、Fe-S クラスターは、SUF 蛋白質群と呼ばれる、6つの蛋白質の共同作業で合成されることがわかってきました。各蛋白質には、Fe-S クラスターの材料の調達・運搬・組立て・組込みなど、それぞれの役割分担があります。中でも、最も大切な役割である組立てを担っているのが、SufBCD と呼ばれる3つの蛋白質の複合体です。興味深いことに、この蛋白質複合体は、ABC トランスポーターに共通して保存される ABC-ATPase ドメインを持っています。もちろん SufBCD は、トランスポーターでもなければ、膜蛋白質でもないため、全く新規な ABC 蛋白質としても注目されています。
私達は現在、この新規 ABC 蛋白質に注目し、合成メカニズムの解明に向けて、構造・機能解析に取り組んでいます。主な研究手法は X 線結晶構造解析ですが、遺伝学/生化学的な手法も駆使した、多面的な解析から生理機能に迫りたいと考えています。もし私達の研究に興味がある方がおられましたら、研究室の HP にぜひお立ち寄り下さい。
2P-090 寺岡 佳晃(大阪府立大学大学院 生命環境科学研究科)

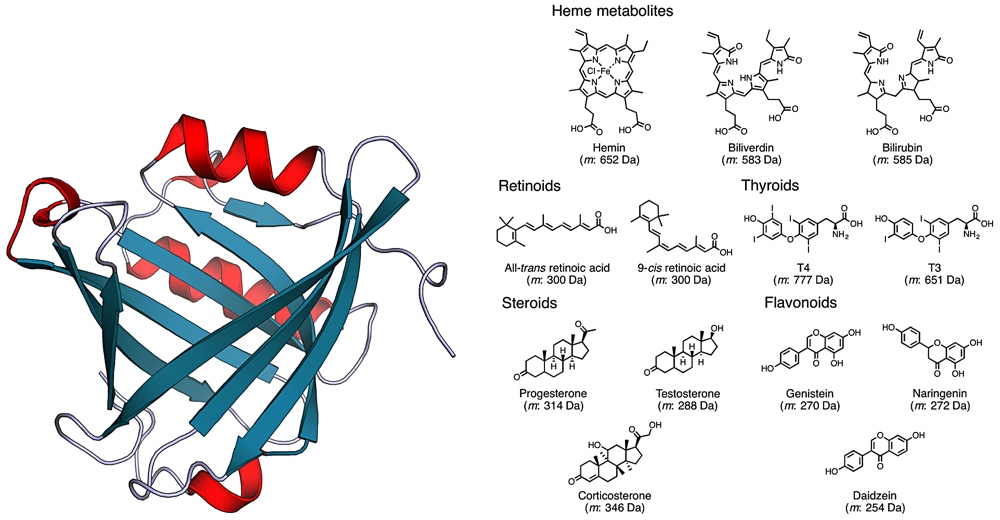
生体高分子とリガンドとの相互作用は、酵素の基質認識、抗原抗体反応、およびシグナル伝達など、多くの基礎的な生命現象を担っています。現在までに、このような相互作用を説明する結合モデルがいくつか提案されていますが、未だ現象を十分に理解できているとはいえません。
例えば、蛋白質の疎水性キャビティにおける脂溶性低分子の結合反応は、脱水和に伴うエントロピー利得を駆動力とする古典的な疎水性相互作用によって説明されてきました。しかしながら、この一般原理は、熱力学量に基づいて実証されているわけではありません。そこで私たちは、リポカリン型プロスタグランジン D 合成酵素(L-PGDS)が、ヘム代謝産物やビタミン A 誘導体などの様々な脂溶性低分子に対して幅広い結合能を有することに着目し、L-PGDS を利用した熱力学的な相互作用研究を実施しました。
等温滴定型熱測定法により、15種類の脂溶性低分子と L-PGDS との結合反応に伴う熱力学量を決定しました。その結果、相互作用の駆動力は、有利なエントロピー項に偏るのではなく、典型的なエンタルピー・エントロピー補償効果が認められました。このことから、L-PGDS の脂溶性低分子に対する幅広い結合能は、疎水性相互作用に伴うエントロピー利得だけでは単純に説明できず、水素結合や静電相互作用に伴うエンタルピー利得によって繊細に調節されていることが示唆されました。
今後も私は、物理化学的、および計算科学的な手法を駆使した研究を行い、生体高分子とリガンドとの相互作用について深く理解したいと考えています。
2P-117 中辻 匡俊(大阪府立大学大学院 生命環境科学研究科)

リポカリン型プロスタグランジン D 合成酵素(L-PGDS)は生体内輸送蛋白質群に属し、様々な疎水性低分子を結合する。我々は、L-PGDS の本機能に着目し、難水溶性抗癌剤 SN-38 に対するドラッグデリバリーシステム(DDS)の開発を目指している。本研究では、腫瘍標的ペプチドを L-PGDS に付加することにより、腫瘍にのみ SN-38 を輸送する効率的な DDS の構築を試みた。
腫瘍標的 L-PGDS の癌細胞内への取り込みを確認するために、N 末端に EGFP を融合した L-PGDS、および腫瘍標的 L-PGDS を作製した。これらの蛋白質をヒト前立腺癌細胞 PC-3 培養液中に添加し、共焦点レーザー蛍光顕微鏡を用いて細胞内への取り込みの有無を調べた。その結果、PC-3 細胞内において腫瘍標的 L-PGDS の存在が確認された。さらに、SN-38 を各蛋白質に内包し、PC-3 細胞に対する細胞毒性を調べた。300 nM の SN-38 を内包した腫瘍標的 L-PGDS 存在下では、同濃度の SN-38 を内包した L-PGDS と比べ、有意な細胞生存率の減少が見られた。以上の結果から、L-PGDS に腫瘍標的機能を付加することにより、in vitro において SN-38 を効率的に癌細胞内に輸送できることが示された。
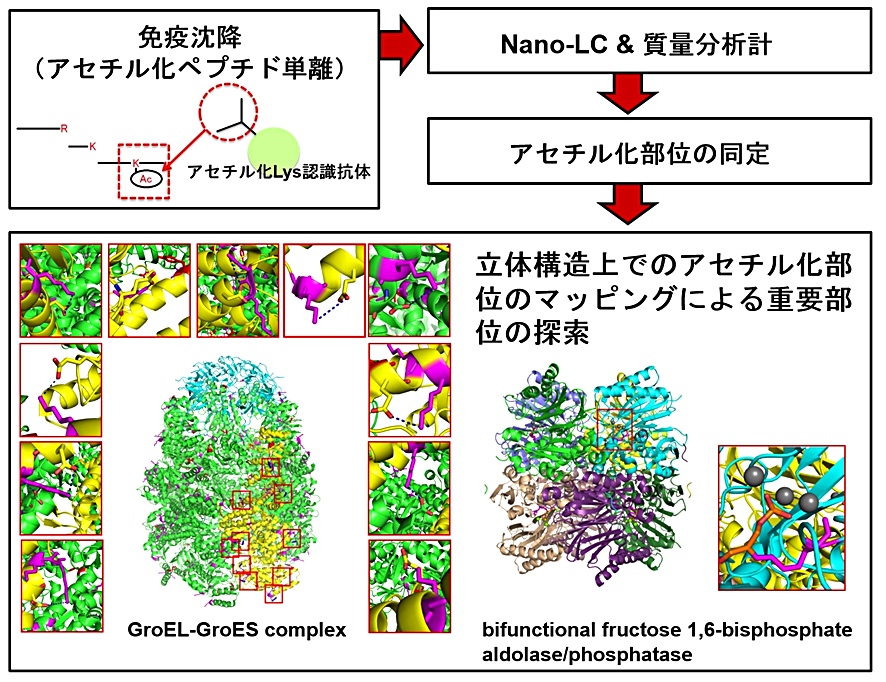
2P-125 岡西 広樹(大阪大学大学院 理学研究科)

バクテリアにおける細胞内翻訳後修飾アシル化システムの解明
蛋白質の翻訳後修飾は生体内での蛋白質の働きを制御する重要な現象であり、これまでに500種類以上の翻訳後修飾が報告されている。そのなかでも蛋白質中の Lys 残基に起こるアセチル化は主要な翻訳後修飾の一つである。最近の研究により、ヒトを含む真核生物の蛋白質に多くのアセチル化が検出されており、ガンをはじめとする疾患にも関与することが示唆されている。さらに近年、真正細菌においても同様にアセチル化が多く存在することが明らかになり、Lys 残基のアセチル化は生物に共通した現象であることが分かってきた。このように重要性が示唆されているアセチル化の役割を理解するために、遺伝子数が少なくてシンプルであり、蛋白質が扱い易く、機能を調べる手掛かりとなる立体構造情報も豊富な高度好熱菌をモデル生物として、細胞全体のアセチル化システムの研究を行いたいと考えている。そこでまず、アセチル化プロテオーム解析を行い、200箇所近くのアセチル化部位を同定した。その後、立体構造情報を利用することによって、22箇所が重要な部位の Lys 残基であることを明らかにした(Okanishi et al. (2013) J. Proteome Res. 12, 3952–3968)。また、アセチル化以外の Lys 残基のアシル化として、アセチル化より炭素鎖が一つ長いプロピオニル化が生体内に豊富に存在することを発見した(Okanishi et al. (2014) Mol. Cell. Proteomics, in press)。今後は、これらのアシル化がどのように働き、どのように使い分けられているのかを、アシル化に関与する蛋白質群の構造と機能から、細胞全体で明らかにしていきたいと考えている。