本年度の若手奨励賞受賞者の3人にご自身の研究などについて自由に書いていただきました。
【若手奨励賞3名】
- 2SA-2 古賀 信康(ワシントン大)
- 題目:理想蛋白質構造のデザイン原理
- 2SA-6 谷中 冴子(サントリー生命科学財団)
- 題目:ヒト主要組織適合複合体の動的なペプチド認識および構造維持機構
- 2SA-9 藤井 勇樹(大阪大)
- 題目:PA タグを用いた新規アフィニティータグシステムの確立
理想蛋白質立体構造のデザイン原理
古賀 信康(ワシントン大学生化学科)

私が初めて参加した学会は第1回蛋白質科学会である。当時は M1 の学生であり12年後に若手奨励賞を頂けるとは夢にも思わなかった。そのときに発表した内容は、蛋白質の折りたたみ機構に関する「郷モデル」を用いた計算機シミュレーションによる研究である。「蛋白質は進化の結果としてファネル(漏斗)型のエネルギー地形を持つ」。これは1990年頃に Wolynes らにより提唱された折りたたみに関する仮説であり、「郷モデル」はこのファネル型エネルギー地形を具現化するモデルである。私は、郷モデルが小さな蛋白質の折りたたみ機構をよく再現することを明らかにし、上記の仮説の妥当性を示した。それでは「ファネル型エネルギー地形はどのようにアミノ酸配列にエンコードされているのだろうか?」。私は妻とワシントン大学の Baker 研究室において、蛋白質の立体構造をデザインすることにより、ファネル型エネルギー地形の成り立ちについて明らかにしようと試みた。
ヒントとなったのは1983年に郷信広先生が提案した「整合性原理」と、2006年の千見寺らによるファネル型エネルギー地形に関する考察である。郷は「局所」相互作用(2次構造を安定にするような、配列に沿って近いアミノ酸同士の相互作用)と「非局所」相互作用(3次構造を安定にするような、配列に沿って遠いアミノ酸同士の相互作用)は、整合して(お互いに辻褄が合って矛盾なく)折りたたみ後の天然構造を安定化していると考えた。千見寺らはこの考えを推し進め、整合する局所および非局所相互作用において、局所相互作用が構造を部分的に制限すれば、その制限された局所構造と不整合な3次構造は不安定になり、結果として蛋白質のエネルギー地形はファネル型になると考察した。
我々はこれらの考えを受け、整合性原理を“完全に”満たすような“理想”構造を設計すれば、ファネル型エネルギー地形を持つ蛋白質を容易にデザインできるのではないかと仮説を立て研究を行った。そこでまず、局所構造として2次構造パターンに着目し、蛋白質がある2次構造パターンを形成したときに、どのような非局所構造(3次構造モチーフ)が整合して形成されるのかについて調べることから研究をはじめた。連続する2つの2次構造要素:ββ、βα、αβが1本のループでつながったペプチドについて、アミノ酸配列の詳細に依存しない粗視化モデルを構築し、ループの長さを変えながら伸びた構造からの折りたたみシミュレーションを行い、どのような3次構造モチーフが高い確率で形成されるか調べた。その結果、以下に示す整合する2次構造パターンと3次構造モチーフに関するルールを発見した。さらに、これらのルールは自然界の蛋白質構造においても観測された。
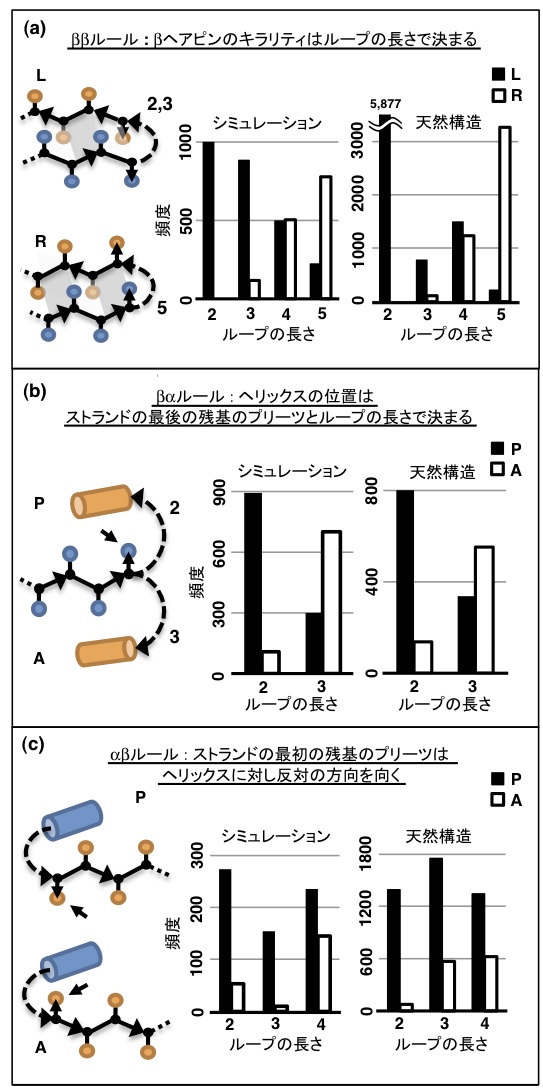
- ββルール:
- βヘアピンのキラリティは、その2つのストランド間にあるループの長さによって決まる(図1a)。ループの長さが2、3残基の場合は L(左手)のキラリティをもつ構造が、5残基の場合は R(右手)のキラリティをもつ構造が形成されやすい。
- βαルール:
- ヘリックスの位置は、ストランドの最後の残基のプリーツと、ストランドとヘリックスの間のループの長さによって決まる(図1b)。βαユニットが形成する3次構造モチーフは、ストランドの最後の残基のプリーツ(CαCβベクトル)に対して、ヘリックスが同じ方向(P)または逆の方向(A)に位置するかにより分類できる。ループの長さが2残基のときに P、3残基のときに A の構造が形成されやすい。
- αβルール:
- ストランドの最初の残基のプリーツはヘリックスに対し反対の方向を向く(図1c)。αβユニットが形成する3次構造モチーフは、ストランドの最初の残基のプリーツが、ヘリックスの側を向く場合(A)とそれとは反対側(P)を向く場合が考えられるが、ループの長さに関係なく P の構造が形成されやすい。
発見したルールを用いて2次構造の長さを選んで3次元主鎖構造を組み立て、その2次構造および3次構造を安定にするようにアミノ酸配列をデザインすれば、ファネル型エネルギー地形を持つ蛋白質を容易に得られるはずである。なぜなら、ルールに従い設定した2次構造パターンが局所的に形成されれば、それとは整合しない3次構造は不安定になるからである。このアイデアをαヘリックスとβストランド両方からなる5つの異なるトポロジー(Fold-I〜V)の蛋白質をデザインすることにより確かめた。図2aは、各々のトポロジーについて、ルールに従い決定された主鎖構造の設計図を表している。蛋白質デザインソフトウエア Rosetta を用いて、この設計図に基づき主鎖構造を構築し、この構造を安定にするようにアミノ酸配列をデザインした。最終的に、in silico でファネル型エネルギー地形を有していたデザインに関して実験的に折りたたみ能を調べた。
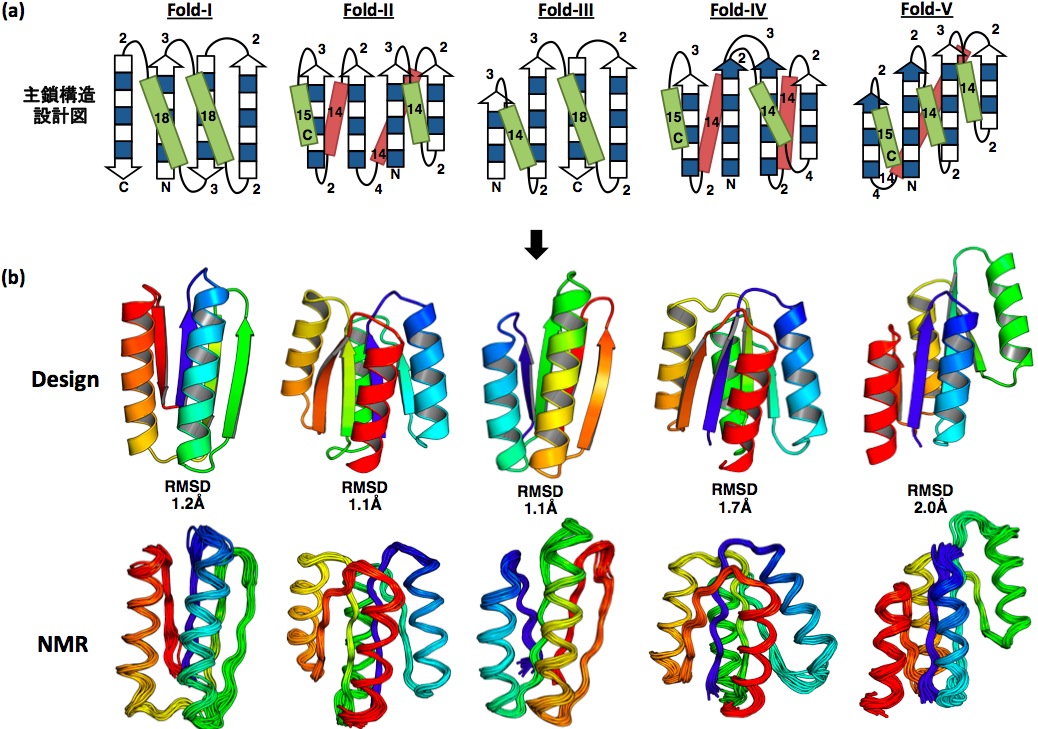
Fold-I〜V についてそれぞれ11個、12個、14個、5個、12個のデザインの折り畳み能を実験的に調べた。これらのアミノ酸配列は天然には相同な配列が全くない新規の配列であった。デザインした配列を大腸菌に組み込み、発現、精製を行い、円偏光二色性、サイズ排除クロマトグラフィー-多角度光散乱、NMR を用いて折りたたみ能を測定した。その結果、1)発現、2)可溶、3)αβ蛋白質に特徴的な円偏光二色性スペクトル、4)変性温度が95℃以上、5)単量体、6)シャープで分散の大きい NMR スペクトル、の6つの条件を満たしたデザインの数は、Fold-I〜V についてそれぞれ1個、4個、3個、2個、1個であった。これらのうち最もシャープで分散の大きい NMR スペクトルを示したデザインをそれぞれのトポロジーから1つ選び NMR により構造を決定した。解かれた NMR 構造は計算機によるデザイン構造とよく一致していた(図2b)。
我々は、整合する2次構造パターンと3次構造モチーフに関するルールを発見し、これらのルールに基づいて構造を組み立てることによって、ファネル型エネルギー地形を持つ蛋白質を容易に設計できることを示した。これらのルールが自然界の蛋白質の構造においても観測されたことから、自然界の蛋白質のファネル型エネルギー地形も同様の原理により形成されていると考えられる。
ヒト主要組織適合複合体の動的なペプチド認識および構造維持機構
谷中 冴子(サントリー生命科学財団)

本発表の概要
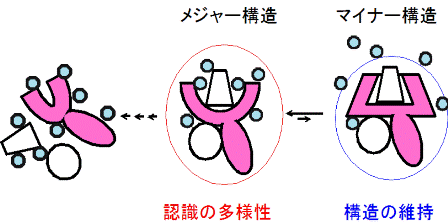
ヒト主要組織適合複合体(HLA)は抗原蛋白質から切り出された様々な抗原ペプチドと結合し、それぞれに特異的な細胞傷害性T細胞(CTL)を活性化する抗原提示に重要な蛋白質である。既にHLAと様々なペプチドとの複合体の結晶構造が明らかにしているがそれらの結晶構造に大きな差異はない。一方、HLA の CTL 活性持続時間は提示するペプチドによって大きく異なり、本研究で用いた HLA-B*3501 について円偏光二色性(CD)の測定から、変性中点温度と細胞中での活性持続時間との間に相関がある事が明らかにされている (1)。また、示差走査熱量測定(DSC)の結果は溶液中の構造の差異を示唆していた。結晶構造では確認されない構造の差異が溶液中に存在する理由として、溶液中には準安定なマイナー構造が存在し、最安定構造とのアンサンブル構造を取ることが考えられる。そこで、活性持続時間が異なる二つの HLA ペプチド VY8-5A、VY8-3A、RY11-8A に着目し、溶液構造のマイナー構造の特徴を原子分解能で解析できる、NMR 緩和分散測定による動的構造解析を行った。その結果、特にペプチドと HLA 重鎖の結合部位に揺らぐ残基が多く見られ、活性持続時間の長く熱安定な HLA の方が揺らぎやすいことが明らかとなった。更に、緩和分散の温度依存性の解析から、マイナー構造はタイトにパッキングした構造であることが示された。HLA はペプチドが結合している周辺の残基を動的に構造変化させ、タイトにパッキングすることで、構造を維持していると考えられる。また、ルースにペプチドと結合したメジャー構造が多様なペプチドの認識に重要であると考えられる。
1) Morozono, C. et al. J. Immunol. (2009)
NMR と緩和分散法の蛋白質研究への応用について
マクロな系における蛋白質相互作用の速度論的、熱力学的な解析を得意とする津本研究室に在籍していた筆者が思うNMRの強みは、ミクロな残基レベルでの速度論的、熱力学的な解析を行えることである。マクロな系においては、蛋白質の残基レベルの影響は変異導入により検証されてきたが、変異導入により狙った効果以外の作用がもたらされることも多く、時にその影響は複雑となる。一方、NMR を用いることで、変異を導入すること無く残基レベルの定量的な解析が可能となる。更に、緩和分散法を用いると溶液中のマイナー構造の情報を得ることができる。つまり、各種反応中間体と言う、従来法では見ることのできなかった構造情報を得られる。このような中間体構造は特に酵素を用いた研究において緩和分散法が適用されることで明らかとなってきており、低存在比ながらも反応過程を制御すると考えられるようになってきている。HLA の場合には緩和分散法で初めて明らかとなったマイナー構造が安定性を制御するということを示すことができた。そして、低存在比であっても非常に速いタイムスケールで起きる反応であるため、遅いタイムスケールで起きる分解反応を制御していることが示唆された。HLA のマイナー構造形成は更に、レセプターとの結合において必要である可能性がある。他のタンパク質では、菅瀬博士らが pKID/KIX の相互作用において、過渡的遭遇複合体が相互作用過程に存在することを明らかにした (2)。HLA 以外の蛋白質についても緩和分散法を用いることが、様々な反応過程の制御機構を明らかにする上で有用となるであろう。緩和分散測定の詳細は2013年12月までに公開される、蛋白質科学会アーカイブを参考にしていただきたい。
(2)Sugase, K. et al. Nature (2007)
受賞の感想と今後の目標
修士課程二年生当時、筆者は東京大学大学院新領域創成科学研究科、津本研究室に所属しており、タンパク質の構造については結晶構造解析を少々学んだことがある程度であった。しかし、生化学若い研究者の会の活動を通して菅瀬謙治博士と知り合い、NMR による蛋白質の動的構造解析法を知ったことで共同研究に至った。本研究の実現をサポートしていただいた津本教授と菅瀬博士に深く感謝したい。学会の段階でまだ論文となっていない内容に対する受賞は、研究の将来性を期待されての受賞であったと思う。様々な先生方の支援に感謝すると共に、今後も引き続き NMR を用いた解析法を学び、NMR の強みを生かした新しい現象の理解や蛋白質のデザインなどを行なっていきたい。
PA タグを用いた新規アフィニティータグシステムの確立
藤井 勇樹(大阪大)

蛋白質の解析において、サンプル調製というステップは非常に重要です。その中でも特に重要なのが「精製」です。精製度が低い蛋白質を用いた実験では、本当に目的蛋白質の挙動を追えているかどうかは不確かであり、信頼性が高いデータは得られません(結晶化のように不純物があった方が核となり都合が良い場合もありますが)。そこで私は、PA タグシステムという新規アフィニティータグ精製システムを確立しました。PA タグシステムは非常に高い親和性を有しながらも、競合ペプチドで簡単に溶出でき、さらには再生することにより複数回使用可能な優れたタグ精製システムです。そのため、現存する精製システムでは精製不可能だった蛋白質や、収量が少ないがために解析へ進むことができなかった蛋白質の機能解析に大きく貢献できると考えられます。現在、このシステムのさらなるブラッシュアップを試みており、商品化への準備を進めています。
しかしこの研究は、私が大阪大学蛋白質研究所分子創製学研究室(高木研)にお世話になり始めた昨年度から始めたものであり未発表です。そのため、この場ではあまり詳細に記すことはできません。そこでこの場では、私の研究室を変えることになったキッカケや、現在の研究のモチベーションについて拙文ながら記していきたいと思います。そもそも私は、修士課程に在籍していた2年前までは、現在とは用いる技術も材料も大きく異なる環境下でプロテインエンジニアリングの研究を行っていました。しかし、研究を進めていくうちに、蛋白質を改良するためには蛋白質の立体構造、特にリガンドとの複合体の立体構造から得られる情報が非常に重要であると強く感じました。そこで、あくまでもツールとして構造解析を行っており、そこからの蛋白質解析に重きを置いていた高木研への進学を、実家を飛び出してまで敢行しました。その結果、充実した研究生活を送ることができ、修士課程までは鳴かず飛ばずであった私が、わずか一年間の研究でこのような素晴らしい賞を受賞することができました。今振り返ってみると、この思い切った決断は非常に意義があったと思います。まだ博士課程在学の身でこのようなことを書くのは気が引けますが、もし現在の研究室で自分のやりたい研究ができずに燻っている学生の方がいらっしゃるならば、思い切って研究室を変えてみるのもよいと思います。

また、私の最終的な研究目標は、まず蛋白質の機能解析を試み、その情報を基にプロテインエンジニアリングを行い、人類に取って有用な蛋白質を作り出すことです。現在はその初期段階である解析する「もの」を取るための技術を開発している段階であり、道のりは非常に長いです。さらには、全てが順調にいくわけがないので、その道程には数多くの困難が待ち受けていることが想定されます。しかし、自分が好きなことをやっていることもあり、そのような困難への挑戦は楽しみでもあります。今後は、これまで用いてきた生化学的な実験手法だけでなく、バイオインフォマティクス的手法等も取り入れて、プロテインエンジニアリングを行っていきたいと考えています。
最後に、今回の受賞は巡り合わせもさることながら、多くの方々の協力の下に成り立っていると痛感しています。特に、時間がないながらも日々のディスカッションにお付き合いしてくださった高木淳一教授、見も知らぬ学生に自分の研究テーマの一つを委ねてくださった東北大学の加藤幸成教授、修士課程卒業までの3年間で研究やプレゼンの基礎を叩き込んでくださった東京農工大学の佐藤令一教授、および高木研のメンバーの方々に深く感謝します。
