本年度第13回年会におけるポスター賞受賞者の方から原稿をいただきましたのでここにお知らせします(演題番号順)。
1P-008 丹治裕美(東京大学大学院薬学系研究科)

Toll 様受容体(TLR)は病原体の分子パターンを認識して自然免疫系を活性化させる I 型膜貫通受容体であり、そのひとつ TLR8 はウィルス由来の一本鎖 RNA やイミダゾキノリン系低分子化合物で活性化しますが、今まで構造科学的な研究は行われていませんでした。本研究では、TLR8 によるリガンド認識機構及びシグナル伝達機構を解明するため、ヒト TLR8 細胞外ドメイン全長について非結合型及び低分子リガンド結合型の X 線結晶構造解析を行い、非結合型は分解能2.3 Å、リガンド結合型は分解能2.0〜2.7 Åで構造決定しました。その結果、非結合型およびリガンド結合型 TLR8 は、いずれもリング状の TLR8 分子が C 末端で向かい合った2量体を形成していました。リガンドは2量体界面の2箇所に結合しており、スタッキング相互作用や水素結合などにより認識されていました。
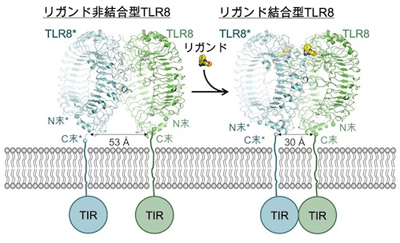
また、リガンド結合によって2量体が再構成され C 末端同士が接近することが分かりました。生体内では2量体の再構成に伴い細胞内の TIR ドメインも2量体化して、シグナルが細胞内へ伝えられると考えられます。TLR8 による詳細なリガンド認識機構の解明はもちろん、TLR において2量体の再構成によるシグナル伝達機構が明らかになったのは今回が初めてであり、本研究は極めて意義深いものだと考えています。
1P-009 寺坂瑛里奈(兵庫県立大学大学院生命理学研究科)

微生物がエネルギーを得るために行う脱窒(NO3-→NO2-→NO→N2O→N2への段階的還元)においては、中間生成物として細胞毒性の高い NO が生成される。このことから、脱窒過程において NO を生成する亜硝酸還元酵素(NIR)と NO を還元する膜結合型一酸化窒素還元酵素(NOR)が超分子複合体を形成し、効率的に NO を分解することで NO による細胞損傷を防いでいると仮説を立てた。本研究では、この仮説に基づき X 線結晶構造解析による NOR-NIR 複合体形成の検討を行った。NOR と NIR の混合溶液から得られた結晶について X 線回折実験を行ったところ、異なる2つの空間群の構造データ(それぞれ4.7 Å、6.5 Å分解能)が得られた。
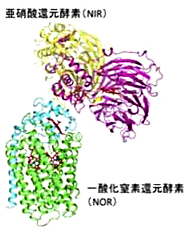
既知の NOR と NIR の構造を用いて分子置換を行った結果、NOR と NIR が1:1の割合で複合体を形成していることが明らかとなった。今回得られたデータからは、相互作用様式の異なる複数の NOR と NIR 複合体の構造が得られているが、予想される相互作用残基と NOR が膜タンパク質であることを考慮すると、図1に示したように、NOR の親水性ドメインと NIR のヘム c ドメインが相互作用している構造が生体内での構造を反映していると考えられる。今後は物理化学的・分光学的なタンパク質間相互作用の検出、分解能向上を目指した結晶化条件の検討を行い、脱窒酵素による超分子複合体形成を証明し、高効率な NO 還元機構を明らかにしたいと考えている。
1P-060 若井信彦(東京大学大学院新領域創成科学研究科)

研究の対象としているアクチンは筋収縮や細胞の動態に関わる重要なタンパク質である.アクチン繊維長の変化はアクチン分子の動的性質に深く関わっていると考えられているが,分子レベルの繊維伸長メカニズムは十分解明されていない.アクチン単量体の結晶構造及び低温電子顕微鏡による繊維構造の比較からは,4個のサブドメインで構成されるプロペラ角と呼ばれる二面角のずれが顕著であることが明らかになっている.本研究では,単量体と重合体(五量体,六量体,七量体)の構造をモデリングし,分子動力学シミュレーションを用いて解析した.その結果,プロペラ角のヒンジ領域周辺の塩橋形成が結合しているヌクレオチドによって変化していることが明らかになった.また,繊維末端に2個目の ATP 結合型アクチンが重合することにより,末端構造に変化を生じることが示唆される.このことは重合における構造変化において核形成と同様に,複数の末端のアクチン同士の相互作用が重要だと示唆する.今後はより長い繊維構造による解析を行うと共に,ヌクレオチドの違いによる自由エネルギー変化を求める予定である.
1P-061 森脇由隆(東大・院農・応生工)

このたびの第13回日本蛋白質科学会年会にてポスター賞を賜り,先生方並びに運営委員の方々に厚く御礼を申し上げます。私は有機化学が盛んな東京大学の工学部化学生命工学科出身でありながら,修士は新領域創成科学研究科,そして現在は農学生命科学研究科で計算科学・情報科学を中心に学んでいるという,自分でもとても不思議な経歴をしているように思います。しかし,こうした経験から,本研究において1アミノ酸残基レベルでの物理化学な実験・計算により,結晶構造情報からだけでは発見できなかった多くの現象を導き出すことができました。昨今では生命科学の分野や解析手法が非常に多岐にわたるようになってきており,物理学や情報科学をベースにした理論も多く使えるようになっております。加えて,計算機の計算速度の向上も急速であり,理論の発展とともに,長時間の蛋白質や動きや複雑系における生命活動の解析が近いうちに可能になりつつこの時代の流れに取り残されないよう努力していきたいと考えております。
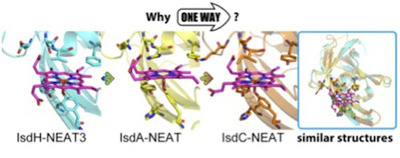
私は引き続き,Isd 蛋白質間でのヘムの輸送に関する考察を行なっております。物質の輸送という現象は生命科学に普遍的なものですが,私はこのような分子レベルでの動きの解明にとても興味を持っております。輸送機構を解明するためには複合体構造の推察や金属周辺の解析も必要になるため量子化学計算も必要であり,まだまだ新たに学ぶべき事が多いですが,計算と実験科学の両方に造詣が深い研究者を目指していきたいと考えております。
1P-077 白石都(九大院・農)

この度の第13回蛋白質科学会におきまして、ポスター賞を受賞できたことを大変光栄に思っております。この受賞は私のこれからの研究において大きな励みとなりました。ご審査下さった先生方、関係者の方々に厚く感謝申し上げます。ありがとうございました。生物の生命活動の上で、遺伝情報を担う DNA には様々な損傷が生じます。例えば、塩基の脱アミノ化は頻繁に起こりますが、アデニンの脱アミノ化塩基(ヒポキサンチン)の修復経路は未だ十分に解明されていません。超好熱性アーキアである Pyrococcus furiosus の細胞抽出液を用いて、ヒポキサンチンの修復に関与するタンパク質のスクリーニングを行ったところ、ヒポキサンチンの 5′ 側を切断する活性が存在することが分かりました。そこで、細胞抽出液からタンパク質を精製し、質量分析によってそのタンパク質を同定しました。このタンパク質には、ヒポキサンチンだけではなく、他の損傷塩基(ウラシル、キサンチン、脱塩基部位)にも同様に作用することも分かりました。さらに、同様の活性を有するタンパク質を近縁種 Thermococcus kodakarensis にも見出しました。同定したこのタンパク質はアーキアの損傷塩基除去修復に関与するタンパク質と考えられ、新たな DNA 修復機構の解明が期待されます。第三の生物であるアーキアの生命現象はどのように営まれているのか、中でも超高温環境下で生息する生物がどのような機構で自らの遺伝情報を守っているのかを想像すると、わくわくするものがあります。この受賞を励みに、博士後期課程に進学して、さらに研究に励みたいと思っております。
1P-083 中澤耕己(東工大・生命理工)

タンパク質は,ひも状のペプチド鎖が正しくフォールディングすることで初めて機能を獲得します.この過程をシャペロンが助けていると言われていますが,翻訳共役的なシャペロンの働きについて細胞内で直接観察した例はこれまでにありません.
本研究では,リボソームでの翻訳後にシャペロンが新生タンパク質のフォールディングを助けるメカニズムを,細胞内かつ分子レベルで観察することで,生きた細胞内でのシャペロンの分子機構を解明することを目標としています.一見すると,試験管内の実験で示唆されたシャペロンの作用モデルを細胞内で証明し直す「だけ」と思われるかもしれません.しかし,多くの分子が混みあい,各因子が複雑に関わり合いながら品質管理を実現している細胞内の環境は,シャペロン研究の新たなステージであると考えられます.タンパク質の社会の一員としてのシャペロンの働きを照らす研究に発展させていきたいです.
本研究の前進にご協力いただいている,田口先生をはじめとする研究室のメンバー,日独で共同研究を進める研究者の方々に,この場を借りて御礼申し上げます.今回のポスター賞受賞を実の伴うものとすべく,今後も研究に励もうと思います.
2P-097 大西由希子(兵庫県立大学大学院生命理学研究科)

兵庫県立大学・阪口研究室・修士2年の大西由希子と申します。この度は光栄な賞をいただきましてありがとうございます。評価をいただいた先生方をはじめ、ポスター発表で貴重なアドバイスをくださいました多くの方々に心より御礼申し上げます。今回は学会ニュースレターに執筆の機会をいただけるということで、研究内容について書かせていただきます。
今回のポスターでは、中程度の疎水性配列を持ったポリペプチド鎖の膜組み込みが、リボソームによって制御される準安定な段階を経て進行するという内容で発表しました。研究のきっかけは、同じ疎水性配列を持ったポリペプチド鎖でも、C 末端がリボソームから解離した場合には膜透過が停止するのに対して、リボソームに結合したままだと膜透過してしまうという偶然の発見と、教授の「ビックリだ、面白い」から始まりました。これまで、疎水性配列の膜への組み込みは、膜透過チャネルであるトランスロコンでおこる膜脂質への単純な分配現象だと考えられてきました。しかし、リボソームの有無による疎水性配列の運命の違いをうけ詳細に解析した結果、膜組み込みにリボソームが関与していることが明らかとなりました。今後は、「リボソームがある場合に疎水性配列を内腔側へ引っ張りこむ力は何か」を明らかにしたいと考えています。
2P-110 村田崇人(東北大・理)

我々は癌抑制遺伝子 p53 に関する研究を行っています。p53 は、膨大な長さの DNA の中から特定の数十塩基配列を探索し結合するという機能を持ちます。この探索機構の詳細を明らかにすることを研究の目的としています。今回の発表では、探索機構の一つである、intersegmental transfer についての研究発表を行いました。intersegmental transfer は、DNA セグメント間を乗り移る機構でありますが、これまで実験的な検証が困難でした。そこで我々は、収縮した DNA 上における p53 の動きを観測するための、新たな実験系を構築しました。その結果、収縮した DNA 上において intersegmental transfer を行ったと考えられる分子の観測に成功しました。今後は、変異体を用いた実験や他の測定方法による実験により intersegmental transfer における p53 各ドメインの動きを解明していくことを考えています。
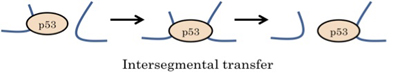
さらなる目標としては、様々な生理的要因が与える DNA 上におけるタンパク質の動きへの影響、複数の分子が存在する条件下におけるタンパク質一分子の動的物性を実験的に解明していくことを考えています。
2P-114 大城理志(東大院・新領域・メディカルゲノム)

この度は、第13回日本蛋白質科学会年会において、このような賞を頂き身に余る光栄でございます。今回の年会の運営に携われた先生方をはじめ、関係者の方々に厚く御礼申し上げます。
今回、発表させていただきましたのは、細菌由来のアルブミン結合ドメインを模倣したヒト型蛋白質の設計に関する研究です。天然に存在する蛋白質をもとに、メディカル分野等で利用しやすい蛋白質を設計したいと考え、この研究を博士課程1年から始めました。
修士課程から同じテーマに取り組んでいる方と比べると、残された時間が非常に少なかったのですが、「研究分野において重要で、研究室のリソースを活用できて、在学中に実現可能なテーマに取り組む」、「最小の労力で理にかなった結果が反映される実験系を組む」、「実験が上手くいかない時は、粘り続けるのではなく、代替案を積極的に取り入れる」ということを常に意識し、指導教員の本田先生と相談しながら研究を進めていきました。このような意識が、短い期間でもアウトプットを生みだすことにつながったのかもしれません。
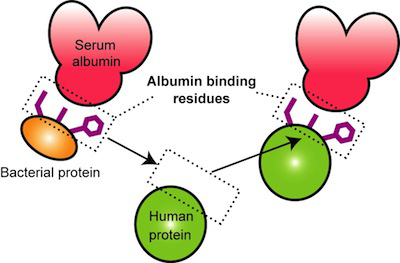
今後は、研究室で身につけた構造インフォマティクスのツールに関する知識・蛋白質の物理化学的な解析手法などを活かし、新たなノウハウ(タンパク質の構造解析など)を習得しながら、メディカル分野・バイオテクノロジー分野で応用される新規の蛋白質の設計を行いたいと考えております。
最後に、研究テーマを考える機会を与えてくださり、研究の全体にわたりご指導を賜りました本田先生、研究室のスタッフの皆様に厚く御礼申し上げます。今後ともご指導ご鞭撻のほど宜しくお願い申し上げます。
2P-121 中原悠介(熊本大学大学院薬学教育部)

このたび第13回日本蛋白質科学会年会においてポスター賞を受賞することができたことを非常に光栄に思います。私はこれまでファージディスプレイ法と呼ばれる分子進化工学的手法を応用した研究を行ってきました。研究が全くうまくいかない時期を経験したことや、悩み抜いて新しい結果を得た時の喜びを味わったことで、ファージと共に自分自身も成長できたように思います。そのような思い入れのある研究の内容についてここで少し触れさせて頂きます。発表させて頂いた研究テーマは「ファージディスプレイ法を用いた GA-pyridine に高親和性な一本鎖抗体の作製とその評価」です。私たちの研究室では GA-pyridine 等の終末糖化産物の免疫化学的な検出法の確立を目指した研究を進めております。今回、GA-pyridine に対する一本鎖抗体(AGE73scFv)に変異を導入し、ファージディスプレイ法を用いたアフィニティセレクションを行うことで GA-pyridine に高親和性で熱安定性の高い変異体(V94AscFv)の作製に成功しました。現在は GA-pyridine の関与が示唆されている動脈硬化症の診断薬への応用を最終目標としつつ、作製した変異体(V94AscFv)の熱安定性の詳細な評価や、さらに機能性の高い一本鎖抗体の作製を試みております。最後に多数の助言やご指導を頂きました森岡弘志教授をはじめとする研究室の先生方、関係者の方々にこの場をお借りして深く御礼申し上げます。
