概要
水はタンパク質の機能を保持するために必要不可欠な溶媒であり、タンパク質の構造や機能との関係性を理解することは重要な課題である。特に、タンパク質表面近傍に存在し、タンパク質と相互作用する水は水和水と呼ばれ、その構造や動的挙動に関する多くの研究がなされてきた。粉末のタンパク質固体を水和することにより、水和水の性質やそのタンパク質に与える影響を直接的に観測することができる。筆者は、テラヘルツ波分光、および中性子散乱を用いてこういった水和タンパク質の動的挙動の本質を明らかにする研究を行ってきた。本稿では、これらの経験で培われた粉末タンパク質の水和方法、および透過型吸収分光や散乱測定などにおいてタンパク質水和試料を用いる際の試料調製法、ならびに測定における試料の設置方法などについて紹介する。
装置・器具・試薬
- 真空乾燥器(ヤマト株式会社、角形真空乾燥器 ADP301 など)
- 密閉できる容器(タッパなど;図1)
- 錠剤成型器と鋳型(日本分光、ミクロ錠剤成形器など;図2)
- グローブバッグ(ドイツabcr GmbH社、Glove Bag SS-30-20Hなど;図4)
- 円筒型セル(図5)
実験手順
- タンパク質乾燥試料の準備
- 試料の粉末化
- 各種測定に合わせたタンパク質粉末試料の水和
実験の詳細
1. 脱水和状態の粉末タンパク質の準備
本稿ではタンパク質水和の方法をできるだけ一般的に記述するつもりであるが、具体的な適応例としてテラヘルツ波分光や中性子散乱を想定している。これらの手法では、例えばテラヘルツ波分光では数十 mg 程度、中性子散乱では数百 mg 程度の試料を必要とする。従って条件検討や再現性の確認を含めると比較的大量のタンパク質粉末を必要とするので、測定を検討しているタンパク質がこの条件を満たすかどうかを確認していただきたい。これまで用いられてきた試料としては、リコンビナント品としては staphylococcal nuclease(Nakagawa and Kataoka, J. Phys. Soc. Jpn. 79(8), 083801_1 (2010))や GFP(Nickels et al., Biophys. J. 105(9), 2182 (2013))など、大腸菌で大量に取得が可能なものが多い。また、膜タンパク質でも、紫膜など比較的得やすいものを用いた例(文献1)もある。もちろん、リゾチームなど市販品として安価で大量に得られるものもあるので、タンパク質にこだわりがなければ市販品を用いても良い。ただ、市販品は純度が低い場合が多いので、一度ゲルろ過やイオン交換による精製を行うほうが良い。また、どのような試料を用いるにせよ、バッファーや塩などタンパク質以外のものが多量に含まれると水和した際にタンパク質以外の成分の水和が起こるので、これらの成分はできれば透析等により取り除くことが望ましい。これらの基本的なタンパク質の調製方法については他の蛋白質アーカイブ含めて様々なところで詳細に解説されているので、ここでは割愛する。
これらの前準備を施したタンパク質水溶液を凍結乾燥することによって粉末状にする。安定なタンパク質であれば凍結せずに水溶液のままでの減圧乾燥でも問題ない場合もある。乾燥はだいたい2,3日で完了するが、念のため乾燥したと思われる時点で一度試料の質量を測定し、さらに乾燥を半日程度続けて質量が変化しないことを確認しておくとよい。筆者は、この状態を脱水和状態(dehydrated state)と定義している。なお、水和量の値としてしばしば \(h\) という値が用いられるが、\(h\) は次のように水和水の質量をタンパク質の質量で割った値で定義される。
\[h = \dfrac{\text{(水和水の質量)}}{\text{(タンパク質の質量)}}\]ただし、以下で述べるように脱水和状態でもいくらか水和水が含まれていることから、正確な水和量の算出には脱水和状態の水和量を知る必要がある。
2. 脱水和状態の水分量の評価
脱水和状態においてもタンパク質表面に強固に結合している水分子が存在しており、水和量を正確に評価するには脱水和状態における水和量を精密に評価する必要がある。文献によってこの評価方法はまちまちであるが、筆者は、真空乾燥器を用いて脱水和状態の試料を95℃で2時間真空引きした状態を水和水が全くない状態、つまり \(h = 0\) の状態と定義し、静置前後の質量差から脱水和状態の \(h\) 値を算出している。つまり、式で書くと以下のようになる。
\[h \text{(脱水和状態)} = \dfrac{\text{(高温真空引き}\small{\textbf{前}}\text{の粉末質量)} - \text{(高温真空引き}\small{\textbf{後}}\text{の粉末質量)}}{\text{(高温真空引き}\small{\textbf{後}}\text{の粉末質量)}}\]なお、真空引き後常圧に戻す際は、乾燥空気や乾燥窒素など水分を含まない気体を用い、また試料を取り出すために扉を開く際は、できるだけ素早く試料をエッペンチューブなどに隔離する必要がある。筆者は、20 mg程度のペレット状試料を真空引きする前からあらかじめエッペンチューブに入れておき、扉を開いた後に素早くエッペンチューブの蓋を閉めることで、外気による望まれない水和を極力回避するようにしている。
なお、水が完全に存在しない状態であることを確認するのは容易ではなく、上で取り上げた真空乾燥法によって到達される状態で、水和水が “全く存在しない” とは言い切れない。先行研究では、試料を塩化カルシウム存在下で密閉することにより脱水させた状態を \(h = 0\) の状態と定義している場合もある。ただいずれの方法に基づいて水和量を定義したとしても、脱水和状態を基準とした水和量は変わらないはずなので、異なる方法で定義された実験結果を比較する際は、どういった方法で \(h = 0\) の状態を定義しているかに留意しておくことが肝要である。
3. 凍結乾燥試料の粉末化
凍結乾燥した試料は綿菓子のようにフワフワした状態であるので、通常はすり鉢などを用いてすりつぶし、細かい粉末状にして取り扱いやすくする。すりつぶす過程は水和を避けるためにできるだけ湿度の低い環境で行うことが望ましい。筆者の経験では、気温25℃で湿度40%の環境だとこの作業中で顕著な質量の増加は起こらないが、用いるタンパク質に依存するので、予備検討を行うほうが良い。なお、すりつぶす際に静電気が生じ、すりつぶした粉末が舞い上がりやすいので、可能であればイオナイザーによって静電気を除去しながら操作すると良い。すりつぶした粉末は、そのまま用いるか、あるいはペレット状に成型することで測定に用いるが、測定に用いる前に念のためもう一度12時間程度常温で真空引きすることにより、作業中に加わった水分を取り除いたほうが良い。
4. 水和方法
このようにして準備した脱水和状態の粉末を水和するが、水和方法は至って簡単で、基本的には密閉空間に超純水を置くことで飽和水蒸気圧にし、そこに粉末試料を静置するだけである(図1)。水和量は時間経過とともに増加するので、適当な時間で水和を停止し、質量増加を確認して目的の水和量に達成していれば完了である。ただ、この方法ではどの程度水和すると水和量がどの程度増加するか完全に経験則なので、時間と水和量増加の関係をある程度調べておく必要がある。なお、例えばリゾチームの場合、脱水和状態は \(h \sim 0.11\) で、超純水で12時間程度水和させると、\(h\) は0.35程度になり、これはリゾチーム表面をおよそ一層分、水が覆ったと仮定した場合の値に相当する。ここからさらに12時間程度水和させると \(h\) は0.45程度、さらに12時間水和させると0.55程度まで上昇する。また紫膜の場合は、脱水和状態は \(h \sim 0.05\) で、12時間程度水和すると \(h\) は0.2程度になり、これは紫膜表面をおよそ二層分水が覆ったと仮定したときに値に相当する。さらに12時間程度水和すると \(h\) は0.3程度になり、これはおよそ三層分に相当する。
また、これに代わる方法として、純水ではなく塩溶液を用いることもできる。例えば KCl の飽和溶液は純水の飽和蒸気圧の90%程度の飽和蒸気圧を持つので、純水よりも水和速度が遅くなり、また最終的にある \(h\) の値以上は水和が進まなくなることがある。従って、水和する時間を気にする必要がないというメリットがある。ただ、タンパク質によっては純水の飽和蒸気圧でのみ顕著に水和が進むものも存在するので、ぞれぞれのタンパク質でどの方法が一番適しているかは試してみないとわからない部分もある。
さて、単に粉末を水和するにはこれで良いが、測定法に合わせて試料の状態を前もって整えた状態で水和したほうが後々都合がよい。本稿では、(ⅰ)透過型測定法(特にテラヘルツ波分光)、および(ⅱ)散乱型測定法(特に中性子散乱)に分類して説明する。
(ⅰ)透過型測定法の場合
透過型測定の場合は吸光係数を求める必要があるため、ペレット状にして表面を滑らかにし、かつ試料の厚さを均一にする必要がある。例えば日本分光などで市販されている錠剤成型器を用いることによって、直径が既知の鋳型中にペレットを作製するとよい(図2;https://www.jasco.co.jp/jpn/product/FTIR/accessories.html)。水和する場合はこのペレットを取り出して水和するか、あるいは測定によっては鋳型ごとセッティングする必要がある場合は、鋳型に入れたまま水和する。なお、鋳型は通常金属製であるが、水和中に錆びてくることがあるので、対腐食処理をしたほうがよい。なお、例えば日本分光の場合、表面をテフロンコートした鋳型を販売しているので、こういったものを用いるとよい。
さてペレット試料の厚さを調べる方法であるが、ペレット内部の多重反射補正を利用する。例えばテラヘルツ波分光法(\(1 \ \text{テラヘルツ} \fallingdotseq 33.3 \ \mathrm{cm}^{-1}\))の場合、ペレットに照射された電磁波は一部がペレット内部で2度反射し、反射されずに透過した電磁波と干渉することでいわゆるエタロン効果による干渉パターンが出現するが、実験データからスペクトルを算出する際はこの干渉効果を補正する必要がある。この際、情報としてペレットの正しい厚さが必要である。逆に言うと、ペレットの正しい厚さを用いた時に干渉パターンが消失するので、この性質を利用して厚さを求めることができる(図3)。なお、これが厚さを求める有効な方法であることは、デジタルノギスであらかじめ厚さを調べたペレットを用いて実証済みである。水和試料は柔らかく、デジタルノギスで厚さを求めることが難しいので、特にこの方法が有効である。
また、水和した試料は乾燥を防ぐために密閉できる治具にセットして用いるのが望ましい。特に温度変化測定など測定に時間を要する場合は必須である。実験中に試料が乾燥していないかどうかは実験前後で質量を測定することで確認する。もし質量変化があった場合は、測定前後の平均値を用いるようにしている。なお、著しく質量が変化する場合は密閉できていない可能性があるので治具の使い方を再確認するか、あるいは治具そのものを再度設計し直すべきであるが、これまでの筆者の経験では治具の密閉性が担保されていれば測定前後で有意な質量減少が起こることはない。
なお、ペレットの直径が大きい(1.5 cm以上)と、水和した際にペレット内部と外部の膨張率の違いから、ペレットがひび割れする場合がある。この場合は粉末を水和してからペレットを作成するなど別途工夫が必要である。
(ⅱ)散乱型測定法(特に中性子散乱)の場合
中性子散乱では重水で水和することにより、溶媒に由来する散乱因子をほぼなくす手法がしばしば取られる。この場合、脱水和状態の粉末タンパク質の水和水、および易交換性のタンパク質プロトンを重水に置換する必要がある。そのために、精製及び脱塩した脱水和状態のタンパク質を重水に溶解させ、凍結乾燥する作業を3回繰り返す。最初の2回については粉末由来の軽水の混入が生じるので、用いる重水の純度は99%程度で良いが、最後の1回については99.9%以上の、できるだけ高純度な重水を用いるのが望ましい。
このようにして得られた凍結乾燥パウダーをすりつぶして以後の実験に用いるが、粉末試料の調製中や重水による水和中に大気中の軽水による水和が起こらないよう注意する必要がある。この問題を避けるために、筆者はビニール製の簡易型グローブバッグを用いて外気を遮断している(図4)。作業を行う際は、グローブバッグの中に必要な器具を入れて内部を乾燥窒素で3回洗い、それから粉末の調製や水和を行う。ただ、ビニール製グローブバッグの場合、作業するのがビニール越しであるために摩擦によって非常に静電気が起こりやすい環境にあり、すりつぶしている間にタンパク質粉末が舞い上がりやすい状態になっている。そこで、イオナイザーを用いたり、また静電気除去シートを用いることで、できるだけ静電気を除くことが望ましい。
さて、中性子散乱のような散乱系測定の場合は、試料になるべく均一に入射ビームが照射されるのが望ましいが、例えば筆者は図5に示すような円筒形のアルミ試料セルを用いている。材質としてアルミを用いるのは、主に中性子の散乱断面積が小さく、軽量で安定しているからである。セルに試料を充填する際は、セルの内側に散乱が過剰に起こらない程度の粉末をできるだけまんべんなく広げる必要があるが、そのために、あらかじめシート状にしたアルミ箔上に脱水和粉末を均等に広げたものを用意している(図5A)。試料はアルミ箔ごと水和用の密閉空間に静置し、水和が完了すれば上からさらにアルミ箔をかぶせてこぼれないように包み込む。この際、シートのふちを大きめに取り、周囲を折るようにすれば粉末がこぼれるのを防ぐことができる。このシートを円筒状セルの内側に張りつけ(図5B)、最後に蓋をして密閉する(図5C)。ただ、多少こぼれたとしても水和量そのものは変化しないので、ここはあまり神経質にならなくて良い。
以上、タンパク質粉末の水和方法、およびそれを用いた測定に際する試料の準備方法を説明させていただいた。実際の実験結果や解釈については、テラヘルツ分光は文献 (1–3)、中性子散乱は文献 (4) 等を参考にしていただきたい。また文章では伝わらない部分、伝えきれない部分もあると思うので、不明な点があれば遠慮なく連絡いただければ幸いである。
なお、タンパク質試料の作製方法や透過型測定に関する内容は、神戸大学分子フォトサイエンス研究センター、富永圭介教授との共同研究において開発され、発展した内容である。また中性子散乱に関する試料調製は、大強度陽子加速器施設(J-PARC)で行われた一連の中性子散乱実験において、一般財団法人総合科学研究機構 中性子科学センター、富永大輝博士、および国立研究開発法人日本原子力研究開発機構 原子力科学研究部門・物質科学研究センター、中川洋博士のご協力により行われた(課題番号;2018A0200、2018B0225)。自治医科大学 医学部 生理学講座 生物物理学部門の柴山修哉教授には様々な器具をお借りした。これらの方々に、この場を借りて感謝申し上げる。
文献
- Yamamoto, N., et al., The Journal of Physical Chemistry B, 122, 1367–1377 (2018).
- Yamamoto, N., et al., Soft Matter, 8, 1997–2006 (2012).
- Yamamoto, N., et al., The Journal of Physical Chemistry B, 120, 4743–4755 (2016).
- Yamamoto, N., et al., The Journal of Physical Chemistry Letters, 12, 2172–2176 (2021).
-

図1:粉末試料を水和している様子
粉末試料を水和している様子。左がタンパク質粉末で、右の容器に超純水が入れられている。水和の際はタッパの蓋を閉め、密閉して行う。 -

図2:錠剤成型器によって作製された、薄い金属円筒内のペレット状の試料
このまま水和することも可能である。 -
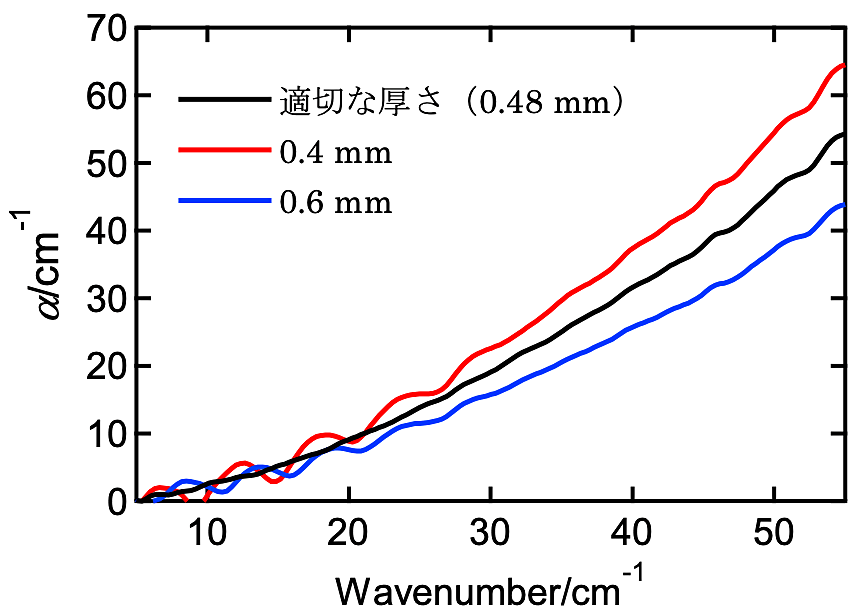
図3:テラヘルツ領域の吸収スペクトルにおける試料の厚さ依存性
スペクトルを算出する際に用いる試料厚さの値が実際の値よりも厚い、あるいは薄い場合は、エタロン効果による干渉縞が出現する。 -

図4:外気と遮断して試料調製する際のグローブバッグ
左上の筒より乾燥窒素などのガスを送り入れる。右の袋出っ張りは開放しており、袋止めクリップなどで閉じることで、閉鎖系にすることができる。 -

図5:中性子散乱測定に用いられる円筒型セルと挿入するサンプルの例
A で示すように適当な広さのアルミホイル上にできるだけまんべんなく粉末試料をまぶし、B のように丸めて円筒形セルに入れる。セルを閉じた様子は C のようになっている。


