本年度第16回年会におけるポスター賞受賞者の方にコラムを寄稿いただきましたので、掲載致します(演題番号順)。
日本蛋白質科学会 役員会
1P-001 菅野 泰功(奈良先端科学技術大学院大学)

この度、第16回日本蛋白質科学会年会においてポスター賞を受賞できたこと大変光栄に思います。これからも「研究を楽しむ」を念頭において頑張っていきたいと思います。
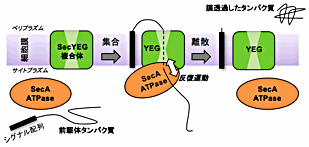
それでは、私の研究に関して簡単に紹介したいと思います。細胞質で合成された蛋白質が膜を越えて輸送される過程(蛋白質膜透過)は、すべての生物に保存されています。細菌では、蛋白質膜透過チャネル「Sec トランスロコン(SecYEG 膜蛋白質複合体)」とモーター蛋白質「SecA ATPase」が、その輸送を担っています。これまでの Sec トランスロコンの結晶構造解析や機能解析から、蛋白質膜透過の様々なモデルが提唱されてきましたが、3 Å 分解能をこえる高分解能の SecYEG 複合体の構造や、膜透過反応の分子動態の詳細は分かっていませんでした。まず、最も高分解能の SecYEG の構造を明らかにし、この高分解能の構造から、トランスロコンの新たな仕組みを示しました。しかしながら、蛋白質膜透過の分子動態の解明は、実際に活きて働く状態の「動」的観察が必須です。そこで、1ユニットで膜蛋白質の再構成が可能である「Nanodisc」と、高い時間分解能と空間分解能を備えた「高速原子間力顕微鏡(高速 AFM)」を用いて、研究を進めています。
最後になりましたが、ご指導して頂いている塚崎智也准教授、田中良樹助教授、研究室の皆様および本研究の関係者のみなさまに御礼申し上げます。
1P-024 大木 規央(横浜市立大学)

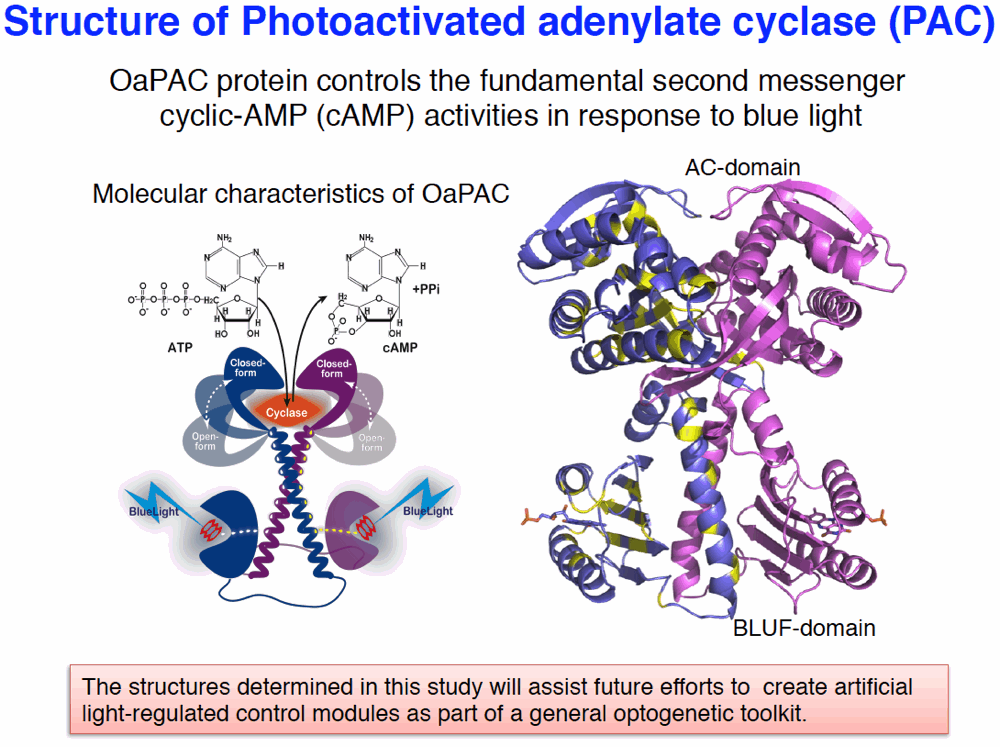
光活性化アデニル酸シクラーゼ(PAC)は、動物・植物で普遍的な情報伝達物質(cAMP)の生産を光で制御できる生体タンパク質で、生体内での光スイッチとして医学的な応用が期待される分子です。我々は、ランソウの1種 Oscillatoria から見いだされた光活性化アデニル酸シクラーゼ(OaPAC)を大腸菌から単離精製・結晶化・構造解析に成功し、世界で初めて光活性化アデニル酸シクラーゼの構造とメカニズム解明に成功しました。OaPAC 全体構造は、N 末端側の光感知領域 BLUF ドメインと C 末端側の酵素触媒領域ACドメインが、分子間の強い疎水性結合により2量体を形成していました。その活性機構は、AC ドメインの Closed から Open による構造変化で調整されていることが明らかとなりました。また、光遺伝学(optogenetics)ツールとして、HEK293 細胞を用いた青色光の OaPAC による cAMP 制御や、マウス海馬の神経細胞への神経軸索コントロールを可能にしました。本研究により、今後更なる光遺伝学の発展へとつながり、新しい再生医療や新薬開発の基礎的研究に貢献できると期待されます。
今回のポスター賞受賞を励みに、今後もより興味深い研究をしていきたいと思います。
1P-057 許 維麟(東京工業大学)

この度、第16回日本蛋白質科学会年会でポスター賞を賜り、大変光栄に思っております。
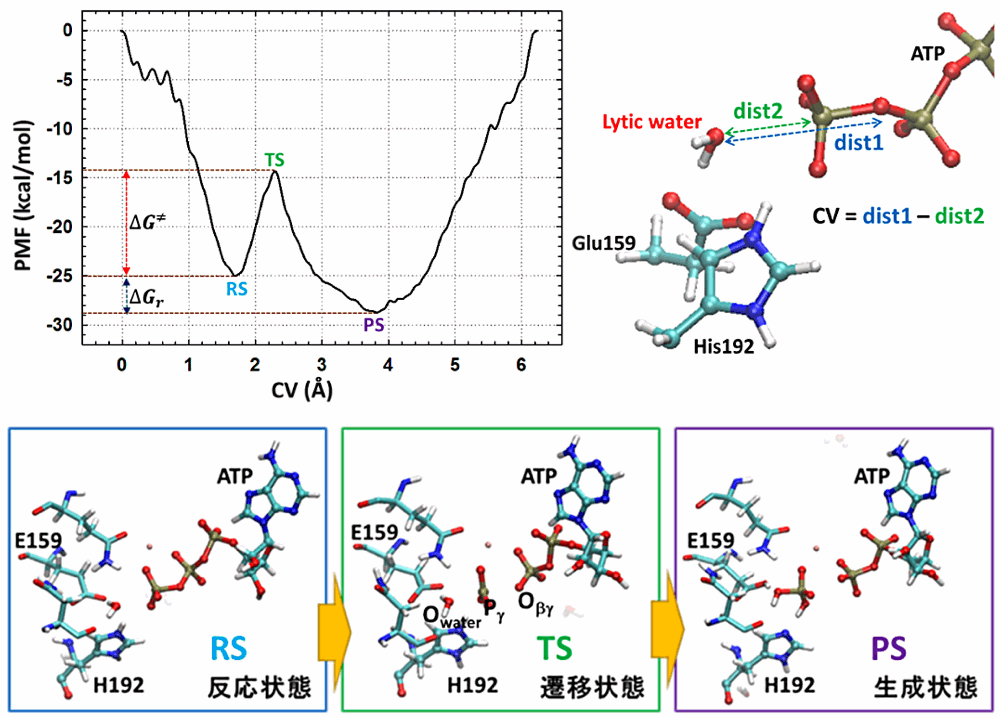
本研究は QM/MM metadynamics の手法で ABC(ATP-binding cassette)トランスポーターの一種、マルトーストランスポーター内の ATP 加水分解を解析しました。適切な QM 領域、collective variable(CV)を用いて、加水分解反応における反応状態、遷移状態、生成状態の妥当な構造が得られました。それらの構造から、Pi の分離は分解水(lytic water)との結合生成よりも先に起こるが明らかになりました。このことから反応は dissociative モデルに近いと判断しました。さらに、見積もられた活性化エネルギーは約 10.5 kcal/mol で、反応エネルギーは凡そ -3.8 kcal/mol でした。また、幾つのプロトントランスファーも観察しており、ABC トランスポーターの Walker A motif に高度保存されているリシン残基の機能を予測しました。
私はこの研究で初めて酵素内の反応を量子力学の手法で直接に動的な観察をすることに成功しました。今後もこの経験を生かして、様々なタンパク質の構造や機能を予測する研究に取り組みたいと考えており、それはとても素敵なことだと思います。今回のポスター賞受賞を励みに、これからもタンパク質の魅力をもっと探査していきたいと思っております。
最後になりましたが、指導教員である櫻井実先生、古田忠臣先生、研究室のメンバーに厚く御礼申し上げます。
1P-100 山際 来佳(兵庫県立大学)

この度は、ポスターを頂くことができ、大変光栄に思っております。
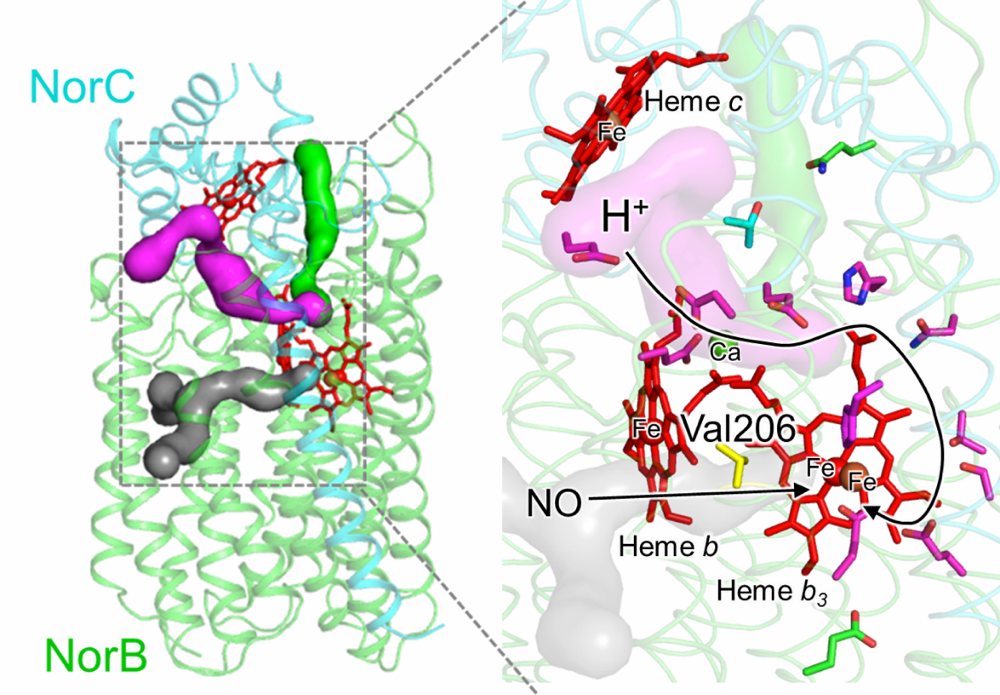
私は、緑膿菌由来の一酸化窒素還元酵素cNORの機能解析を行っております。cNOR は、微生物が硝酸塩を用いた嫌気呼吸を行う過程で、一酸化窒素 NO を亜酸化窒素 N2O へと還元する酵素です(2NO + 2H+ + 2e- → N2O + H2O)。cNOR の結晶構造が解かれてからすでに5年が経過しておりますが、発現系がなく NO 還元反応の詳細な機構は明らかにできていませんでした。本研究では緑膿菌をホストとした cNOR の発現系を構築し、発現系を用いた in vivo および in vitro の変異体解析により、基質 NO と H+ の輸送経路を明らかにしました。さらに NO 輸送経路に存在する Val206 残基の役割が、NO の輸送経路の形成と NO 還元反応の効率化であることを提案しました。今後は生化学的解析に加えて、X 線結晶構造解析を行い、NO 還元反応機構を解明していく予定です。
今回の賞を励みにこれからも日々、研究に打ち込んでいきたいと思います。
1P-101 高島 夏希(九州大学)

この度の第16回日本蛋白質科学会年会におきましてポスター賞という栄誉を賜り、大変嬉しく思っております。評価を頂いた先生方並びに運営関係者の方に厚く御礼申し上げます。
私はアーキアの DNA 複製を担うと考えられているファミリー D DNAポリメラーゼ(PolD)について研究を進めています。PolD はアーキアのみから見つかる DNA ポリメラーゼで、他のポリメラーゼとの配列に相同性がないこと、複合体全体の立体構造が報告されていないことから、その機能と構造について未だ明らかになっていない部分が多くあります。
本研究では、Thermococcus kodakarensis 由来の PolD の2つのサブユニットである DP1、DP2 を単独および共発現系での産生系を構築し、高純度精製したタンパク質について生化学的な解析を行いました。また、静的光散乱法、電子顕微鏡での単粒子解析は、PolD 複合体がヘテロ二量体(DP1:DP2 = 1:1)で存在することを支持していました。DP1 および DP2 単独ではポリメラーゼ活性も3′–5′エキソヌクレアーゼ活性も検出されませんでしたが、両者が複合体を形成すると初めて顕著な活性が検出されました。この結果は、PolD が複合体を形成して初めて活性型になるということであり、言いかえると、活性型になるためには DP1 は DP2 の、DP2 は DP1 の構造を互いに必要とすることを示しています。私は今後、PolD が活性を発揮するために必要な構造を突き止めたいと考えています。
2P-009 張 志寛(東京大学)

この度は、第15回日本蛋白質科学会でポスター賞を頂くことができ大変光栄に思っております。皆様に心より感謝致します。それでは、私の研究内容に関して簡単に紹介させて頂きます。
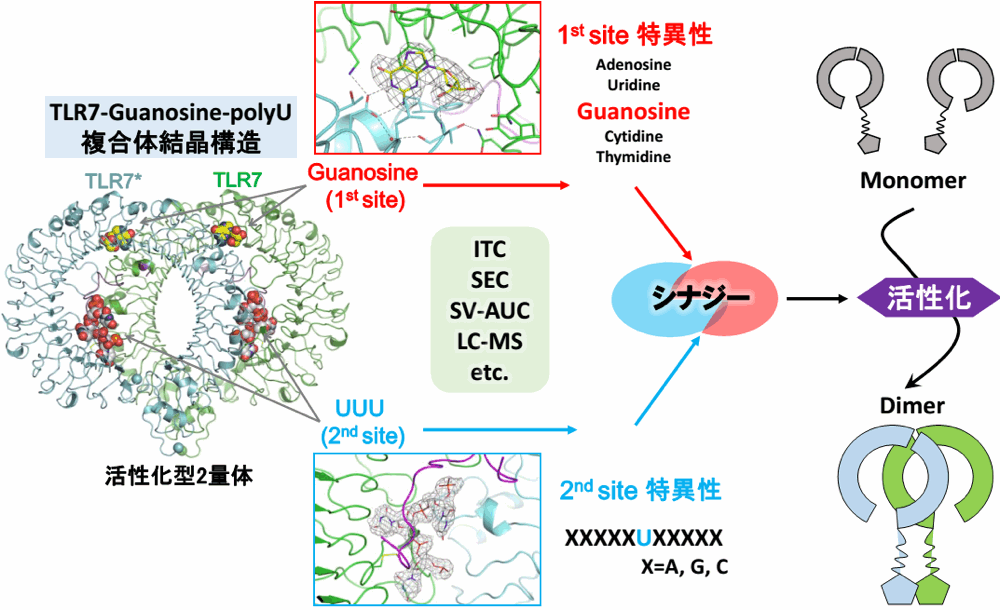
TLR7 は一本鎖 RNA を認識し、自然免疫を活性化する受容体で、HIV-1、HCV 感染症や自己免疫性疾患に関与しています。今回私が世界で初めて、TLR7 の結晶構造解析に成功しました。TLR7-guanosine-polyU、TLR7-loxoribine-polyU および TLR7-R848 の複合体構造を解きました。驚くべきことに、TLR7 は単なる RNA receptor ではなく、2つのリガンド結合部位を持つ dual receptor であることを発見しました。立体構造および様々な生化学実験によって、1st site では Guanosine を、2nd site では uridine 塩基を含む ssRNA を特異的に認識することを明らかにしました。さらに、両者へのリガンド結合のシナジー効果により TLR7 が活性化されることを示しました。本研究は、2ヶ所の結合部位をターゲットに TLR7 の機能を調節する、新たな創薬視点を提供するものです。
2P-012 宮内 弘剛(東京大学)

このたびはポスター賞をいただくことができ、大変光栄に思っております。この場をお借りして、審査員の先生方をはじめとする学会関係者の皆様に心から御礼申し上げます。
私はトランスポーターの X 線結晶構造解析について研究しております。私は生物のもつ異物排出現象に興味をもち、その膜を隔てた異物の輸送メカニズムについて原子レベルでの解明を目指しております。
今回の発表が私にとって初めての学会発表の場でしたが、ポスターまで足を運んでくださった方々と意見交換させていただき、大変有意義な時間をすごすことができました。今後もこの賞を励みにして異物排出のメカニズムの解明を目指したいと思います。
2P-016 糟谷 豪(東京大学)

今回、ポスター賞という形で私の研究を評価していただきまして大変光栄です。また、学会を運営してくださった方々に深く感謝いたします。
私が研究している P2X 受容体は、細胞外 ATP の結合により活性化される陽イオンチャネルで、神経伝達や痛覚など様々な生体反応に関与しています。P2X 受容体のチャネル活性化の際には、二価陽イオンが活性調節因子として働き7つある P2X サブタイプの特異性に寄与することが知られてきました。しかしながら、P2X 受容体における二価陽イオン認識機構や活性調節機構についての構造基盤は不明でした。
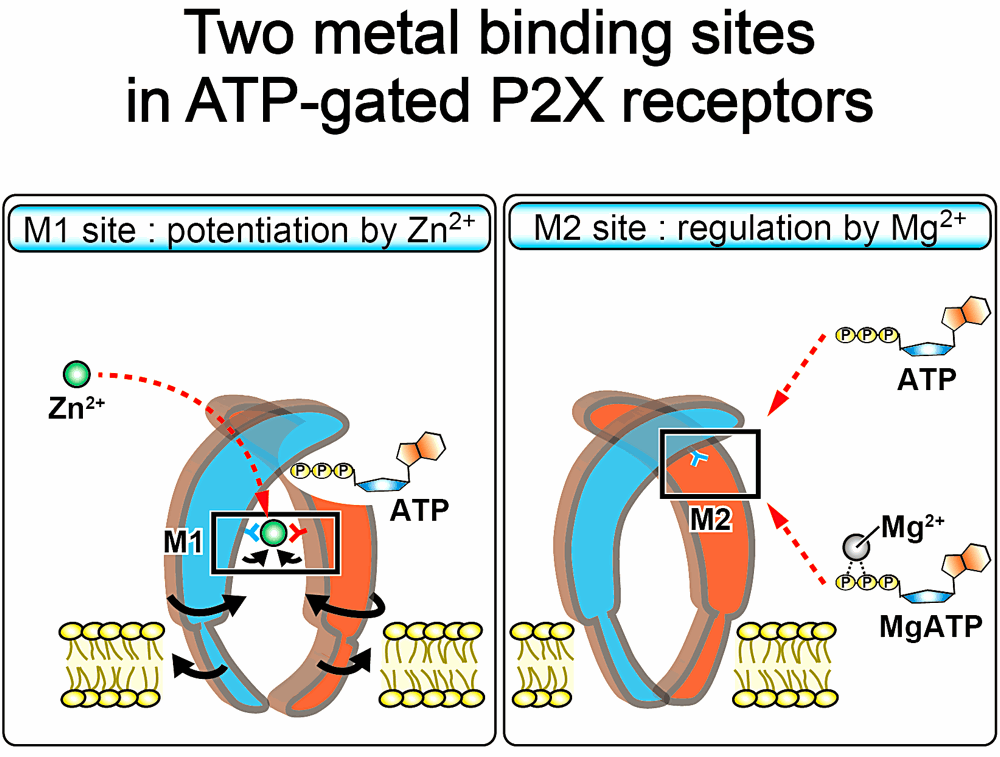
今回、私は無脊椎動物 A. maculatum 由来 P2X 受容体の構造を ATP および亜鉛イオン(Zn2+)結合した状態で決定しました。得られた構造では、三量体の境界面および ATP 結合部位の近傍の合計二箇所に Zn2+ が確認され、これを M1 および M2 サイトとそれぞれ名付けました。更に、電気生理学解析および分子動力学解析から、M1 サイトは Zn2+ の結合による細胞外ドメインの開状態への構造変化の促進に関わっていること、M2 サイトは ATP4- と MgATP2- のサブタイプ特異的な識別に関わっていることを明らかにしました(Kasuya, et al., Cell Rep., 14, 932–944 (2016))。
今後も、「面白い」と思えるような研究を報告できるよう頑張っていく所存です。
2P-101 三輪 つくみ(東京工業大学)

タンパク質がフォールディングに失敗すると凝集体を形成してしまい、本来の機能が発揮できなくなります。凝集体の形成はタンパク質を扱う上で障害となっており、凝集性タンパク質を可溶性に変換する方法論の確立が望まれています。
当研究室の先行研究によってタンパク質の凝集性は、大腸菌のシャペロニン GroEL に細胞内フォールディングを依存する「GroE 依存性」と高い相関があること、また、GroE 依存性を決定づける要因がアミノ酸配列中に存在していることが示されています。
そこで、本研究では凝集性タンパク質のGroE依存性を変換することで可溶性への変換に繋げること、その方法が一般的に適用可能であるかどうかを検証することを目指しています。
本研究の手法が一般的に適用できれば凝集性タンパク質を取り扱った研究が活発となることが期待できます。さらに、GroE は大腸菌の生存に必須な唯一のシャペロンであることから、GroE 基質を非依存性化する配列が明らかになれば、シャペロンが生育に不要な大腸菌の作製し、生物にとってのシャペロンの意義について迫ることもできるかもしれません。このように壮大な可能性を秘めた本研究について、その面白さをポスターでお伝えできたということはとても励みになりました。今後も壮大な夢に近づくこと、そしてみなさんに「こんな面白いことをやったぞ」とお伝えすることを目標にして頑張っていきます。
2P-106 安齋 樹(慶応義塾大学)

私の研究対象である銅・亜鉛スーパーオキシドディスムターゼ(SOD1)は活性酸素の除去に関わるタンパク質ですが、変異型の SOD1 は神経変性疾患の一種である筋萎縮性側索硬化症(ALS)を引き起こすことが知られています。アミノ酸変異によって SOD1 に構造異常(ミスフォールディング)が生じ、細胞毒性を発揮することが提案されていますが、疾患の発症に関わるミスフォールド型 SOD1 の構造的特徴については、未だ明らかでない点が多く残されています。
そこで私は、SOD1 の熱変性に伴う構造変化を種々の分光学的手法や X 線小角散乱法により追跡し、野生型、及び、変異型 SOD1 の溶液構造についての詳細な検討を行いました。その結果、生理的温度(37℃)における変異型 SOD1 は、野生型と同じく球状でコンパクトな形状を維持しているにもかかわらず、二次構造の含量が大きく低下した異常なコンフォメーションを有していることを明らかにできました。
本研究で得られたミスフォールド型 SOD1 の構造的特徴は、ALS 発症メカニズムについての分子レベルでの解明に重要な知見を提供するだけでなく、タンパク質の構造異常を標的とした予防・治療薬開発にも貢献できると私は考えています。今回頂いたポスター賞を励みにして、タンパク質の構造変化が引き起こす疾患の発症メカニズムについて、蛋白質科学的な側面から、引き続き研究に取り組んでいきたいと思います。
2P-118 李 石(鳥取大学)

この度、第16回日本蛋白質科学会でポスター賞を賜り、大変光栄に思っております。私はパーキンソン病原因蛋白質αシヌクレインのアミロイド線維形成抑制機構について研究を行っております。αシヌクレインという蛋白質は様々なストレスによりアミロイド線維を形成し、それが神経細胞内に凝集・蓄積し、細胞の変性・脱落を引き起こし、パーキンソン病の発病に繋がると考えられています。そのため、αシヌクレインのアミロイド線維形成抑制を引き起こし、なおかつ血液脳関門を通過できる低分子の探索はパーキンソン病の治療・予防法の開発および疾患の解明に繋がると考えられています。
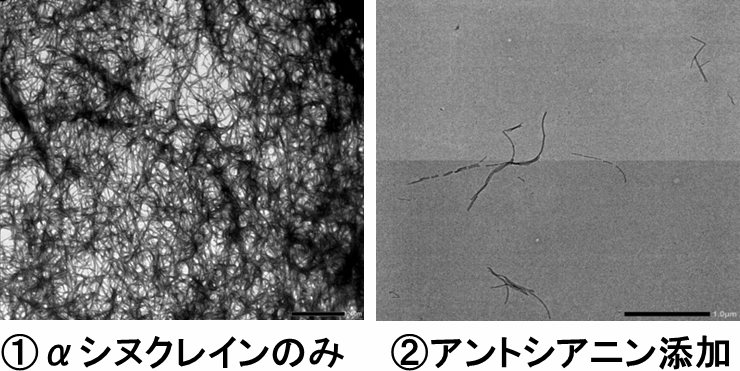
本研究ではポリフェノールの一種であるアントシアニンを用いてαシヌクレインの線維形成に対する抑制効果を調べました。アントシアニンの濃度に依存してαシヌクレインのアミロイド線維形成が抑制されることが分かりました。その反応機構を詳細に調べたところ、アントシアニンがαシヌクレイン内の N 末端領域と相互作用をすることにより、アミロイド線維形成が抑制されることが明らかとなりました。これらの結果からαシヌクレインのN末端領域がアミロイド線維形成において非常に重要な役割を果たしていることが明らかとなり、アントシアニンがパーキンソン病の予防に役に立つことが示唆されました。
今回の発表で、様々な方に「なるほど」、「面白い」と言われたことが大変印象深く、あらためてこれまで分からなかったことを探求しつづける研究の楽しさを実感しました。今回の経験を糧にして、今後も様々な研究に積極的に挑戦していきたいと考えています。
2P-137 笹本 峻弘(東京薬科大学)

この度、第16回蛋白質科学会年会のポスター賞に選ばれたこと、大変光栄に感じております。審査員の先生方をはじめとする学会関係者の皆様方、日々指導してくださっている先生方にこの場を借りて御礼申し上げます。それでは、私の研究内容を簡単にですが紹介します。
私たちは、タンパク質を通して「生命の進化」に迫る研究に取り組んでいます。特に、38億年以上前の初期生命の進化が私の研究対象です。初期進化の時代、生命は20種類より少ないアミノ酸種からなるタンパク質を合成していたと考えられています。しかし、それがどのアミノ酸種だったのかは明らかになっていません。
私たちは、タンパク質のアミノ酸組成を系統的に減らした変異体を作製、解析し、安定で活性を持つタンパク質の合成に必須な最少のアミノ酸種を探索することで、初期生命が用いていたアミノ酸種を推定しようと考えました。ターゲットタンパク質としてヌクレオシド二リン酸キナーゼを用いました。その結果、ある程度の安定性と検出可能な触媒活性を持ち、かつ、少ないアミノ酸種からなるキナーゼを作製することができました。今後はどこまでアミノ酸種類数を減らすことができるか検討したいと考えています。
最後に、本研究に興味を持っていただいた全ての方々に御礼申し上げます。