本年度第15回年会におけるポスター賞受賞者の方から原稿をいただきましたのでここにお知らせします(演題番号順)。
日本蛋白質科学会 理事会
1P-003 李 勇燦(東大・理・生物)

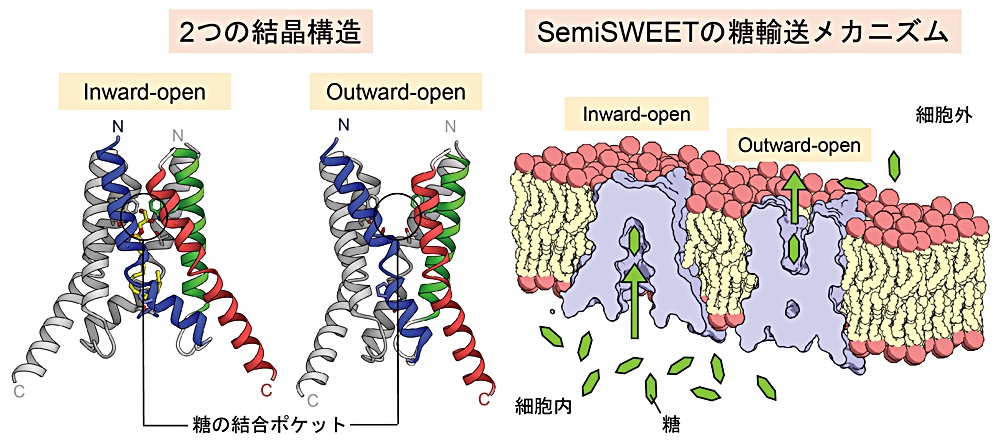
糖輸送体は細胞膜を介した糖の出し入れを媒介し、細胞の栄養獲得に重要な役割を果たします。2010年、既知の糖輸送体とは配列相同性を持たない新しいファミリーの糖輸送体が発見され、SWEET と名付けられました。これまでの研究によって、SWEET は糖の排出に関与することが明らかになっていますが、その構造は未知であるため SWEET による糖の輸送メカニズムはよく分かっていませんでした。
そこで私は、SWEET の原核生物ホモログである SemiSWEET に着目し、その X 線結晶構造解析を行いました。その結果、SemiSWEET の構造を inward-open 状態と outward-open 状態の2つの状態で決定することに成功しました。構造を見ると、SemiSWEET は膜内で二量体を形成しており、その中心に糖の結合ポケットを作り出していました。この結合ポケットは、inward-open 状態では細胞内側に開いている一方、outward-open 状態では細胞外側に開いていました。このことから、SemiSWEET は構造変化によって糖の結合ポケットを開閉し、これによって糖を輸送することが明らかになりました。
このたびの受賞を励みとして、今後も面白い研究を続けていきたいと思います。
1P-007 津久井 秀(京大院・農・森林)

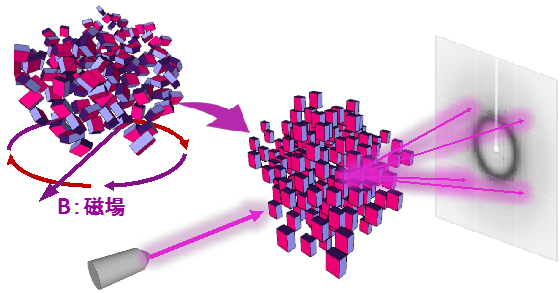
今回、ポスター賞に選んで頂き誠にありがとうございます。僕は修士過程を出た後に一度証券会社で株式デリバティブの商品組成を行う仕事をしていたので、既に30歳手前であり、おそらくポスター賞受賞者の中では一番年上なのではないかなと思います。証券会社で働いていましたが、現在はタンパク質結晶構造解析の手法開発を行っています。多数の微結晶を集め、微結晶一つ一つを磁場で三次元的に向きを揃えることで、擬似的な巨大結晶を作製して散乱体積を増加させることで回折強度を上げる、という研究です。現在はそのようなサンプルの X 線による放射線損傷を研究するためオックスフォード大学の Prof. Garman の研究室で短期間ですが放射線損傷の研究を行っています。
きちんと結晶構造解析の世界を見始めたのは仕事を辞めて、博士課程の学生として戻ってきてからなので2年半ぐらいになります。僕の所属している研究室はタンパク質の結晶構造解析を行っている研究室ではないので、学生として戻ってきてから、研究室外の様々な先生達の助けやアドバイスを求めて話を聞きに行きました。とても感謝しております。
微結晶(かつ単斜晶、直方晶、三斜晶系の結晶)しかできず、本手法を試したいサンプルをお持ちの方は気軽に tsukui.shu.52w@st.kyoto-u.ac.jp までお願いします。
1P-075 大山 克明(立命館大・生命科学)

この度、第15回 日本蛋白質科学会でポスター賞を賜り、大変光栄に思っております。私はシアノバクテリアの生物時計の研究をおこなっております。シアノバクテリアは生物時計を持つ最も単純な生物であり、その生物時計は3つの時計タンパク質 KaiA、KaiB、KaiC によって構成されています。KaiA は KaiC の自己リン酸化活性を促進し、KaiB は KaiA の反応を阻害するように働きます。また、KaiC は六量体を形成し、KaiA と KaiB の結合によって自身のリン酸化状態を変動します。これら3つの Kai タンパク質からなる生物時計は in vitro で再構成可能なことが知られています。本研究では、Kai タンパク質の再構成系を用いて、KaiC に着目し Blue Native PAGE により解析しました。これにより、KaiC 六量体に二つの状態変化があることを示し、さらに、KaiC が一方の状態の時 KaiB が結合することを明らかにしました。
今後もこの賞を励みにして、Kai タンパク質が時間を測るメカニズム解明を目指したいと思います。最後になりましたが、指導教員である寺内一姫 先生、浅井智広 先生、研究室のメンバーにこの場を借りて御礼申し上げます。
1P-088 工藤 翔太(東大院・工)
この度は、ポスター賞を頂くことができ大変光栄に思っております。皆様に心より感謝致します。それでは、私の研究内容に関して簡単に紹介させて頂きます。
私は細胞接着を担う蛋白質の「カドヘリン」に関して研究を行っております。特に、癌の悪性化に関与していることが示唆されている P-カドヘリンを研究対象にしております。P-カドヘリンがどのように細胞同士を結びつけているのかを理解することで、カドヘリン分子一般の細胞接着メカニズムの理解や P-カドヘリンを標的とした薬剤設計の応用等へ繋げたいと考えております。
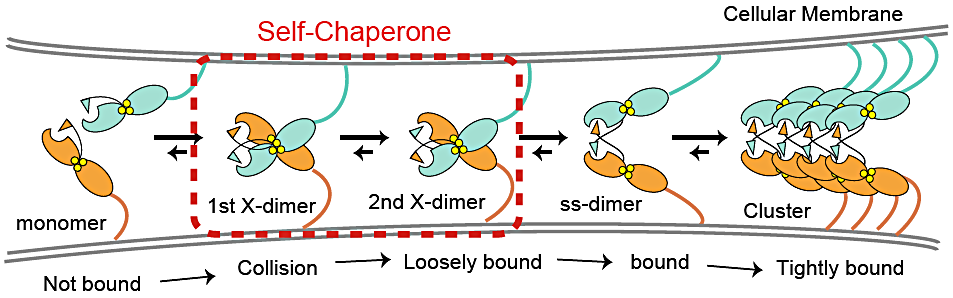
カドヘリンは一般的に細胞間でホモダイマーを形成することで細胞同士を結びつけていることが知られています。私は、P-カドヘリンの接着メカニズム解明を目指し、X 線結晶構造解析、ホモダイマー形成の速度論的、熱力学的解析、細胞を用いた接着機能解析を行いました。その結果、P-カドヘリンは strand-swap dimer(ss-dimer)と X-dimer の異なる2種のホモダイマーを形成可能であることが分かりました。さらに、X-dimer が速度論的に有利な中間体として終状態である ss-dimer の形成を促進する働きがあることを見出しました。以上のことから、X-dimer が自身の高次構造形成を促進する「自己シャペロン」として機能し、迅速な細胞接着に貢献しているという新規なメカニズムの構築いたしました。
今後は、本研究で明らかになった接着メカニズムに基づき、P-カドヘリンを標的とした薬剤設計を行っていく予定です。
1P-101 佐藤 大輔(創大・工・生命情報)

蛋白質科学会にてポスター賞を頂くことができ、大変光栄です。私は、池口教授、藤原准教授の指導の元、研究を行っています。蛋白質が自発的にアセンブリする現象に魅せられ、この世界に足を踏み入れました。蛋白質超分子のアセンブリ過程を追跡する実験は古くから行われていますが、時間分解能、空間分解能が低い実験手法を用いていたため、そのメカニズムは明らかになっていません。
そこで私達は、蛋白質超分子のアセンブリ・メカニズムを明らかにするために、SPring-8 における高速検出器 PILATUS を用いた時間分解 X 線小角散乱法(TR-SAXS)を採用しました。SPring-8 の高輝度 X 線と PILATUS を用いたことで、今までは困難であった非常に速い反応を追跡することが可能になりました。実験対象としては、24量体フェリチンを用いました。酸性条件下で2量体に解離したフェリチンを中性条件に戻すことで、アセンブリ反応を開始させ、SAXS を測定することで追跡しました。その結果、フェリチンは様々な中間体を経由して最終構造を形成し、その時の中間体濃度は非常に低いということが示唆されました。また、アセンブリ速度において、フェリチンの正味電荷間の反発が重要であることが分かりました。この受賞を励みにして、今後もさらなる実験、解析を行っていきます。
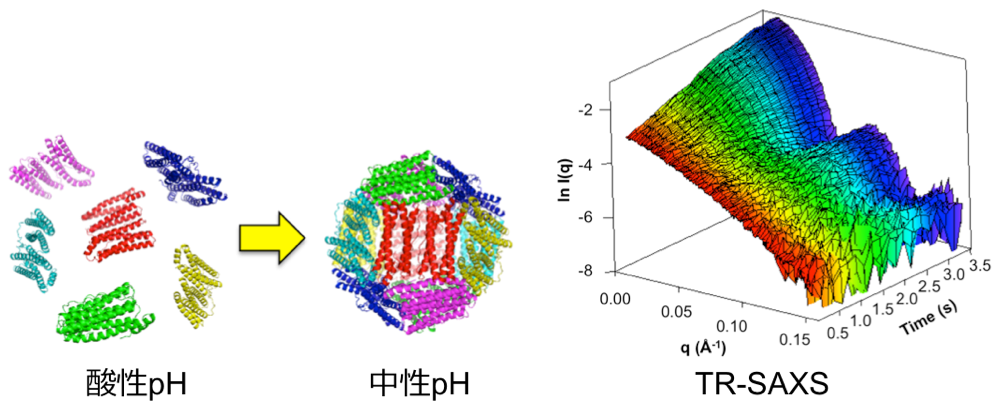
2P-019 谷口 怜哉(東大・理・生科)

この度は、ポスター賞という形で私の研究内容を評価して頂き、大変ありがたく思っております。
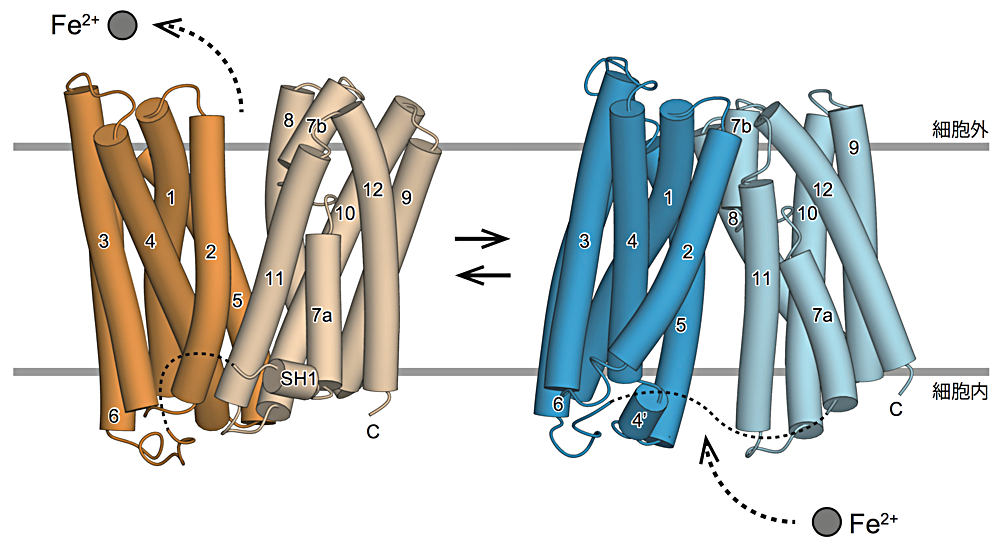
私が研究してきた鉄排出輸送体 Ferroportin(FPN)は、ヒトを含む脊椎動物において、細胞からの鉄排出を担う唯一の膜輸送体です。生理的な重要性の一方で、FPN の立体構造は不明であり、FPN による基質輸送機構も未解明のままでした。そこで我々は、細菌が持つ FPN ホモログに着目し、その結晶構造を、外向き開状態と内向き開状態という、異なる二状態で決定しました。得られた構造から、FPN が二状態の行き来によって鉄を輸送していることが示されました。これまで FPN は iron efflux channel と表記されることもありましたが、我々の構造より、FPN が鉄の「輸送体」であることが明確になりました。また、ヘプシジンと呼ばれるペプチドホルモンが FPN に結合し、その機能を抑制することが知られていたものの、分子基盤の理解は不十分でした。そこで今回得られた構造に基づき、ヘプシジン結合部位のアミノ酸残基の位置を推定したところ、それらはすべて輸送体中央の溝内部に位置していました。これより、溝内部へのヘプシジンの結合が FPN の構造変化を直接阻害することで、FPN の鉄排出活性が抑制されている可能性が示唆されました。この仮説の実験的な検証までは到達できていないものの、今後の FPN研究にとって有益な示唆を提示できたと考えています。
今回の発表では、多くの方々に研究内容を「面白い」と思って頂けたことが最大の喜びでした。今後もタンパク質の構造解析を通して、新しいこと、面白いことを見つけ出せるよう、日々精進していく所存です。
2P-043 阪野 美紗(東工大・バイオセンター)

LEA(Late Embryogenesis Abundant)タンパク質の中でも Group3 に属するもの(G3LEA)は、ネムリユスリカ幼虫などの耐乾燥生物を乾燥誘導すると体内に大量に発現されます。そのとき同時に産生されるトレハロースと協調して、乾燥状態の生体成分を保護していると考えられています。同タンパク質はアミノ酸11残基から成るモチーフ配列を繰返し持ち、これが機能部位であると推測されています。
当研究室では、このモチーフ配列を2回繰り返したモデルペプチド(PvLEA-22)を考案し、天然の G3LEA と同様の構造的・熱力学的性質を持つこと、タンパク質や細胞膜の凝集を抑制する機能があることを様々な物理化学実験に基づいて明らかにしてきました。この機能は、PvLEA-22 が乾燥時にタンパク質や細胞膜の表面をシールディングすることにより、それらの直接接触に起因する凝集・融合を防ぐためではないかと考えられていますが、詳細は不明です。
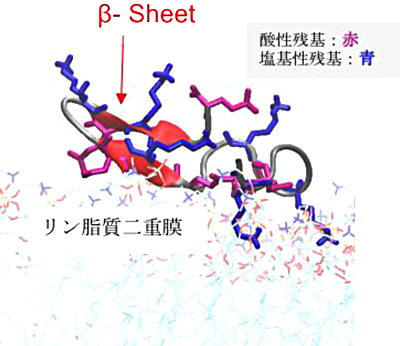
そこで本研究では、PvLEA-22 と細胞膜から成る系に着目して、作用メカニズムに関する上の仮説を検証することを目的としました。具体的には、MD simulation や umbrella sampling を行うことで、PvLEA-22 の膜結合過程における自由エネルギー変化や構造変化を解析しました。その結果、PvLEA-22 の膜付着は自発的に起こるということ、その付着状態は水中遊離状態と比較して十分に安定(18 kcal/mol)であることが分かりました。さらに、PvLEA-22 は水中遊離状態では特定の二次構造を持ちませんが、膜付着時には β-sheet に構造化することが判明しました。
我々はこの PvLEA-22 が実用化されれば、細胞その他の生物資源の常温乾燥保存が可能になるのではないかと期待しています。ポスター賞受賞を励みに、今後も機能解明に尽力してまいりたいと思っております。
2P-096 杉山 在生人(東北大学大学院・工学研究科バイオ工学専攻)

人類は蛋白質のほとんどについて未だ生物の力を借りなければ創り出すことができません。そのため私たちは大腸菌のような宿主生物にお願いして作ってもらうことで、初めて蛋白質をいじることができます。とても高尚なことだと思います。そんな生物の力をうまく利用して、この世にまだない人工の蛋白質を創りだす研究に魅力を感じ、蛋白質工学の梅津研究室に入りました。
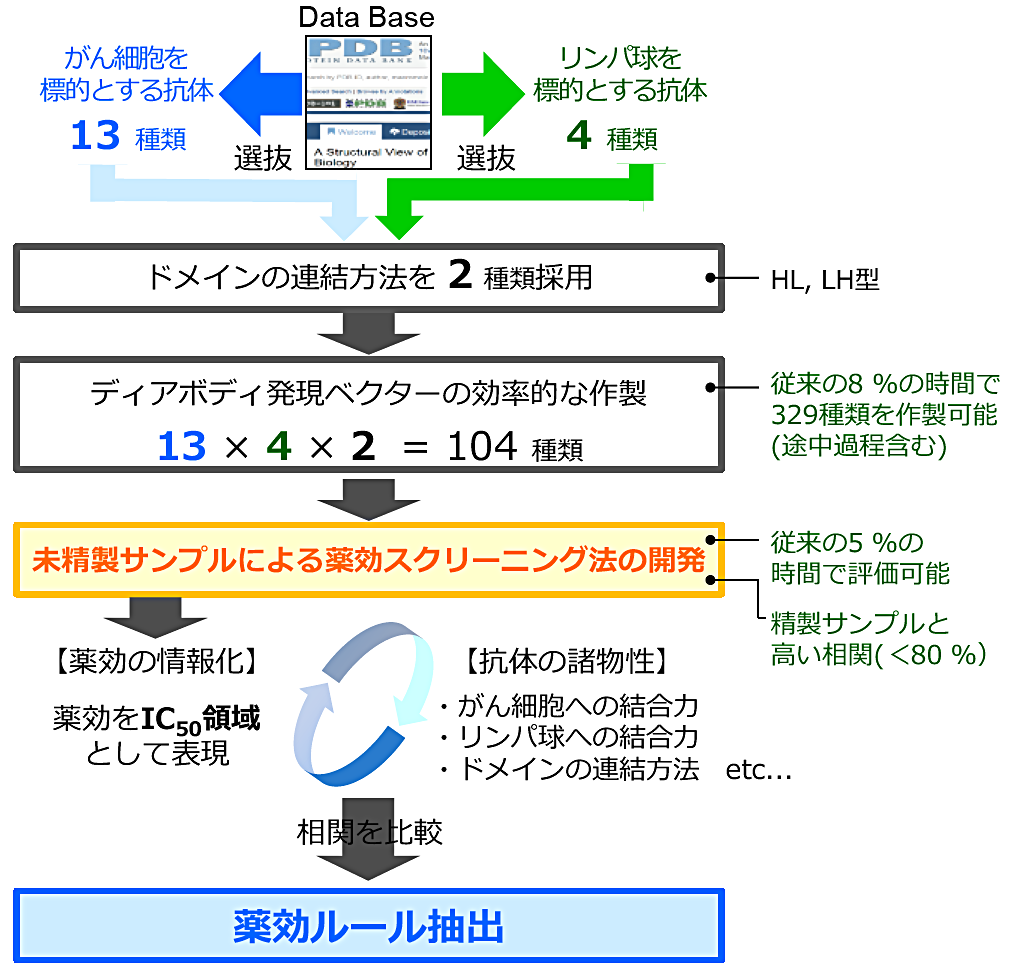
現在、研究しているのはがん細胞とリンパ球を架橋できる「ディアボディ」とよばれる二重特異性抗体です。抗体医薬は副作用の少ない抗がん剤として知られていますが、このディアボディはこの利点に加え、IgG 型が苦手とする腫瘍性のがんにも高い薬効を発揮できる次世代型の抗体医薬として期待されています。しかし、高薬効なディアボディを意図して設計するには至っていません。そこで、本研究では様々な物性をもつディアボディ104種類を網羅的に構築し、薬効と諸物性の相関を比較することで、薬効ルールの抽出を行いました。100 種を越えるディアボディを扱うにあたり、遺伝子設計を出発点として発現ベクターの効率的作製、多種類の蛋白質調製法、薬効の網羅的評価までの一貫したプロセス構築を行いました。結果、LH 型と呼ばれる構造フォーマットが適していること、リンパ球よりもがん細胞に強く結合できた方が高薬効になりやすい等、複数の薬効ルールを抽出することができました。
蛋白質科学会のような大きな学会で賞をいただくことができとてもうれしいです。学会を運営してくださった方々に深く感謝いたします。
2P-110 高橋 愛実(北海道大学大学院 生命科学院(旧薬学研究院))

この度は、第15回蛋白質科学会年会にてポスター賞を賜り、身に余る光栄に存じます。この場をお借りして、審査員の先生方をはじめとする学会関係者のみなさまに心から御礼申し上げます。
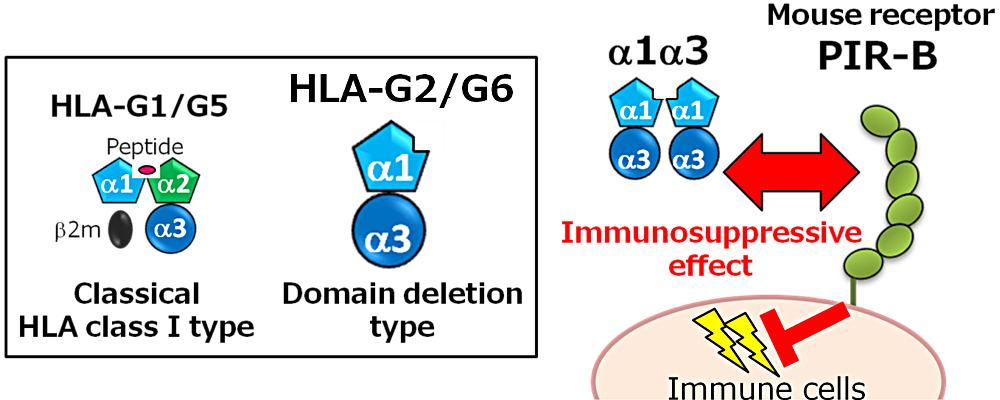
私は、免疫抑制・寛容誘導分子として妊娠やがん、臓器移植などに関与する HLA-G の7つのスプライシングアイソフォームの中でも、特に、機能未知であったドメイン欠損タイプの HLA-G2(膜結合型)及び G6(分泌型)アイソフォームに着目して研究を行ってきました。今回私は、HLA-G2/G6 に共通のアミノ酸配列から成るリコンビナント蛋白質(α1α3 蛋白質)の SPR 解析を用いた受容体との相互作用解析、ヒト関節リウマチモデルマウスを用いた機能解析を行い、α1α3 蛋白質の免疫抑制効果を示すことに成功しました。現在は、α1α3 蛋白質が自己免疫疾患等の治療薬に応用されることを期待し、引き続き実験を続けています。主に、蛋白質の立体構造解析や分子間相互作用解析を得意とする研究室で in vivo 実験を行うことは困難も多くありましたが、蛋白質を扱う研究室だからこそ、やや扱いの難しい α1α3 蛋白質を用いて in vivo での結果を出すことができたのではないかと思っています。
今回のポスター賞の受賞は、私にとって大きな励みになりました。将来、世界に通用する研究者となり新薬開発等で社会に貢献できるよう、博士課程ではより研究に邁進したいと思っております。
最後になりましたが、いつも温かく見守り、的確なご助言・ご指導をくださる前仲勝実先生、黒木喜美子先生、研究室の方々、本研究の関係者のみなさまに厚く御礼申し上げます。
2P-114 雨宮 舜(熊本大学大学院薬学教育部)

この度、第15回日本蛋白質科学会年会においてポスター賞を受賞することができたことを大変名誉に思います。また、これからの研究への大きな励みとなりました。
現在、抗癌剤として用いられているチロシンキナーゼ阻害剤は、ATP 結合ポケットをターゲットとしており、その近傍に変異が入ることによる薬剤耐性変異が問題となっています。本研究では、従来標的としている ATP 結合ポケットではなく、キナーゼドメインの相互作用面を標的とした新たな阻害剤の開発を目指しています。
まず、ファージディスプレイ法を用いた2段階スクリーニングを行い、2種のペプチドを獲得しました。得られたペプチドを用いて、HSQC 2次元 NMR 測定やキナーゼのリン酸化実験をペプチド添加と非添加で評価したところ、相互作用面近傍にペプチドが結合し、FGFR1 の自己リン酸化を特異的に抑制することが分かりました。本研究は、キナーゼドメインの相互作用阻害が新たな創薬標的として有望であることを示唆しています。将来的にはこれらのペプチドを用いた競合実験により、ATP 結合ポケット以外をターゲットとした低分子化合物のスクリーニングが可能になると期待しています。
最後になりましたが、日々多数の助言や指導をしてくださっている研究室の先生方をはじめ、年会に携われた関係者の皆様にこの場を借りて厚く御礼申し上げます。
