概要
タンパク質結晶の X 線回折データを収集する際、十数年前までは、タンパク質結晶をガラスキャピラリー内に封じ室温で X 線回折データを収集していた。しかし、放射光 X 線の高輝度化によって結晶の冷却は必須であり、現在では 100 K の窒素ガス気流下での X 線回折実験が主流である。しかし、SPring-8 BL41XU などのアンジュレータービームラインでは、100 K で実験を行っても X 線損傷によって結晶交換が必要になることも多い。最近では、液体ヘリウムを利用して結晶を冷却する方法が開発されており (1)、一般的ではないが必要であればより低温でのデータ収集も可能になってきている。
このプロトコルは、一般的な 100 K の窒素ガス気流下でのタンパク質結晶のクライオ条件の検討について解説する。クライオ条件の検討法は研究者が色々工夫している点が多い。それら全てを紹介することはできないため、当研究室で日常的に行っているプロトコルについて紹介したい。
放射光実験にむけた実験室系での予備的な回折実験について述べるが、放射光でのクライオ条件の検討も同様な手法で行える。
装置
X 線発生装置、検出器、吹きつけ低温装置が無い場合は、放射光ビームラインを使用する。実体顕微鏡(結晶観察用)50倍程度の倍率があると良い
器具
米国ハンプトンリサーチ社(http://www.hamptonresearch.com/)のクライオ器具が主流であるが、研究者が独自に開発している場合もある。一般にはハンプトンリサーチ社の製品を購入すればよいと思う。ハンプトン社のカタログや WEB サイトをみると、同じようでもちょっと違う製品が沢山あるので、初めて購入する際には注意が必要である。
- ループ、キャップ、ワンド、トング、クランプ(図1および2)
- 断熱性マグカップ(ディスカウントショップで販売されているもので十分)
- デュワー瓶
- 結晶保存タンク
- ドライシッパー(結晶運搬用)
- クライオケーン
- スライドガラス
- 冷気を遮断するためのカード(テレホンカードの様な物、名刺やアルミ箔でもよい。図4を参照)
- ピペットマン、チップ
試薬
グリセロール、エチレングリコール、アルコール類などの抗凍結剤(ハンプトンリサーチ社から抗凍結剤のセットが販売されているので、それを利用しても良い。)
液体窒素
実験手順
- 抗凍結剤の選択
- 結晶の抗凍結処理
- 結晶の冷却
- 回折像の確認
- 結晶の回収
実験の詳細
1. 抗凍結剤(クライオプロテクタント)の選択
まず結晶化に用いた溶液をループですくい、100 K の窒素ガス中で透明に凍るか白く凍るかを確認する。もし結晶化溶液が透明に凍るのであれば、結晶を抗凍結処理することなしにそのまま窒素ガス中で冷却できる。白く凍る場合は水の結晶が生成しているので、抗凍結処理の必要がある。
もっとも広く用いられているクライオプロテクタントはグリセロールかエチレングリコールであり、ほとんどの場合、グリセロールかエチレングリコールでうまくいく。当研究室では溶液の粘性の低いエチレングリコールを好んで使用している。まず、20–30%のエチレングリコールを含む結晶化溶液を調製し、ループですくい窒素ガスで冷却し、透明に凍ることを確認する。白く凍るようであれば、エチレングリコールの濃度を上げるか、他のクライオプロテクタントを試す。沈殿剤に PEG、MPD、塩を使用している場合は沈殿剤濃度を上げると沈殿剤がクライオプロテクタントとなる場合がある(注1)。
2. 結晶の抗凍結処理
クライオプロテクタントを加えた結晶化溶液が透明に凍ることを確認できたら、結晶をその溶液に浸し、抗凍結処理を行う。この溶液をこのプロトコルではプロテクタント溶液と呼ぶことにする。
スライドガラスに1–2マイクロリットルのプロテクタント溶液のドロップを作る。顕微鏡下、結晶化ドロップからループを使って結晶をすくい(図3)、プロテクタン溶液のドロップに移す(ソーキング)。このとき結晶が割れる、あるいは結晶が溶けるようであればプロテクタント溶液の組成やソーキング条件を検討する必要があるかもしれない(注2)。結晶をソーキング後、数秒待って結晶の状態に変化がないようであれば、結晶の凍結へ進む。
3. 結晶の凍結
結晶の凍結はいろいろな方法があるが(注3)、ここでは 100 K の窒素ガスを使った凍結法を紹介する。
抗凍結処理した結晶をループですくい、吹きつけ低温装置のノズルをカードでふさぎ冷気を遮断する。ループをマウント後、すぐさまカードをノズルから離し、結晶を凍結する(図4)。ここで結晶あるいはループ全体が白くなってしまう場合は、抗凍結処理の時間を長めにする、あるいはクライオプロテクタントの濃度を上げる、クライオプロテクタントを変更するなどの検討が必要になる。
凍結時、多少白くなってもデータ収集には大きな問題にならない場合もあるので、最終的には振動写真を1–2枚撮影し、回折像から凍結の良否を判断するのがよい。
4. 回折像の確認
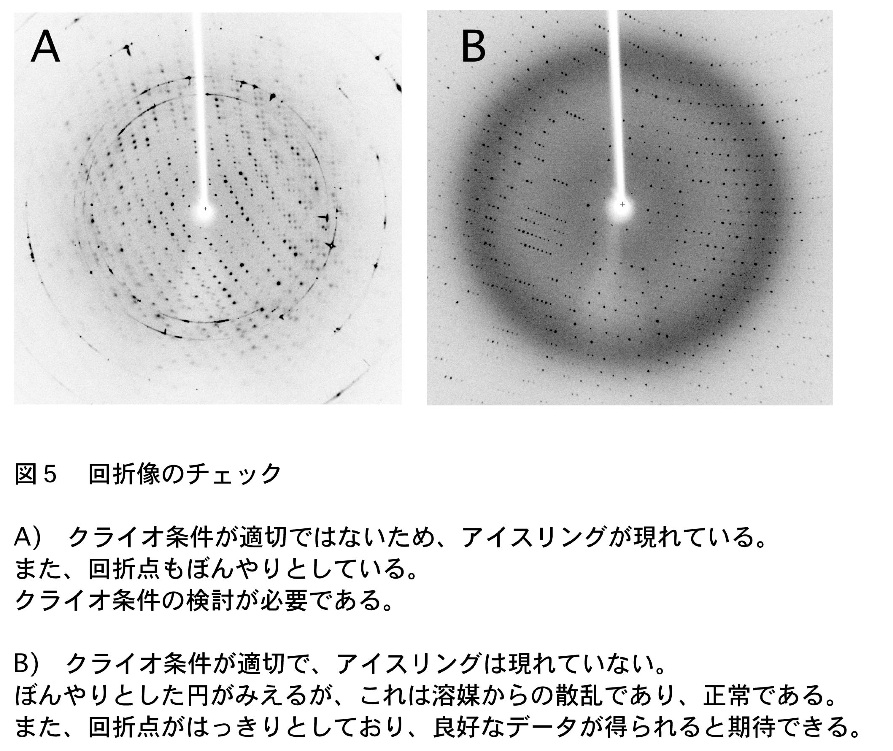
X 線回折像を1枚撮影し、抗凍結処理がうまくできているかを確認する。可能であれば、結晶を90°回転させた方向でも撮影し、指数付けを行う。
アイスリングと呼ばれる同心円状の回折が現れていなければ抗凍結処理はうまくいっているが、回折点がはっきりしない場合はプロテクタント溶液の組成やソーキング方法を検討する必要があるかも知れない(注4)。例えばクライオプロテクタントの濃度が足りないか、ソーキング時間が足りない場合はアイスリングが現れる(図5)。
回折像を撮影し、問題がないようであればそのままデータ収集を行うか、放射光実験にむけて結晶を回収する。
もし、低エネルギー X 線を利用したデータ収集を行うのであれば、特別なループを使用することが必要になる(注5)。
5. 結晶の回収
液体窒素をいれた断熱マグカップでトングを十分冷却する。結晶をトングで挟み、すぐに液体窒素の入ったマグカップに戻す。
液体窒素をいれた発泡スチロールのケースにキャップを挟んだクランプ、ワンドを入れ、十分に冷却する。結晶を挟んだトングも入れる。ワンドを使ってトングから結晶を外し、キャップにねじ込む(ねじ式キャップの場合)。磁石式キャップの場合は、ワンドの上部をノックすることでループがキャップに収まる。キャップ内に液体窒素が入っていることを確認し、クライオケーンにセットし、保存容器に移す。結晶を放射光に運搬する場合はドライシッパーを使用する(図6)。
工夫とコツ
(注1)
グリセロールやエチレングリコールの他に、結晶化の沈殿剤として用いられている MPD や PEG、高濃度の塩、スクロースやトレハロースなどの糖もクライオプロテクタントとして用いられる。一方、鉱物油もクライオプロテクタントとして利用されている。結晶を鉱物油で覆うことで、結晶表面での氷生成をおさえることができる。鉱物油やヒアルロン酸を用いた汎用クライオプロテクタントも考案されている(2)。
(注2)
プロテクタント溶液へのソーキングによって結晶が壊れてしまう場合、ソーキング時間を短くすることで改善されることがある。もし結晶が割れてしまっても結晶の破片が十分きれいであればそれを使ってデータ収集が可能である。
結晶が激しく壊れてしまう場合は、クライオプロテクタントの濃度を段階的に上げていく方法を用いる場合もある。また、直接プロテクタント溶液にソーキングせずにボタン透析によってゆっくりとプロテクタント溶液に置き換えていく方法もある。どの方法がよいかは結晶に依存するので、うまくいかない場合は色々試みることが必要である。ソーキング時間だけでなく抗凍結処理の温度も重要な因子になる場合もある。20℃で得られた結晶でも抗凍結処理は4℃の方が良いこともある (3)。うまくいかない場合は様々なクライオプロテクタントを試すべきであることは言うまでもない。ハンプトンリサーチ社のクライオプロテクタントのキット CryoPro™ の条件を一通り試してみるのがよいだろう。
(注3)
結晶の凍結は 100 K の窒素ガスを用いることが多い。X 線装置には吹きつけ低温装置が取り付けてあることが多いからである。しかし、直接液体窒素中で凍結させることもある。つまり、ワンドを取り付けたループで結晶をすくい、それを液体窒素中に入れ、結晶を凍結する。この場合、急激に気化した窒素ガスによる大量の泡が結晶にダメージを与える。液体窒素は冷却効率が悪いため、冷却速度を上げるために液体エタンや液体プロパンを使うと良いが、安全面や操作性を考えるとあまり一般的ではない。
(注4)
結晶がガラス状に凍結されているが(アイスリングが現れていない)、回折しない、あるいはきれいな回折斑点が得られないことは日常的に直面する問題である。このような場合、結晶がそもそも悪いか、クライオ条件が悪いか、どちらかである。実験室系での実験であれば室温での回折像を撮影することで結晶自体の良否を判断することができる。この場合、結晶と結晶化溶液をガラスキャピラリーに内包するか、ループで結晶をすくい乾燥しないように工夫してX線実験を行う。米国 MiTeGen 社(http://www.mitegen.com/)は室温実験可能なループを販売しており、国内ではファルマアクセス社から購入可能である(http://www.pharmaxess.com/products/MicroRT/index.html)。
結晶自体に問題がある場合でも、クライオ条件の検討によって改善される場合もあり、どうすればよいのかは一概には言えない。一度、結晶を窒素ガスで凍結後、気流を遮り融解させ、再度窒素ガスで凍結させると良好な回折像が得られる場合がある。この方法はアニーリングと呼ばれている。アニーリングは全ての結晶に適用できるわけではないが、良好な回折像が得られない場合は結晶を破棄する前に一度試してみても良いと思う。アニーリングは上述のように気流を遮る方法と、一度結晶をプロテクタント溶液に戻して再度ループですくい窒素ガスで凍結させる方法がある。どちらの方法が良いかは結晶次第である。 結晶自体に問題がある場合、また、結晶を沈殿剤濃度の濃い溶液に浸すことで結晶性が良くなる場合もある(デハイドレーション)。溶媒含量の多い結晶では有効かも知れない。アニーリングやデハイドレーションなどは Post-Crystallization treatment と呼ばれている (4)。また、結晶を凍結する前に結晶周りの湿度をコントロールすることで分解能が向上することもある(http://www.rigaku.com/protein/fms.html)。
筆者は残念ながらクライオ条件の検討やデハイドレーションなどで結晶性が劇的に改善されたケースは今のところ無い。結晶性に問題がある場合は結晶化条件の再検討を行った方が良いだろう。
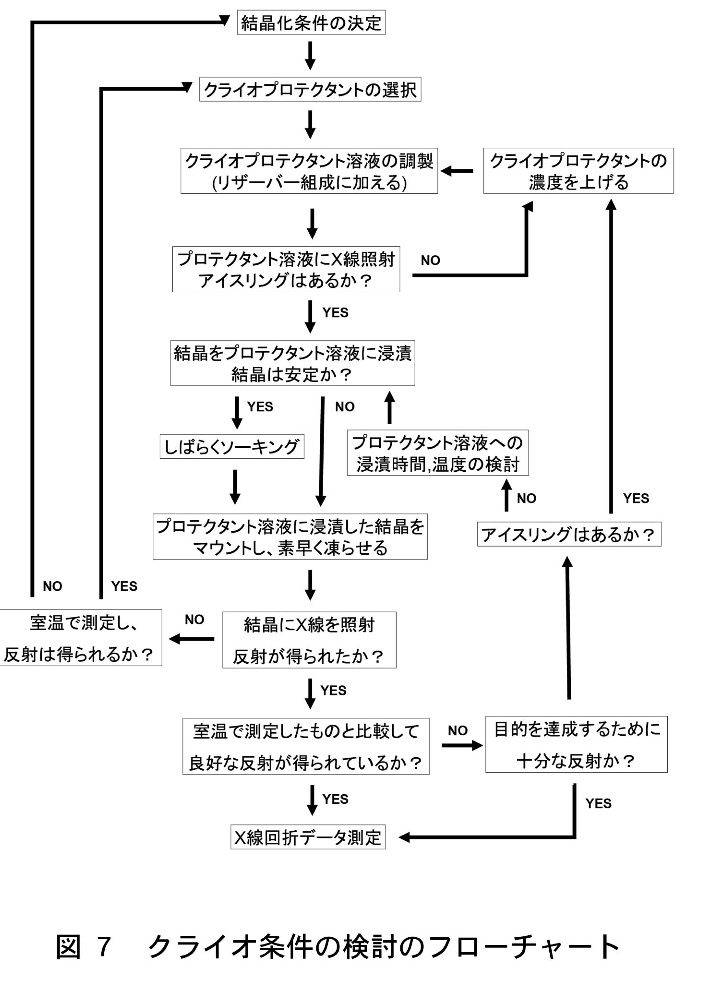
一般的なクライオ条件の検討のフローチャートを図7に示す。
(注5)
低エネルギー X 線(長波長 X 線)はループや溶媒への吸収の効果が無視できない。1.8 Åよりも長い波長を用いるのであれば、一般的なナイロンループではなく吸収の少ない材質で結晶をマウントし、かつ余分な溶媒はなるべく取り除いた方がよい。溶媒を取り除いたマウント法が考案されている (5)。また、吸収の少ない素材を使った製品は MiTeGen 社(http://www.mitegen.com/)の MiroMount™、MicroMesh™ やプロテインウエーブ社(http://www.pro-wave.co.jp/)の LithoLoops などがある。
長波長 X 線を利用し、硫黄原子などの異常分散効果を利用した構造解析を行うのであればこのような結晶マウント法が必要である。
文献
- Nakasako, M., Sawano, M., Kawamoto, M., Rev. Sci. Instrum., 73, 1318–1320 (2002)
- Sugahara, M. & Kunishima, N., Acta Cryst. D62, 520–526 (2006)
- 千田ら、結晶学会年会 (2007)
- Heras, B. & Martin, J. L., Acta Cryst. D61, 1173–1180 (2005)
- Kigato, Y., Watanabe, N., Tanaka, I., Acta Cryst. D61, 1013–1021 (2005)
クライオ実験全般についての文献
- タンパク質の結晶化、京都大学学術出版会 (2005)
- Macromolecular Crystallography Protocols: vol. 2, Humana Press (2007)
- 蛋白質結晶構造解析入門、日本結晶学会 (1997)
(その他)
当プロトコル作成に際し、当研究室の学生である吉澤拓也氏、柳生昌克氏、菱木麻美氏の協力を得た。