概要
ストップト・フロー(stopped-flow)法は、概ねミリ秒程度を上限とする速い反応の速度論を観測することができる手法のひとつである。二種類(以上)の溶液を混合することにより、pH などの溶液条件を短時間で変化させ、反応を開始し、その後の反応過程を観測する。ストップト・フロー法を用いて反応過程を観測する際には、装置の不感時間や混合能率などの性能を評価することが本質的に重要である。本稿では、不感時間等の評価の仕方を例に、ストップト・フロー法を用いた速度論(kinetics)の測定法の概要を紹介し、さらにモデル蛋白質アポミオグロビン(apoMb)のアンフォールディング反応を例として、蛋白質を用いた測定法を紹介する。
装置・器具・試薬
- ストップト・フロー装置(SX.17 型[2023年11月現在: 販売終了 SX.20 型が後継機]、Applied Photophysics)
- 高圧窒素ガス(2 – 8気圧)
- 恒温槽(RTE-110[2023年11月現在: 販売終了: 同等の冷却水循環装置で代替可能]、Thermo Fisher Scientific)
- N-アセチル-L-トリプトファンアミド(N-acetly-L-tryptophanamide; NATA)
- N-ブロモコハク酸イミド(N-bromosuccinimide; NBS)
- 30 µM apoMb / 10 mM クエン酸ナトリウム(pH 5.7)
- 10 mM クエン酸ナトリウム / 5.4 M 尿素(pH 5.7)
ストップト・フロー法を用いた速度論の測定
蛋白質のフォールディング反応や酵素触媒反応などの機構を理解するには、反応の速度論を測定することが非常に有用である。これらの反応は、非常に速い過程を含むことがあり、反応開始後ミリ秒程度の時間領域での観測が必要になることも多い。速い過程を含めて反応速度論を測定するためには、まず迅速に反応を開始することが重要であり、様々な反応開始法が知られている。例えば、蛋白質のフォールディング / アンフォールディング反応を開始するための手法としては、溶液の温度や圧力を急激に変化させる温度ジャンプ法、圧力ジャンプ法や、蛋白質溶液と緩衝液等とを混合する溶液混合法などがある。溶液混合法を用いることにより、溶質の濃度やpH等を迅速に変化させることができる。溶液混合法の、蛋白質のフォールディング研究の応用には、変性剤変性蛋白質溶液を緩衝液と混合し、変性剤濃度を変化させる変性剤濃度ジャンプ法や、酸/アルカリ変性蛋白質溶液を異なる pH の緩衝液と混合し、pH を変化させる pH ジャンプ法等がある。この様に溶液混合法は適用範囲が広く、速度論研究に大きな貢献をしている。溶液混合法の中でもストップト・フロー法は、ミリ秒程度の時間領域の反応を観測することが可能であり、しかも微量の試料溶液でも速度論を測定することができる手法である。この手法は、1940年に Chance 等によって開発されて以来、速度論測定に広く用いられ続けている (1–3)。本稿では、1. ストップト・フロー法を用いるに当たって必要な装置の、動作確認と性能評価(混合能率と不感時間)を行うための方法、2. 応用として実際の蛋白質(apoMb)のアンフォールディング反応を測定するための方法、これら二点を述べる。1. では、装置の動作確認と性能評価の方法を通じて、装置の使い方の実際を説明し、2. では、その蛋白質への応用を述べる。
ストップト・フロー法について詳述した書籍には、参考文献4, 5等がある。参考文献4(第5章:162–213ページ)は、手法の原理、装置の詳細はもちろんのこと、実際に研究に用いる上での装置の性能評価、よく直面する問題やその解決法について多角的かつ詳細に述べてある。参考文献5にも詳細な記述が見られる。本稿は、ストップト・フロー装置使用のための first step guide を目指した。
ストップト・フロー装置
ストップト・フロー装置について述べる(図1)。ストップト・フロー装置は、実際に試料溶液が流れる流路系と反応を観測する観測系とに分けることができる。まず、流路系について述べる。ストップト・フロー装置は、文字通り溶液を流し、その流れを止めて反応を観測するためのものである。流れを作り、流れを止めるための方法にはいくつかある。本稿では、気体(通常は窒素)の圧力を用いてシリンジを押すことによって流れを作り、最下流のストップシリンジによって流れを止める型について述べる。二つの試料溶液用リザーバが、それぞれドライブシリンジ1、2とバルブを通して接続している。ドライブシリンジ1、2は、溶液混合器と流路(チューブ)で接続されている。ストップト・フロー装置の溶液混合器にはさまざまな型が存在する。本稿で紹介する Applied Photophysics 社製ストップト・フロー装置 SX.17 では、T 字型の溶液混合器を使用している。塩酸グアニジン等の粘度が大きく混ざりにくい溶液を、より効率的に混合するため、溶液を四方からぶつけて混合する4ジェット方式や、多段階の混合器等の複雑な溶液混合器も存在する。溶液混合器の下流には、観測フローセルがある。観測フローセルは、ストップバルブを挟んで、ストップシリンジと流路(チューブ)で接続されている。観測系は、試料溶液の吸収や蛍光、円二色性などの分光学的性質をプローブにすることが多い。図1は、蛍光ストップト・フロー装置を示している。光源(キセノンランプ等)からの白色光を分光器で分光し、励起光として観測フローセルに導く。蛍光は、光学フィルタを通して光電子増倍管で検出する。
測定に際しては、以下のように動作する。それぞれの溶液がドライブシリンジ1、2に満たされているとする。観測フローセル内に残った溶液を置換するのに充分な体積(「工夫とコツ」参照)の溶液がストップシリンジから排出される。次に、ドライブラムが素早くシリンジを押す。それに伴い、二本のドライブシリンジからそれぞれの溶液が約 8 – 10 mL/s の流速で押し出される。この溶液は、溶液混合器で混合される。混合された溶液は観測フローセルへと流れる。ドライブシリンジ1、2から流れてきた溶液によって、ストップシリンジが満たされると、それ以上溶液は流れなくなり、流れが止まる。ストップシリンジのプランジャの先にはトリガーがあり、シリンジが満たされるとトリガーがかかり、新たに混合された溶液で満たされた観測フローセルからの蛍光を実時間で観測する。
反応は、二種類の溶液が溶液混合器内で混合されたときに開始している。溶液混合器から観測フローセルに至るまでの流路には有限の体積があるので、混合によって反応が開始された溶液が、観測フローセルに辿り着いた時点で、既に幾分か反応は進んでしまっている。この様に、装置の構造上、反応開始直後に観測できない時間領域が存在する。さらに、ストップシリンジが停止した後においても、観測フローセル内の溶液の局所的な流れが完全に止まり、シグナルが安定するまでに有限の時間がかかる。観測フローセル内の溶液が安定して初めて反応によるシグナルを観測できる。この様にして生じる観測不能な時間領域を不感時間(deadtime)と呼ぶ。反応の中には、不感時間内に反応のかなりの部分が進んでいる場合もある。例えば、蛋白質のフォールディング反応の場合、不感時間内に中間体の蓄積が起こるものもある。この様な場合、反応曲線をゼロ時刻外挿することにより、中間体の特徴づけを行うことができるが、そのためには反応開始時刻が正確に定義されていることが必須の条件になる。従って、反応速度論を測定する際には、不感時間の評価は極めて重要である。
本稿ではまず、ストップト・フロー法を用いた速度論測定の詳細について、特に不感時間の測定に用いる NBS による NATA の蛍光の消光過程 (6,7) を例にして述べる。不感時間の評価に広く用いられている反応には、このほかに2,2’-ジニトロ-5,5’-ジチオジ安息香酸(5,5’-dithiobis(2-nitrobenzoic acid); DTNB)/ チオグリセロール(440 nm における吸収)、キノリン / マグネシウムイオンによる蛍光強度の変化(可視域の蛍光)(8,9) や2,6-ジクロロフェノールインドフェノール(2,6-dichlorophenol indophenol; DCIP)/ L-アスコルビン酸による還元退色反応 (10) 等がある。次に、蛋白質を用いた反応過程の測定への応用例として、apoMb のアンフォールディング反応の測定について述べる。ここでは、apoMb を例に取るが、他の蛋白質についての測定も同様である。
1. NBS による NATA の蛍光の消光過程を利用したストップト・フロー装置の性能評価
NBS による NATA の蛍光の消光反応
不感時間の評価は、速度論測定の際に特に重要である。不感時間の評価には既知の反応を用いる。この反応は、実際に測定したい反応で用いるプローブに合致したものを選択するべきである。たとえば、トリプトファン蛍光を用いて蛋白質のフォールディング反応を観測したい場合は、トリプトファンのアナログである NATA の蛍光を用いることができる。NATA の蛍光の NBS による消光反応がお勧めである(スキーム1)。
NATA は蛍光を示すが、NBS や反応中間体、生成物は蛍光を示さないため消光が観測される。反応速度の微分方程式は以下で書ける。
\[\frac{\mathrm{d[NATA]}}{\mathrm{d}t} = \frac{\mathrm{d[NBS]}}{\mathrm{d}t} = -k\mathrm{[NATA]} \cdot \mathrm{[NBS]} \tag*{(式1)}\]つまり、時刻ゼロにおける NATA、NBS の濃度をそれぞれ \(\mathrm{[NATA]_{0}}\), \(\mathrm{[NBS]_{0}}\) として、\(\lambda = k (\mathrm{[NBS]_{0}} - \mathrm{[NATA]_{0}})\) とおくと、
\[\mathrm{[NATA]} = \frac{\mathrm{[NATA]_{0}} \cdot (\mathrm{[NBS]_{0}} - \mathrm{[NATA]_{0}}) \cdot \exp(-\lambda t)}{\mathrm{[NBS]_{0}} -\mathrm{[NATA]_{0}} \cdot \exp(-\lambda t)} \tag*{(式2)}\]である。\(\mathrm{[NBS]_{0}} >> \mathrm{[NATA]_{0}}\) とすると、
\[\mathrm{[NATA]} \cong \mathrm{[NATA]_{0}} \cdot \exp(-\lambda t),{\ }\lambda \cong k \mathrm{[NBS]_{0}} \tag*{(式3)}\]となる。観測される蛍光強度 \(F(t)\) は NATA の単位濃度あたりの蛍光強度を \(f\) とすると、
\[F(t) = f \cdot \mathrm{[NATA]} \cong f \cdot \mathrm{[NATA]_{0}} \cdot \exp(-\lambda t) \tag*{(式4)}\]と書ける。したがって、\(F(t)\) を NBS が存在しない場合の蛍光強度 \(f \mathrm{[NATA]_{0}}\) で規格化し、これを \(N(t)\) とおくと、
\[N(t) = \exp(-\lambda t) \tag*{(式5)}\]と書くことができる。\(N(t)\) は反応開始時刻に1になる(\(N(0) = 1\))。
実際の測定では反応開始から不感時間まで(\(0 < t < t_{\mathrm{deadtime}}\))の変化は観測されず、\(t > t_{\mathrm{deadtime}}\) の変化しか観測できない。
観測する反応と反応条件
本稿では、装置として Applied Photophysics 社製ストップト・フロー装置 SX.17 を念頭に置いている。この装置の観測フローセルは 1 mm × 2 mm × 10 mm であり、典型的には 5 – 10 µM NATA 存在下での、いくつかの濃度における NBS による消光過程を観測する。NATA 溶液と NBS 溶液との混合比は、目的とする実験での混合比と同じにしておく。装置の設定は、できるだけ後の測定と合わせる。本稿では混合比 1 : 5 の場合について述べる。それぞれの溶液は、
| 体積 | 溶液 | |
|---|---|---|
| シリンジ1 | 0.5 mL | 30 µM NATA in 50 mM リン酸塩(pH 7.0)または水 |
| シリンジ2 | 2.5 mL | 0.24 – 0.84 mM NBS in 50 mM リン酸塩(pH 7.0)または水 |
これらの溶液を 1 : 5 の混合比で混合するので、観測フローセルでの反応は \(\text{5 µM NATA} + \text{0.2 – 0.7 mM NBS}\) となる。
実験の詳細
1)サンプルの調製
30 µM NATA、0.24 – 0.84 mM NBS を調製する。NBS は使用時に調製し遮光する。ほこりや気泡は散乱等の原因になるため、フィルター(0.45 µm)を用いて濾過し、充分に脱気を行う(20分程度)。試料溶液は測定温度で平衡化しておく。
2)装置の立ち上げ
主電源、ランプ、分光器、試料混合部、計算機、恒温槽を立ち上げる。ランプ点灯後、光源が安定化するまで時間がかかるため、最低でも30分 – 1時間程度暖機を行う。計算機のソフトウェアで分光器とストップト・フロー装置の制御を行う。励起波長は 295 nm、光電子増倍管の電圧は 550 V 程度に設定する。トリガーを external に設定し、pressure held(測定中にドライブシリンジに圧力をかけたままの状態にする)に設定する。恒温水の温度は、恒温槽に表示される値ではなく、ストップト・フロー装置に組み込まれた温度計(計測用ソフトウェアのディスプレイ上に値が表示される)を合わせるようにする。アンプはシグナルの大きさに合わせて調整する。ドライブシリンジ駆動用の高圧窒素の圧力を設定する。SX. シリーズの場合、1 : 1 混合の際には8気圧、それ以外の非対称混合の場合には2気圧である。ドライブシリンジ、ストップシリンジに気泡が生じていないかを充分確認する(特にシリンジの先端付近やプランジャについていることがあるので注意)。シリンジ内に気泡がある状態で測定を行うと、アーティファクトが出る。あからさまに大きな気泡は、ストップシリンジを取り外し、追い出す。非常に小さな(目視できるかどうかくらい)気泡については、30分程度脱気した水を用いて、ショットを打ち続けると、消えることがほとんどである。
3)測定
| ⅰ) | リークの確認 | シリンジ1(緩衝液)、シリンジ2(緩衝液) |
| ⅱ) | バックグラウンドの測定 | シリンジ1(緩衝液)、シリンジ2(緩衝液) |
| ⅲ) | 混合能率の評価 | シリンジ1(NATA)、シリンジ2(緩衝液) |
| ⅳ) | 反応の測定 | シリンジ1(NATA)、シリンジ2(NBS) |
ⅰ)リークの確認
ストップト・フロー装置は、流路の接続部等から試料溶液がリークすることがある。この場合、溶液の流れが止まらないため正確な測定ができない。したがって、リークの有無を確認しなければならない。具体的な手順は以下の通りである。ドライブシリンジに緩衝液を導入する。二三度緩衝液で共洗いをする。その際、シリンジ内に気泡が入らないように注意する。ドライブシリンジを緩衝液で満たし、20ショット程度空打ちをして、流路と観測フローセル内を緩衝液に置きかえる。リークの有無を確認するため測定時間を 10 s 程度に設定し、測定を開始する。リークがなければ、トリガー後にドライブシリンジは停止する。リークがある場合は、pressure held になっているためトリガー後もドライブシリンジが少しずつ動き続ける。これを見つけるためには、プランジャの先端部分とシリンジにある文字の印刷との位置関係が測定中に変化するかどうかを基準にするとわかりやすい。リークが認められた場合は、原因を探し、リークをなくさなければならない。可能性のある原因としては、1. チューブが折れている、2. チューブの接続があまい(測定温度が室温から外れていると、収縮によって接続があまくなることがある)等があげられる。1の時には、チューブの交換、2の時には流路の接続部の増し締めなどを行う(ただし締めすぎに注意すること)。
ⅱ)バックグラウンドの測定
測定時間を 50 ms に設定する。リークの確認と同様に測定を開始する。バックグラウンドの測定では、一定の大きさのシグナルが表示され続けるだけである。シグナルの変化が見られるようであれば、脱気が不十分である場合があるので、再度脱気した後、もう一度測定しなおす。10回程度積算すると S/N の良いデータが得られる。メモリー上に記憶できるデータ数が限られている場合は、測定後すぐに保存するか、auto save に設定しておく。
ⅲ)混合能率の評価
シリンジ1を NATA に置き換える。まずは少量(0.5 – 1 mL)の NATA でシリンジ内を共洗いする。シリンジ1を NATA に置き換えたら、空打ちをして流路も NATA に置き換える。シリンジ1を NATA で、シリンジ2を緩衝液で満たし、測定を開始する。混合能率の測定では、一定の大きさのシグナルが表示され続けるだけである。シグナルの変化が見られるようであれば、NATA と緩衝液とが充分に混合していない可能性がある。あまりないことではあるが、ドライブシリンジ駆動用の窒素ガスの圧力がメーカー推奨の値に達していない可能性があるので確認する。
ⅳ)反応の測定
シリンジ2を NBS に置き換える。これはシリンジ1を NATA に置き換えた時と同様にして行う。測定は低濃度の NBS から順に行えばシリンジ内の溶液の置き換えの際、必要な溶液の量を節約できる。シリンジ1を NATA、シリンジ2を NBS で満たし、測定を開始する。
4)解析
表示される時間軸はトリガー後の経過時間 \(t_{\mathrm{trigger}}\) であり、反応時間 \(t\) ではない。したがって時間軸の補正が必要になる。反応は二種類の溶液が混合されたときに開始される。つまり、反応開始時刻は、溶液が溶液混合器近傍にあるときである。その後混合された溶液は、溶液混合器から観測フローセルまで導かれる。溶液混合器から観測フローセルまで到達するのに必要な時間を \(\Delta t\) とすると、
\[t = t_{\mathrm{trigger}} + \Delta t \tag*{(式6)}\]である。いま、
\[A = \exp(-\lambda \Delta t) \tag*{(式7)}\]とおくと式5は
\[N(t) = A \cdot \exp(-\lambda t_{\mathrm{trigger}}) \tag*{(式8)}\]となる。実験で得られる反応曲線は式8であるので、反応曲線から \(A\) の値を評価することによって \(\Delta t\) を得る。フィッティングで得られた当てはめ曲線が反応曲線と一致しない時間域は観測フローセル内の溶液の流れが止まっていないと考えられるので、この時間域も不感時間になる(図2)。
具体的には次のように解析する(図3)。まず、「iii)混合能率の評価」と「iv)反応の測定」で得られた反応曲線からバックグラウンドを引く。バックグラウンド補正の後、「iii)反応の測定」で得られた反応曲線を、「iv)混合能率の評価」で得られた反応曲線で割り、規格化する。規格化後、縦軸(相対蛍光強度)を対数表示にする。対数表示した相対蛍光強度が直線とみなせる時間域のデータを用いて、単一指数関数でフィッティングする。測定で得られた反応曲線とフィッティングで得られた当てはめ曲線とが一致し始める最も早い時刻(\(t_{\mathrm{stop}}\))を読み取る(図3a)。\(t_{\mathrm{stop}}\) 以降、観測フローセル内の溶液が静止しているとみなせる。確認のため、\(t_{\mathrm{stop}}\) 以降のデータを用いて、再度、単一指数関数でフィッティングし、\(t_{\mathrm{stop}}\) が、測定で得られた反応曲線と当てはめ曲線とが一致し始める時刻であることを確認する。すべての NBS 濃度に対する当てはめ曲線は相対蛍光強度1で交わる(図3b)。その時刻が、試料溶液が溶液混合器から観測フローセルに至るまでに必要な時間(\(\Delta t\))である。溶液が溶液混合器から観測フローセルに至るまでに必要な時間(\(\Delta t\))と溶液が止まるまでに必要な時間(\(t_{\mathrm{stop}}\))を合わせた時間が、装置の不感時間である。
5)後片付け
測定終了後、流路を洗浄する。充分脱気した超純水を 100 mL 用意する。測定時間を最短に設定し、二つのドライブシリンジを超純水に置き換える。100 mL 分空打ちを行い流路を洗う(二時間程度)。洗浄後、計算機等の電源を落とし、窒素圧をぬく。
2. apoMb の尿素濃度ジャンプによるアンフォールディングの測定
apoMb のアンフォールディング
apoMb は、25℃、pH 5.7で天然状態にある。この溶液条件にある天然 apoMb 溶液を高濃度尿素を含む溶液と混合することによって、尿素濃度ジャンプを引き起こし、それによってアンフォールディング反応を開始することができる。
観測する反応と反応条件
不感時間測定と同様、用いるストップト・フロー装置は、Applied Photophysics 社製 SX.17 を想定する。5 µM における apoMb のフォールディング反応過程をトリプトファンの蛍光をプローブとして観測する。天然 apoMb 溶液と尿素を含む溶液との混合比は、不感時間測定と同様 1 : 5 である。それぞれの反応溶液は、
| 体積 | 溶液 | |
|---|---|---|
| シリンジ1 | 0.5 mL | 30 µM apoMb in 10 mM クエン酸ナトリウム(pH 5.7)(溶液1) |
| シリンジ2 | 2.5 mL | 10 mM クエン酸ナトリウム / 5.4 M 尿素(pH 5.7)(溶液2) |
であり、5 µM apoMb の 0 M から 4.5 M への尿素濃度ジャンプによるアンフォールディング反応を観測できる。
実験の詳細
1)サンプルの調製
30μM apoMb in 10 mM クエン酸ナトリウム(pH 5.7)(溶液1)、10 mM クエン酸ナトリウム / 5.4 M 尿素(pH 5.7)(溶液2)および 10 mM クエン酸ナトリウム(pH 5.7)(溶液3;apoMb を含まない溶液1)を調製する。蛍光強度を(例えば、酸変性状態に対する)相対蛍光強度で表す必要があるときは 30 µM apoMb in HCl(pH 2.0)(溶液4)および HCl(pH 2.0)(溶液5)を調製する。調製した溶液の濾過、測定温度での平衡化、脱気を行うことなどの前処理は、不感時間測定と同様に行っておく。装置の立ち上げについては、不感時間測定の 2)を参照。改めて設定するパラメータについては、以下に述べる。また、実験に用いるセットアップでの装置の性能評価(不感時間、混合能率)は予め行っておく。
2)測定
| ⅰ) | リファレンスの測定 | シリンジ1(溶液4)、シリンジ2(溶液5) |
| ⅱ) | 反応の測定 | シリンジ1(溶液1)、シリンジ2(溶液2) |
| ⅲ) | バックグラウンドの測定 | シリンジ1(溶液3)、シリンジ2(溶液2) |
ⅲ)はバックグラウンド測定であり、ⅱ)はアンフォールディング測定である。ⅰ)は、蛍光強度を酸変性状態での蛍光に対する相対値に規格化する場合に必要な測定である。連続フロー法などの他の手法で得られる反応曲線とストップト・フロー法で得られる反応曲線とを繋ぎたいときに必要になる。溶液交換の手順も、不感時間測定にならう。
測定しながら、パラメータの設定を行う。
光電子増倍管の電圧、オフセット:
まず、反応初期状態(天然状態)と終状態(ほどけた状態)との蛍光について、蛍光スペクトルを予め測定しておき、反応過程を観測した際に起こる蛍光強度変化を予想しておく。光電子増倍管を適当な値(〜500 V)に設定し、反応を観測する。シグナルがフルスケールを超えないように注意して、電圧をあげる。始状態も終状態も蛍光強度が大きく、しかも強度変化が小さい場合には、オフセットを用いる。
本測定では、電圧を 550 V に設定し、オフセットは使用していない。
測定時間:
測定した反応曲線から、およその時定数を評価する。測定時間は、反応に起因する蛍光強度変化がなくなるまで(最も遅い相の時定数の5 – 10倍程度の時間)とする。装置の安定性以上の長い時間の測定を行うことはできないので、ストップト・フロー法では測定できない長時間の測定については、マニュアルミキシングで測定する。また、蛍光測定の場合は、励起光によって色素が壊れるフォトブリーチが起こることがある。この場合、反応が終わっても蛍光強度におよそ時間の一次関数と見なせる変化が起こる。しかしながら、フォトブリーチは、反応ではないので、解析の際には、線形項を加えたフィッティング関数を用いる。
本測定では、500 ms 間測定を行った。
データ間隔:
それぞれの相の時定数を得るためには、各相につき、数十点(少なくとも二十点)程度のデータ点が必要である。複数の相からなる反応の場合には、最も速い相の時定数の2 – 3倍程度の時間を取り、その時間内でのデータ点が数十になる様にデータ間隔を決める。次の相についてもおよそその時定数の2 – 3倍の時間内でのデータ点が数十になる様にデータ間隔を決める。理想的には、全ての相に対して、対応する時定数の2 – 3倍程度の時間を取り、その時間内でのデータ点が数十になる様なデータ間隔の組を用いて、測定することが望ましい。しかし、例えば SX.17 は、ひとつの測定に対して二種類のデータ間隔しか用いることができないので、適宜データ点の間隔を反応曲線に応じて決める必要がある。SX.17 には、対数スケールでデータ取り込みを行うモードもある。このモードは、反応開始後から時間が経つにつれて対数的にデータ間隔が長くなるものである。
本測定は、0.25 ms のデータ間隔で行った。
レスポンス:
ここでいうレスポンスとは、装置内のローパスフィルタの時定数のことである。最も速い過程の時定数をおよそ評価できたら、その数分の一から十分の一程度のレスポンスを選択する。ノイズを減らすことができる。
本測定では、ローパスフィルタは使用していない。
以上の設定を行ったら、改めて測定を繰り返し行い、数回積算する。同様にバックグラウンド、必要があればリファレンスの測定を行う。測定の結果を図4に示す。解析(フィッティング)と後片付けも不感時間測定の項を参照。
工夫とコツ
低温での測定における注意
実験室の湿度などに依るが、概ね測定温度が10℃以下では、観測フローセルの周りに結露が生じることがある。その場合は、セルホルダーをビニール袋で覆い、その中を窒素ガスでパージすることにより、結露を防ぐことができる。
装置設定によって性能が変わることへの注意
ストップト・フロー装置のカタログやマニュアルに、不感時間の測定方法と装置の典型的な不感時間が掲載されていることが多い。この様な性能は、装置の性能が見かけ上もっともよくなる条件で得られているものである。測定条件の例としては、溶質濃度の低い水溶液同士の 1 : 1 混合があげられる。しかし、実際の実験では、例えば6 M尿素を含む溶液と尿素を含まない溶液の混合行うことや、1 : 10 の混合比での混合を行う必要があることも多い。特に、1. 非対称混合(1 : 1 混合以外の溶液混合)を行う場合、2. 粘度の異なる溶液の混合を行う場合、については、装置のカタログやマニュアルであらわに述べられていることが少ないが、混合能率は悪くなり、不感時間は長くなることがある。この様な設定では、カタログにある性能に基づくのではなく、実際に各設定の下で混合能率、不感時間を評価しなければならない。
溶液の密度とシリンジの位置
密度の大きく異なる溶液の混合の場合(例えば尿素濃度の差が大きい場合)、どちらのシリンジにどちらの溶液を用いるかに注意が必要になる。SX.17 では、溶液混合器に直接接続されている流路の高さが異なっている(図1)。密度勾配に起因する流路内の溶液の移動を防ぐために、密度の小さい溶液を上側の流路(ドライブシリンジ1)に、密度の大きい溶液を下側の流路(ドライブシリンジ2)に接続する。
装置の安定性
ストップト・フロー装置の流路は繋がっているため、長時間の測定においては、未反応の溶液と反応溶液とが観測フローセル内で混合してしまうことがある。この様な、長時間の測定に対する装置の安定性を評価するためには、NATA の緩衝液等による希釈後のシグナルの時間変化を測定する。シグナルの変化が見られない限り、反応の観測が可能である。また、100 s 以上の測定の後に連続して反応を観測する場合、これら二つの反応曲線が重ならないことがある。これは、拡散によって流路が汚染され、観測フローセル内の試料溶液の置換がうまくいかないことに起因するので、空打ちによって溶液を少量流して流路を洗うことによって解消される場合がほとんどである。SX.17 の場合、測定時間が 100 s 以上の遅い反応の測定中は pressure held に設定していてもドライブラムから圧力が抜ける。そのため、測定中にドライブシリンジのバルブを切り替えることが可能であり、ドライブシリンジを流路から切り離すことにより、汚染の拡大を防ぐことができる。
試料溶液の体積の最小化
一ショットの測定に必要な試料溶液の体積は、溶液混合器から観測フローセルまでにある溶液を、新たに置き換えるだけの量で充分である(典型的には、計 0.1 – 0.2 mL)。一ショットの測定に使用される試料溶液の体積は、測定開始時にストップシリンジから排出される溶液の体積と同じである。試料溶液が充分にあり、一ショットの体積を充分大きくとることができれば、溶液の置き換えに問題は生じない。しかし、蛋白質等の貴重な試料溶液を使用する場合は、測定に用いる体積を可能な限り小さくしたい。そのためには、ストップシリンジのラム下側に取り付けられているネジを調節する。このネジをまわすことによって、測定に使用される試料溶液の体積を変えることができる。まず、体積を最小にする。このときは、観測フローセル内の試料溶液の置き換えがほとんどなされないので、反応曲線における蛍光強度変化量は小さくなる。一ショット分の試料溶液の体積を増やすと、反応曲線に見られる蛍光強度変化量も増えていく。さらに、ある体積以上になると反応曲線の蛍光強度変化量は一定になる。これは、観測フローセル内の試料溶液の交換が充分に行われていることを示しているので、この体積が測定に必要な最小の試料溶液の体積である。
文献
- Chance, B., J. Franklin. Inst., 229, 445–476 (1940).
- Chance, B., J. Franklin. Inst., 229, 613–640 (1940).
- Chance, B., J. Franklin. Inst., 229, 737–766 (1940).
- 廣海啓太郎, 酵素反応解析の実際 162–213 講談社サイエンティフィク (1978).
- 大西正健, 生物化学実験21 酵素反応速度論実験入門 147–178 学会出版 (1987).
- Peterman, B. F., Anal. Biochem., 93, 442–444 (1979).
- Peterman, B. F. & Laidler, K. J., Biochim. Bhiphys. Acta., 577, 314–323 (1979).
- Paul, C. et al., Anal. Biochem., 101, 442–448 (1980).
- Brossette, P. et al., Anal. Biochem., 181, 234–238 (1989).
- Tonomura, B. et al., Anal. Biochem., 84, 370–383 (1978).
改訂履歴
2023年12月2日 改訂
- 「装置・器具・試薬」を一部改訂(下記の太字部分を加筆・修正)
ストップト・フロー装置(SX.17型[2023年11月現在: 販売終了 SX.20型が後継機]、Applied Photophysics)
恒温槽(RTE-110、Thermo Fisher Scientific[2023年11月現在: 販売終了、同等の冷却水循環装置で代替可能])
-
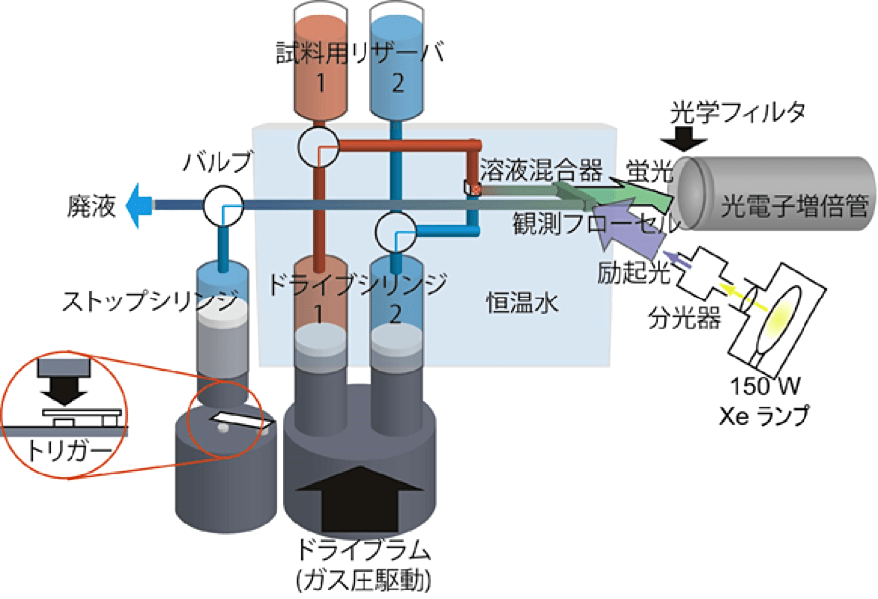
図1:ストップト・フロー装置。ドライブシリンジへの試料溶液の補充や、ストップシリンジから溶液を排出する際はバルブを切り替える。ドライブシリンジ1は上側から、ドライブシリンジ2は下側から溶液混合器へと接続されているので、密度の小さい溶液はシリンジ1に、大きい溶液はシリンジ2に接続する。 -
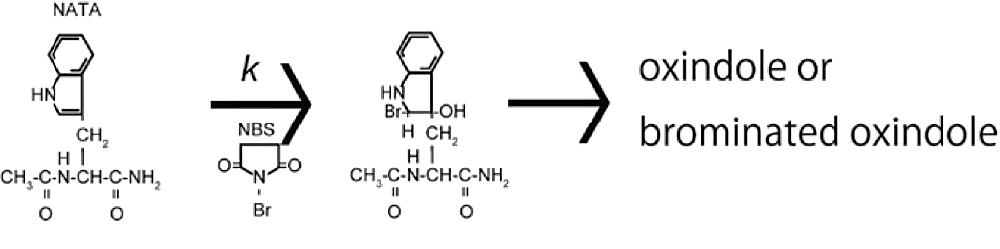
スキーム1:NBS による NATA の消光反応。この反応では、蛍光を示す物質は NATA のみであるため、消光が起きる。 -
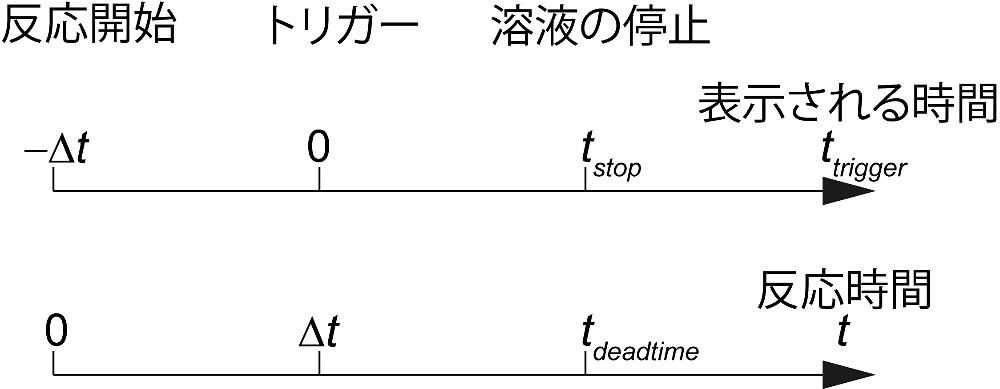
図2:示される時間と実際の反応時間との関係。表示される時間 \(t_{\mathrm{trigger}}\) はトリガーした時刻を基準としているため、実際の反応時間 \(t\) とは異なっている。\(\Delta t\) は溶液混合器から観測フローセルに試料溶液が導かれるまでに要する時間。\(t_{\mathrm{stop}}\) はトリガーの後、試料溶液が完全に停止するまでの時間。\(t_{\mathrm{deadtime}}\) は装置の不感時間であり、\(\Delta t\) と \(t_{\mathrm{stop}}\) からなる。 -
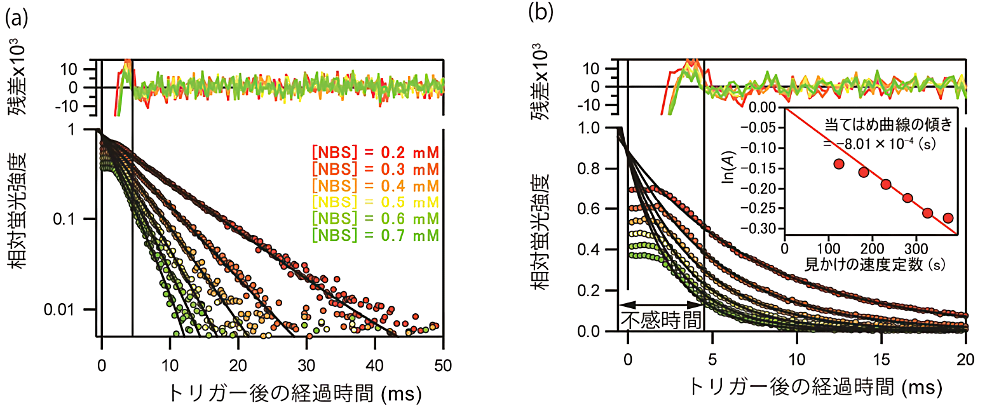
図3:NATA/NBS 反応による蛍光強度変化。NATA の濃度は 5 µM、NBS の濃度は上の反応曲線から順に 0.2, 0.3, 0.4, 0.5, 0.6 および 0.7 mM である。5 µM NATA の蛍光強度を1とし、スキーム1の反応で観測される相対蛍光強度を、トリガー後の経過時間に対してプロットしている。
(a) 相対蛍光強度は対数表示してある。トリガー後約 4.5 ms 以前の蛍光強度は直線からのずれが見られる。したがって、トリガー後、流れが完全に停止するまでに必要な時間 \(t_{\mathrm{stop}}\) は約 4.5 ms である。
(b) 相対蛍光強度は線形表示してある。トリガー後 4.5 ms 以降のデータに対して非線形最小二乗法を用いて単一指数関数(式8)を当てはめた。−0.8 ms 付近ですべての当てはめ曲線は1になる。埋め込みのグラフは、当てはめ曲線(式8)の速度定数 \(l\) に対して変化量 \(A\) を対数プロットしてある。式7より、\(\ln(A) = -\lambda \cdot \Delta t\)(式9)であり、グラフの傾きが \(\Delta t\) に対応する。反応がない場合、つまり、\(\lambda = 0\) の場合は \(\ln(A) = 0\) である。グラフから、試料溶液が観測フローセルに至るまでに必要な時間 \(\Delta t\) は約 0.8 ms である。したがって不感時間 \(t_{\mathrm{deadtime}}\) は約 5.3 ms と評価される。 -
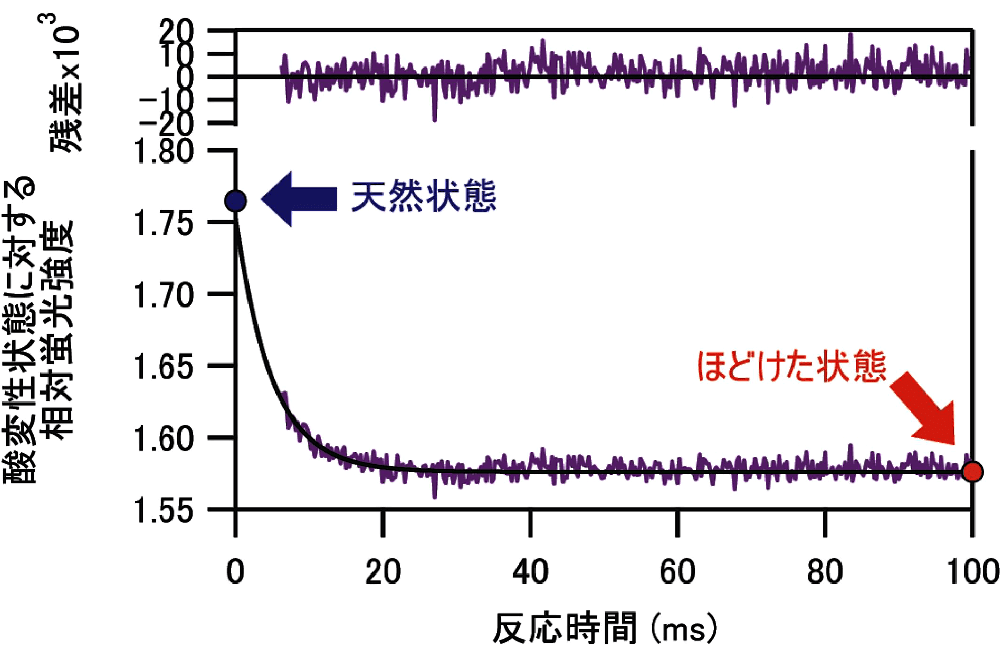
図4:apoMb のアンフォールディング反応曲線と、天然状態、ほどけた状態の相対蛍光強度。混合後の溶液条件は 5 µM apoMb / 10 mM クエン酸ナトリウム / 4.5 M 尿素(pH 5.7, 25℃)である。天然状態にあった蛋白質が、ほどけた状態へと変化する。反応時間 \(t\) に対する当てはめ曲線 \(F(t)\) は、\(F(t) = A_{0} + b \cdot t + A \exp (-k \cdot t)\)(式10)
\(A_{0} = 1.58;{\ }b = -0.00237{\ }\mathrm{s^{-1}}\);
\(A = 0.177;{\ }k = 201.9{\ }\mathrm{s^{-1}}\)
である。\(t\) に関する一次の項はフォトブリーチによる蛍光強度変化を近似的に表している。


