概要
圧力摂動熱量測定(PPC)は、溶液に対する圧力摂動により生じた熱量変化を測定することで、溶質の熱膨張係数を測定する手法で、蛋白質の熱転移における部分体積変化、熱膨張係数変化を評価することができる。本プロトコールでは示差走査熱量計(DSC)とPPCアクセサリーとを使用して、蛋白質の熱転移に伴う部分体積変化を評価する方法の概略を述べる。実験としては、溶液の精密密度測定による溶質の部分体積の評価と、計4種類のPPC測定(水、buffer、サンプルの組み合わせ)とを行う。またデータ解析としてPPC測定データから熱膨張係数を評価し、蛋白質熱転移の多状態解析により体積変化を評価する。
イントロダクション
圧力摂動熱量測定(PPC)は一定温度で、溶液に減圧・加圧を行うことで生じる熱量変化を測定することで、溶質の熱膨張係数を精度よく評価する比較的新しい手法である(1)。蛋白質などの生体物質のPPC測定も行われており、蛋白質の熱転移に伴う部分体積変化、熱膨張係数変化が評価されている。部分体積、熱膨張係数は溶質の水和状態に敏感に影響される熱力学量として注目されている。
装置、器具、試薬
筆者らはMicroCal VP-DSCとPPCアクセサリーとを使用した。(現在GEヘルスケア社がMicroCal VP-DSCの販売を行っている。またTA Instrument社装置NanoDSCもPPC測定が可能な仕様となっている)。
- MicroCal VP-DSC (GEヘルスケア社)
- PPCアクセサリー(GEヘルスケア社)
- 窒素ガスボンベ(加圧用)
- 振動式密度計DMA5000 (Anton-Paar社)
実験手順
1日目
PPCシステムのセットアップ
測定試料の準備
2日目
水-水測定
水-buffer測定
3日目
buffer-buffer測定
buffer-サンプル測定
密度測定
4日目
データ解析(1):熱膨張係数の評価
データ解析(2):2状態、3状態解析による体積変化の評価
実験の詳細
1日目
以下は筆者が使用しているMaicroCal社装置VP-DSCとPPCアクセサリーでのPPC測定手順である。(PPC測定はDSC装置を使用して行う。一般的なDSC測定については文献2を参照して下さい)。
PPCシステムのセットアップ
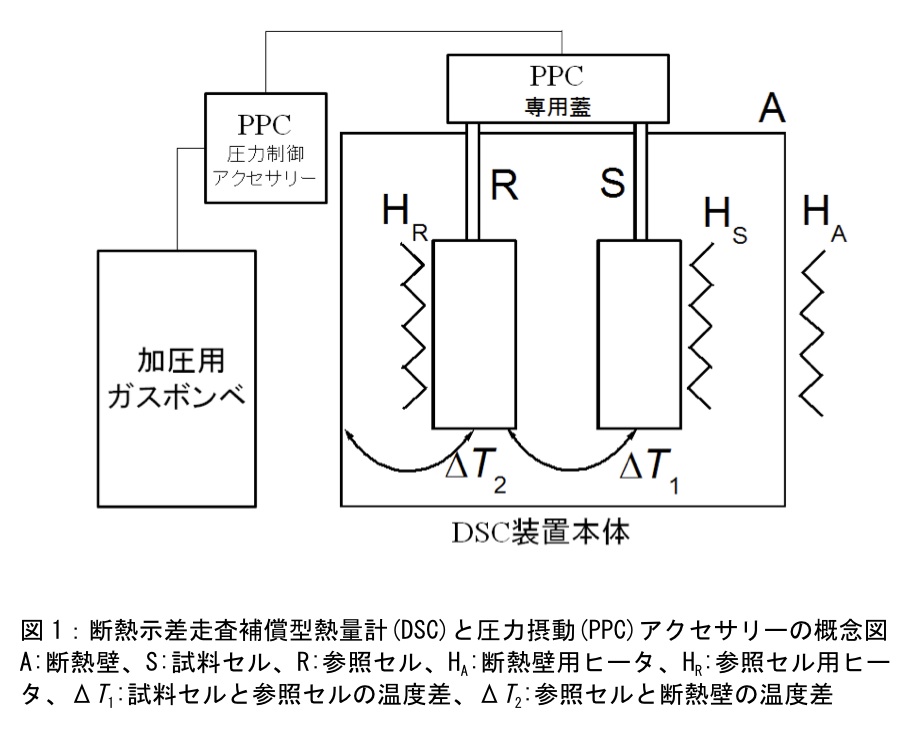
図1にDSC装置とPPCアクセサリーの概念図を示した。PPC測定は通常DSC測定を行っている装置のセルのフタをPPCアクセサリーのフタに変更して行う。PPCアクセサリーは加圧用窒素ボンベと接続している。窒素ボンベの圧力を50~75 psi(3~5 atm程度)に調節する。圧力が高いほど観測される熱量は大きくなるが、セルの耐圧限界以上に加圧しないように注意する。(筆者が使用している装置はセルの耐圧限界が80 psiである。セルの耐圧限界は装置・型式により異なるので注意する)。
測定試料の準備
測定するサンプルはDSCの場合と同様にbufferを外液として透析を行う(2)。PPC測定では感度を上げるために、サンプル濃度は2.5 mg/ml以上の高濃度で行うことが推奨されている。筆者の使用している装置では1回の測定で1 ml程度のサンプル量が必要である。
2日目
水-水測定
蛋白質溶液のDSC測定では通常buffer測定とサンプル測定の2回の測定を行うが、PPC測定では水-水測定、水-Bf(サンプル側セル)測定、Bf-Bf測定、Bf-サンプル測定の4回の測定を行う必要がある。
セルに充填する純水はよく脱気しておく必要がある。セルへの充填は通常のDSC測定の場合と同じで、専用シリンジを使いセルに気泡が入らないように充填・泡抜き(シリンジプランジャーを上下にポンピングする)を行う(2)。リファレンスセル、サンプルセルの両方に純水を充填する。
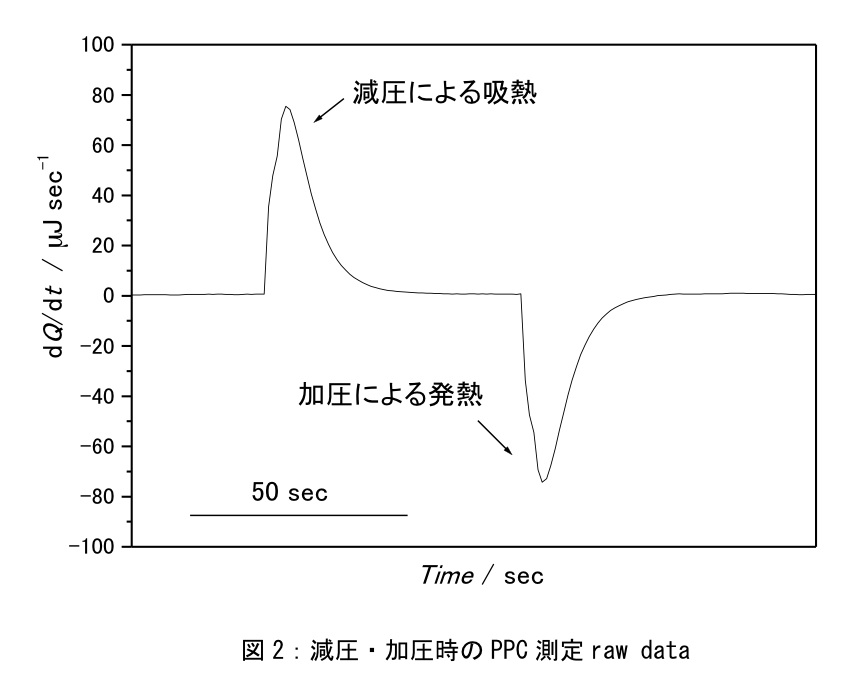
PPC測定では一定温度で加圧状態(+75 psi)から常圧状態(+0 psi)、常圧状態(+0 psi)から加圧状態(+75 psi)への変化にともなう熱量を測定する(図2参照)。各温度で一回の測定で減圧・加圧に伴う2点のデータを取得する。10℃~100℃の温度範囲を5℃刻みで、各温度1回積算を行う場合は1測定に3時間半程度かかる。今回は5℃~100℃の温度範囲を2.5℃刻みで各温度1回積算を行った。(1測定に7時間程度かかる)。
水-buffer測定
水-水測定終了後にサンプルセルによく脱気したbufferを充填する。bufferはサンプルを透析した透析外液を使用する。今回は5℃~100℃の温度範囲を2.5℃刻みで測定を行った。
3日目
buffer-buffer測定
水-Bf測定終了後にリファレンスセルによく脱気したbufferを充填する。bufferはサンプルを透析した透析外液を使用する。今回は5℃~100℃の温度範囲を2.5℃刻みで測定を行った。
buffer-サンプル測定
Bf-Bf測定終了後にサンプルセルによく脱気したサンプル溶液を充填する。サンプル濃度は分光光度計により前もって決定しておく。buffer-サンプル測定では統計誤差を減らすため各温度で積算を3回行った。(5℃~100℃の温度範囲を2.5℃刻みで各温度3回積算を行うと、1測定に20時間程度かかる)。
密度測定による部分体積評価
PPC測定と同じサンプル、溶媒を使用して20℃でサンプル溶液、1.5倍希釈溶液、2倍希釈溶液、4倍希釈溶液、buffer溶液の密度測定を行いサンプルの部分体積を評価する。密度計がない場合はサンプルの部分体積の文献値、計算値などで代用する。
4日目
データ解析(1):熱膨張係数の評価
図2はBf-サンプル測定におけるある温度での減圧・加圧に伴う熱変化(ΔQ)を示している。ピーク面積からそれぞれの測定でのΔQを算出する。
水-水測定、水-Bf測定、Bf-Bf測定、Bf-サンプル測定のΔQから下記の関係式を用いて試料の熱膨張係数(αp)を評価する。
\[\alpha_b = \alpha_w - \frac{\Delta Q^{b-w}}{TV_{1}\Delta P} \tag{1}\] \[\alpha_p = \alpha_b - \frac{1}{f_p} \frac{v_s}{v_p} \frac{\Delta Q^{s-b}}{TV_{1}\Delta P} \tag{2}\]ΔQb-wは水-BfでのPPC測定で観測されたΔQから水-水測定でのΔQを差し引いた値で、ΔQs-bはBf-サンプル測定でのΔQからBf-Bf測定でのΔQを差し引いた値を示している。fpはサンプルの質量分率、vsはサンプル溶液の比容、vpはサンプルの部分体積、V1は熱量計のセル体積を示している。またαW、αb、αpは水、buffer、サンプルの熱膨張係数を表している。
ある温度でのサンプルの部分体積と、水-水測定、水-Bf測定、Bf-Bf測定、Bf-サンプル測定結果からMicrocalVP-DSC装置の付属解析ソフトMairocal LLC PPCで簡便にサンプルのαpを評価することができる(ただしこの解析ではvs、vpの温度依存性は打ち消しあうため誤差範囲内で無視できると仮定して解析している)。
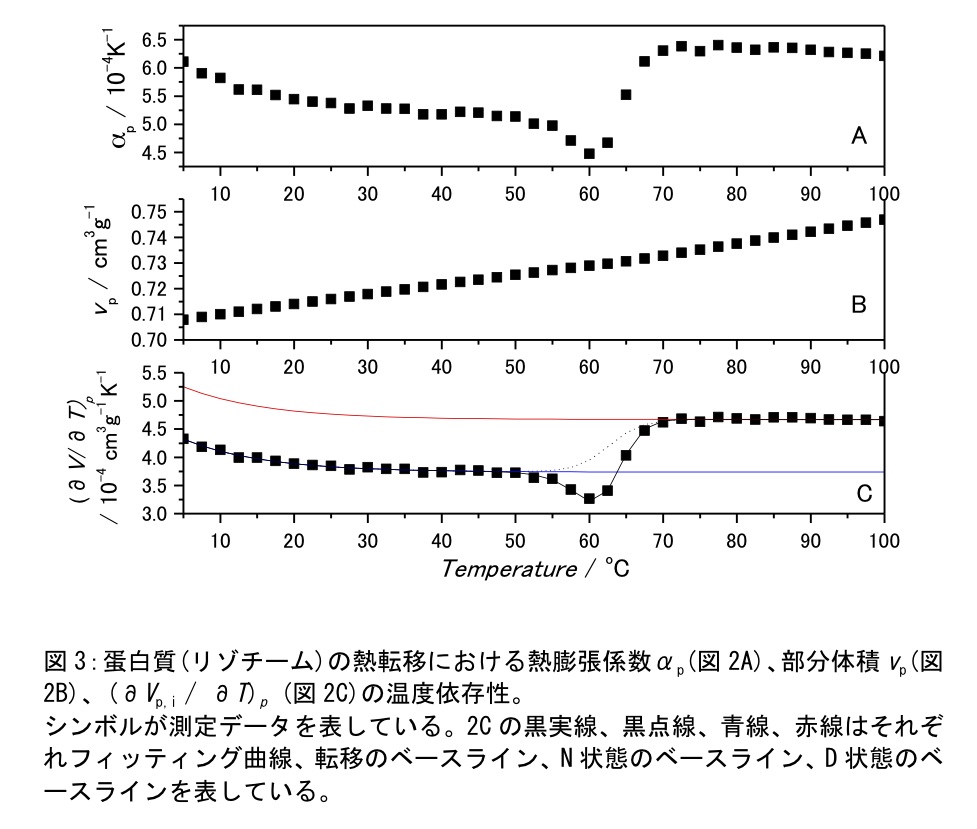
我々のグループではvs、vpの温度依存性含めた解析として各温度でαpとvpを収束するまで繰り返し計算を行った(3)。現在までのところニワトリ卵白リゾチーム、ウマ心臓シトクロムcなどのモデル蛋白質ではvs、vpの温度依存性を考慮に入れた解析でのαpと、温度依存性を無視できると仮定した解析でのαpとの差は1%以内に収まっているが、繰り返し計算を含む解析によりPPC測定からαpだけでなくvpの温度依存性も同時に評価できる。図3にPPC測定で評価した蛋白質(リゾチーム)の熱転移におけるαp、vp、(∂Vp / ∂T)pの温度依存性を示した(5℃~100℃の温度範囲を2.5℃刻みで測定を行った)。
データ解析(2):蛋白質熱転移の多状態解析(今回は2状態解析)による体積変化の評価
熱膨張係数は次式のように表される。
\[\alpha_p = \frac{1}{V_p} (\frac{\partial V_p}{\partial T})_P \tag{3}\]蛋白質の熱転移に伴う(∂Vp / ∂T)p の温度依存性は次式で表される。
\[(\frac{\partial V_p}{\partial T})_P = \sum_i(\frac{\partial V_{p,i}}{\partial T})_p f_i + \frac{\sum_{i < j}\Delta V_{ij}(T)\Delta H_{ij}(T)f_j(T)f_i(T)}{RT^2} \tag{4}\]ここで、(∂Vp,i / ∂T)pはi状態の(∂Vp / ∂T)pであり、今回は指数関数で近似した。fiとfjはi状態, j状態のモル分率を表している。またΔVij, ΔHijはi状態からj状態への転移に伴う体積変化、エンタルピー変化を示している。PPC測定で得られた([image.wmf]Vp / [image.wmf]T)pを上記の式で最小二乗フィッティングを行うことで体積変化などの熱力学量を評価することができる。図3Cは上記モデルでの蛋白質の2状態転移の解析結果を示している。転移に伴い下向きのピークが観測されている。ピーク面積が体積変化ΔVに対応している。またDSCデータとPPCデータのグローバル解析や、体積パラメーター以外の転移パラメーター(ΔHや転移温度など)をDSC測定により決定した値を使用してPPC解析を行うことでΔVやΔαpなどの体積パラメーターを精度よく評価することができる(3,5)。
工夫とコツ
DSCによる可逆性のチェック
PPC測定では各温度で加圧状態(75psi)から常圧状態(0psi)、常圧状態(0 psi)から加圧状態(75 psi)への変化にともなう熱量を測定する。積算1回の場合でも各温度で15分程度等温保持することになり、10℃~100℃までの測定で3時間以上の長時間測定を行うことになる。またPPC測定は測定感度を上げるため2.5 mg/ml以上と高濃度で測定することが推奨されている。高濃度で長時間の測定中に会合・凝集などが起きてないことを確認するために、PPCに使用する濃度でDSC測定を行い可逆性を確認しておくことが推奨される。あるいは、低温から高温まで測定した後に、再度低温の測定を行い、最初の測定と一致するか(熱転移の可逆性)の確認を行うことを推奨する。
濃度と積算
PPC測定でデータ精度をよくする工夫としてはサンプルを高濃度にすること、積算回数を増やすことが挙げられる。その際には高濃度でのサンプルの熱転移の可逆性を確認しておく必要がある。通常2.5 mg/ml~5 mg/ml程度のサンプル濃度でPPC測定が行われることが多い。低温(20℃以下)でのαpの絶対値は水和状態により変化することが知られている。10mg/ml以上のサンプル濃度ではサンプルの分子間相互作用により低温でのαpの絶対値が小さめに観測されることが報告されている(4)。しかし高温での熱転移に伴うΔVやΔαpなどは10 mg/ml以上の高濃度で精度よく評価できるため、3状態転移などの複雑な熱転移などでは20 mg/ml程度のサンプル濃度でPPC測定が行われている(3)。また多くの蛋白質で高濃度で高温で長時間保持するのは可逆性を低下させる原因となる。これを防ぐには、蛋白質の低濃度での測定を可能とする必要があり、現在よりも装置の耐圧性を高めた上で、より大きな圧力変化を与えて測定したり、熱量計の感度を高めることが必要となる。
DSCパラメーターを使用したPPC解析
式(3-4)のようにPPC測定より得られるαp、(∂Vp,i / ∂T)pの温度依存性からΔVやΔαpなどの体積パラメーターとΔH、f、転移温度などの転移パラメーターを両方評価することができる。しかし1つのPPCデータのみから体積、転移パラメーターを同時に評価すると誤差が大きくなる場合もある。そこでPPCとDSCデータのグローバル解析や、転移パラメーターをDSCで評価した値に固定したPPC解析により体積パラメーターのみを評価することで解析誤差を小さくでき(場合によっては10倍以上小さくすることができる)、体積情報をより精度よく抽出する方法が提案されている(2,3)。DSCと組み合わせたPPC解析は3状態熱転移などの複雑な系では特に有効である。
実験の安全
PPC測定では加圧ガスボンベを使用して試料容器に減圧・加圧を行っているが、減圧の際に結構大きなガスが解放される音がでる。ガス漏れ事故と誤解されないために、PPC測定する際には周囲に人に周知しておく。
文献
- Lin, L. et al., Anal. Biochem., 203, 144-60 (2002)
- 向山厚 et al., 蛋白質科学会アーカイブ, 1, e039 (2008)
- Nakamura, S. & Kidokoro, S., J. Phys. Chem. B, 116, 1927-32 (2012)
- Mitra, L. et al., Phys. Chem. Chem. Phys., 8, 1249-65 (2006)
- Schweiker, K. et al., Biochemistry, 48, 10846-51 (2009)
概要
圧力摂動熱量測定(PPC)は、溶液に対する圧力摂動により生じた熱量変化を測定することで、溶質の熱膨張係数を測定する手法で、蛋白質の熱転移における部分体積変化、熱膨張係数変化を評価することができる。本プロトコールでは示差走査熱量計(DSC)とPPCアクセサリーとを使用して、蛋白質の熱転移に伴う部分体積変化を評価する方法の概略を述べる。実験としては、溶液の精密密度測定による溶質の部分体積の評価と、計4種類のPPC測定(水、buffer、サンプルの組み合わせ)とを行う。またデータ解析としてPPC測定データから熱膨張係数を評価し、蛋白質熱転移の多状態解析により体積変化を評価する。
イントロダクション
圧力摂動熱量測定(PPC)は一定温度で、溶液に減圧・加圧を行うことで生じる熱量変化を測定することで、溶質の熱膨張係数を精度よく評価する比較的新しい手法である(1)。蛋白質などの生体物質のPPC測定も行われており、蛋白質の熱転移に伴う部分体積変化、熱膨張係数変化が評価されている。部分体積、熱膨張係数は溶質の水和状態に敏感に影響される熱力学量として注目されている。
装置、器具、試薬
筆者らはMicroCal VP-DSCとPPCアクセサリーとを使用した。(現在GEヘルスケア社がMicroCal VP-DSCの販売を行っている。またTA Instrument社装置NanoDSCもPPC測定が可能な仕様となっている)。
- MicroCal VP-DSC (GEヘルスケア社)
- PPCアクセサリー(GEヘルスケア社)
- 窒素ガスボンベ(加圧用)
- 振動式密度計DMA5000 (Anton-Paar社)
実験手順
1日目
PPCシステムのセットアップ
測定試料の準備
2日目
水-水測定
水-buffer測定
3日目
buffer-buffer測定
buffer-サンプル測定
密度測定
4日目
データ解析(1):熱膨張係数の評価
データ解析(2):2状態、3状態解析による体積変化の評価
実験の詳細
1日目
以下は筆者が使用しているMaicroCal社装置VP-DSCとPPCアクセサリーでのPPC測定手順である。(PPC測定はDSC装置を使用して行う。一般的なDSC測定については文献2を参照して下さい)。
PPCシステムのセットアップ
図1にDSC装置とPPCアクセサリーの概念図を示した。PPC測定は通常DSC測定を行っている装置のセルのフタをPPCアクセサリーのフタに変更して行う。PPCアクセサリーは加圧用窒素ボンベと接続している。窒素ボンベの圧力を50~75 psi(3~5 atm程度)に調節する。圧力が高いほど観測される熱量は大きくなるが、セルの耐圧限界以上に加圧しないように注意する。(筆者が使用している装置はセルの耐圧限界が80 psiである。セルの耐圧限界は装置・型式により異なるので注意する)。
測定試料の準備
測定するサンプルはDSCの場合と同様にbufferを外液として透析を行う(2)。PPC測定では感度を上げるために、サンプル濃度は2.5 mg/ml以上の高濃度で行うことが推奨されている。筆者の使用している装置では1回の測定で1 ml程度のサンプル量が必要である。
2日目
水-水測定
蛋白質溶液のDSC測定では通常buffer測定とサンプル測定の2回の測定を行うが、PPC測定では水-水測定、水-Bf(サンプル側セル)測定、Bf-Bf測定、Bf-サンプル測定の4回の測定を行う必要がある。
セルに充填する純水はよく脱気しておく必要がある。セルへの充填は通常のDSC測定の場合と同じで、専用シリンジを使いセルに気泡が入らないように充填・泡抜き(シリンジプランジャーを上下にポンピングする)を行う(2)。リファレンスセル、サンプルセルの両方に純水を充填する。
PPC測定では一定温度で加圧状態(+75 psi)から常圧状態(+0 psi)、常圧状態(+0 psi)から加圧状態(+75 psi)への変化にともなう熱量を測定する(図2参照)。各温度で一回の測定で減圧・加圧に伴う2点のデータを取得する。10℃~100℃の温度範囲を5℃刻みで、各温度1回積算を行う場合は1測定に3時間半程度かかる。今回は5℃~100℃の温度範囲を2.5℃刻みで各温度1回積算を行った。(1測定に7時間程度かかる)。
水-buffer測定
水-水測定終了後にサンプルセルによく脱気したbufferを充填する。bufferはサンプルを透析した透析外液を使用する。今回は5℃~100℃の温度範囲を2.5℃刻みで測定を行った。
3日目
buffer-buffer測定
水-Bf測定終了後にリファレンスセルによく脱気したbufferを充填する。bufferはサンプルを透析した透析外液を使用する。今回は5℃~100℃の温度範囲を2.5℃刻みで測定を行った。
buffer-サンプル測定
Bf-Bf測定終了後にサンプルセルによく脱気したサンプル溶液を充填する。サンプル濃度は分光光度計により前もって決定しておく。buffer-サンプル測定では統計誤差を減らすため各温度で積算を3回行った。(5℃~100℃の温度範囲を2.5℃刻みで各温度3回積算を行うと、1測定に20時間程度かかる)。
密度測定による部分体積評価
PPC測定と同じサンプル、溶媒を使用して20℃でサンプル溶液、1.5倍希釈溶液、2倍希釈溶液、4倍希釈溶液、buffer溶液の密度測定を行いサンプルの部分体積を評価する。密度計がない場合はサンプルの部分体積の文献値、計算値などで代用する。
4日目
データ解析(1):熱膨張係数の評価
図2はBf-サンプル測定におけるある温度での減圧・加圧に伴う熱変化(ΔQ)を示している。ピーク面積からそれぞれの測定でのΔQを算出する。
水-水測定、水-Bf測定、Bf-Bf測定、Bf-サンプル測定のΔQから下記の関係式を用いて試料の熱膨張係数(αp)を評価する。
\[\alpha_b = \alpha_w - \frac{\Delta Q^{b-w}}{TV_{1}\Delta P} \tag{1}\] \[\alpha_p = \alpha_b - \frac{1}{f_p} \frac{v_s}{v_p} \frac{\Delta Q^{s-b}}{TV_{1}\Delta P} \tag{2}\]ΔQb-wは水-BfでのPPC測定で観測されたΔQから水-水測定でのΔQを差し引いた値で、ΔQs-bはBf-サンプル測定でのΔQからBf-Bf測定でのΔQを差し引いた値を示している。fpはサンプルの質量分率、vsはサンプル溶液の比容、vpはサンプルの部分体積、V1は熱量計のセル体積を示している。またαW、αb、αpは水、buffer、サンプルの熱膨張係数を表している。
ある温度でのサンプルの部分体積と、水-水測定、水-Bf測定、Bf-Bf測定、Bf-サンプル測定結果からMicrocalVP-DSC装置の付属解析ソフトMairocal LLC PPCで簡便にサンプルのαpを評価することができる(ただしこの解析ではvs、vpの温度依存性は打ち消しあうため誤差範囲内で無視できると仮定して解析している)。
我々のグループではvs、vpの温度依存性含めた解析として各温度でαpとvpを収束するまで繰り返し計算を行った(3)。現在までのところニワトリ卵白リゾチーム、ウマ心臓シトクロムcなどのモデル蛋白質ではvs、vpの温度依存性を考慮に入れた解析でのαpと、温度依存性を無視できると仮定した解析でのαpとの差は1%以内に収まっているが、繰り返し計算を含む解析によりPPC測定からαpだけでなくvpの温度依存性も同時に評価できる。図3にPPC測定で評価した蛋白質(リゾチーム)の熱転移におけるαp、vp、(∂Vp / ∂T)pの温度依存性を示した(5℃~100℃の温度範囲を2.5℃刻みで測定を行った)。
データ解析(2):蛋白質熱転移の多状態解析(今回は2状態解析)による体積変化の評価
熱膨張係数は次式のように表される。
\[\alpha_p = \frac{1}{V_p} (\frac{\partial V_p}{\partial T})_P \tag{3}\]蛋白質の熱転移に伴う(∂Vp / ∂T)p の温度依存性は次式で表される。
\[(\frac{\partial V_p}{\partial T})_P = \sum_i(\frac{\partial V_{p,i}}{\partial T})_p f_i + \frac{\sum_{i < j}\Delta V_{ij}(T)\Delta H_{ij}(T)f_j(T)f_i(T)}{RT^2} \tag{4}\]ここで、(∂Vp,i / ∂T)pはi状態の(∂Vp / ∂T)pであり、今回は指数関数で近似した。fiとfjはi状態, j状態のモル分率を表している。またΔVij, ΔHijはi状態からj状態への転移に伴う体積変化、エンタルピー変化を示している。PPC測定で得られた([image.wmf]Vp / [image.wmf]T)pを上記の式で最小二乗フィッティングを行うことで体積変化などの熱力学量を評価することができる。図3Cは上記モデルでの蛋白質の2状態転移の解析結果を示している。転移に伴い下向きのピークが観測されている。ピーク面積が体積変化ΔVに対応している。またDSCデータとPPCデータのグローバル解析や、体積パラメーター以外の転移パラメーター(ΔHや転移温度など)をDSC測定により決定した値を使用してPPC解析を行うことでΔVやΔαpなどの体積パラメーターを精度よく評価することができる(3,5)。
工夫とコツ
DSCによる可逆性のチェック
PPC測定では各温度で加圧状態(75psi)から常圧状態(0psi)、常圧状態(0 psi)から加圧状態(75 psi)への変化にともなう熱量を測定する。積算1回の場合でも各温度で15分程度等温保持することになり、10℃~100℃までの測定で3時間以上の長時間測定を行うことになる。またPPC測定は測定感度を上げるため2.5 mg/ml以上と高濃度で測定することが推奨されている。高濃度で長時間の測定中に会合・凝集などが起きてないことを確認するために、PPCに使用する濃度でDSC測定を行い可逆性を確認しておくことが推奨される。あるいは、低温から高温まで測定した後に、再度低温の測定を行い、最初の測定と一致するか(熱転移の可逆性)の確認を行うことを推奨する。
濃度と積算
PPC測定でデータ精度をよくする工夫としてはサンプルを高濃度にすること、積算回数を増やすことが挙げられる。その際には高濃度でのサンプルの熱転移の可逆性を確認しておく必要がある。通常2.5 mg/ml~5 mg/ml程度のサンプル濃度でPPC測定が行われることが多い。低温(20℃以下)でのαpの絶対値は水和状態により変化することが知られている。10mg/ml以上のサンプル濃度ではサンプルの分子間相互作用により低温でのαpの絶対値が小さめに観測されることが報告されている(4)。しかし高温での熱転移に伴うΔVやΔαpなどは10 mg/ml以上の高濃度で精度よく評価できるため、3状態転移などの複雑な熱転移などでは20 mg/ml程度のサンプル濃度でPPC測定が行われている(3)。また多くの蛋白質で高濃度で高温で長時間保持するのは可逆性を低下させる原因となる。これを防ぐには、蛋白質の低濃度での測定を可能とする必要があり、現在よりも装置の耐圧性を高めた上で、より大きな圧力変化を与えて測定したり、熱量計の感度を高めることが必要となる。
DSCパラメーターを使用したPPC解析
式(3-4)のようにPPC測定より得られるαp、(∂Vp,i / ∂T)pの温度依存性からΔVやΔαpなどの体積パラメーターとΔH、f、転移温度などの転移パラメーターを両方評価することができる。しかし1つのPPCデータのみから体積、転移パラメーターを同時に評価すると誤差が大きくなる場合もある。そこでPPCとDSCデータのグローバル解析や、転移パラメーターをDSCで評価した値に固定したPPC解析により体積パラメーターのみを評価することで解析誤差を小さくでき(場合によっては10倍以上小さくすることができる)、体積情報をより精度よく抽出する方法が提案されている(2,3)。DSCと組み合わせたPPC解析は3状態熱転移などの複雑な系では特に有効である。
実験の安全
PPC測定では加圧ガスボンベを使用して試料容器に減圧・加圧を行っているが、減圧の際に結構大きなガスが解放される音がでる。ガス漏れ事故と誤解されないために、PPC測定する際には周囲に人に周知しておく。
文献
- Lin, L. et al., Anal. Biochem., 203, 144-60 (2002)
- 向山厚 et al., 蛋白質科学会アーカイブ, 1, e039 (2008)
- Nakamura, S. & Kidokoro, S., J. Phys. Chem. B, 116, 1927-32 (2012)
- Mitra, L. et al., Phys. Chem. Chem. Phys., 8, 1249-65 (2006)
- Schweiker, K. et al., Biochemistry, 48, 10846-51 (2009)