概要
タンパク質に結合する金属イオンは生体機能の発現に重要な役割を担う。金属結合タンパク質は分子内に特定の金属種に対する金属結合部位を有している。しかしながら、その金属結合部位に特定の金属種以外の金属を結合することが報告されており、その機能調節、機能非発現時の安定化、疾患の発症につながることが示唆されている。言い換えると、金属タンパク質に結合している金属種の同定は、生体機能発現や疾患発症を理解する上で重要な役割を担うということである。本稿では、金属タンパク質に結合する金属イオンを同定する手法の一つである原子吸光法を紹介する。本同定法は、金属タンパク質に結合する金属イオン種の同定を簡易に行うことが可能であり、直接的かつ信頼性の高い方法である。また、本同定法とX線結晶構造のデータとを組み合わせて、カルシウム結合タンパク質として知られる、アネキシンIVにナトリウムが結合していることを示した例を紹介する。本同定法は目的タンパク質が用意されていれば、調べる金属イオン種の数にもよるが1日足らずで行える簡単な方法である。
イントロダクション
金属タンパク質が、生理活性発現に必要な金属イオンと異なる金属種を結合することはよく知られている(1-3)。その意義は、生理活性に必要な金属を遊離した際にタンパク質を安定化させる(1)、膜との結合/解離の調節(2)などが示唆されている。また、異なる金属を結合することで疾患を誘引する原因となっている可能性も示唆されている(3)。このように、タンパク質にとって生体内機能を維持する上で、金属イオンの結合と結合金属種は重要な意味をもつ。
金属タンパク質に結合している金属イオンの同定には、X線吸収分光(XAFS)法、電子スピン共鳴(ESR)法(4)、電子常磁性共鳴(EPR)法、原子吸光法などが知られている。これらの方法はいずれも長所や短所を持ち合わせている。原子吸光法を用いた結合金属イオンの同定は、異なる結合条件における結合イオンの同定が手軽に行えること、サンプルの調製が簡便であること、データ解析が容易であること、などの点が魅力的である。また、X線結晶構造解析と組み合わせることで、信頼性の高い考察を行うことが可能となる(2)。ただし、この方法のみでタンパク質に金属イオンが特異的に結合していることを示すのは困難である。つまり、あるタンパク質に結合する可能性のあるいくつかの金属イオンについて、本方法を試すことで金属イオン種の同定を行い、総合的に特異的に結合していることを証明する必要がある。
本稿では、実験方法の後半にX線結晶構造の補助的データとして原子吸光法による結合金属イオンの同定を行うことで、カルシウム結合部位を有することが知られているアネキシンIVにナトリウムが結合することを証明した例を紹介する(2)。
装置・器具・試薬
- アセチレン燃焼法を利用した原子吸光装置(各社)
- 簡易脱塩カラム(GEヘルスケア バイオサイエンス社、NAP-5 Colums)
- 冷却遠心機
- ゴム手袋
- 1 N 硝酸
- 各種金属イオン標準液(和光純薬)
- Milli Q水
- 約10 mg/ml タンパク質標品(分子サイズ 36 kDa、金属結合部位 4カ所/1分子)
実験の手順
操作は以下に示す三段階の簡易な操作であり、タンパク質の取扱に不慣れな人でも可能な操作である。
1)タンパク質標品の脱塩
2)タンパク質の酸変性による金属イオンの遊離
3)原子吸光装置による測定
実験の詳細
1)タンパク質標品の脱塩
簡易脱塩カラムを十分量のMilli Q水で平衡化する。簡易脱塩カラムのマニュアルに書かれている容量のタンパク質標品をカラムに通し、緩衝液を取り除くことでタンパク質標品の溶媒をMilliQ水へ置換する。その際、緩衝液中の塩の混入をなるべく避け、タンパク質濃度を下げないようにするため、溶出画分の前半一部と後半一部を除く。例えば、ここで紹介する簡易脱塩カラム(NAP-5)では、附属マニュアルのサンプルのアプライ量は0.5 ml (5 mgタンパク質)、溶出画分の総量は1.0 mlであるが、前半の約0.1 mlと後半の約0.2 mlを除いた約0.7 mlを以後の操作に用いた。この操作を行う際に、ネガティブコントロールとしてタンパク質が溶解している緩衝液と同じ溶液を用意し、同じ操作を行う。
2)タンパク質酸変性を用いた金属イオンの遊離
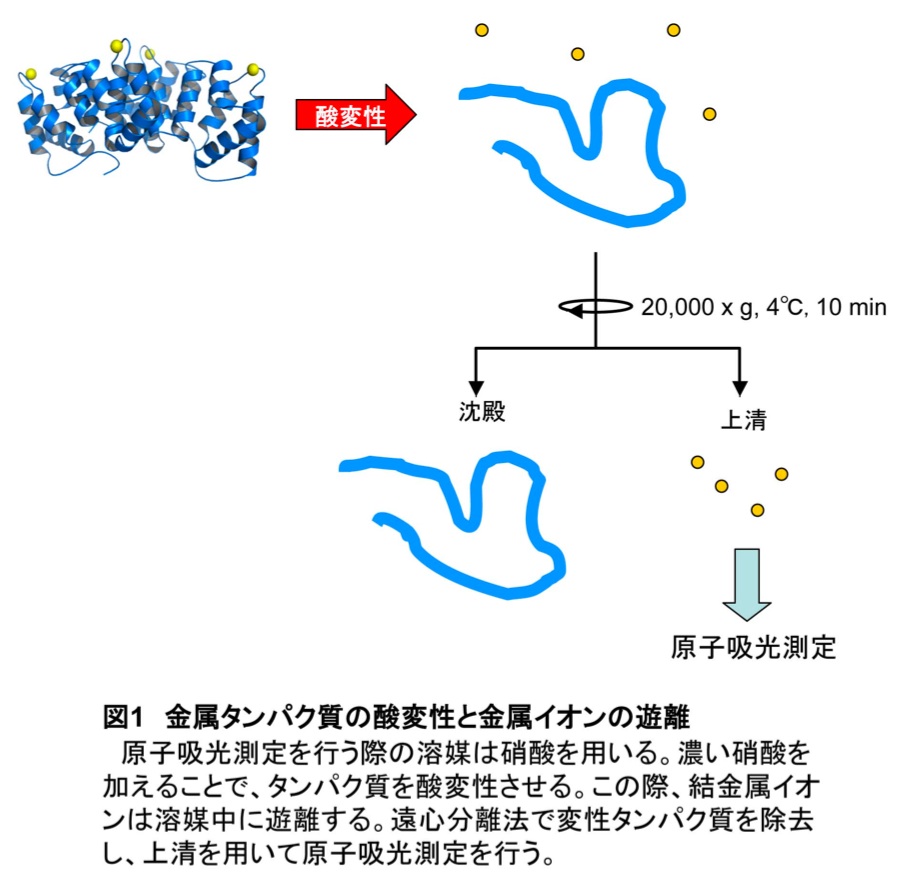
脱塩したタンパク質標品に1 N硝酸を等倍量加え、酸変性させる。18,000 × g、4℃で10分間遠心し、変性タンパク質を沈殿させる。上清を回収し、硝酸最終濃度が0.1 NになるようにMilli Q水で希釈した後、氷上で5分間インキュベートしたものを測定用サンプルとする(図1)。ネガティブコントロール(緩衝液のみを脱塩した標品)についても同様の操作を行う。脱塩されたタンパク質標品についてタンパク質濃度を測定する。著者らはウシ血清アルブミンを用いてローリー法で濃度を決定した。タンパク質濃度の決定法はタンパク質の種類によるので、特に指定はしない。
3)原子吸光装置による測定とデータ整理
測定したい金属イオンの標準液を調製する。金属イオン種ごとに調製が必要である。標準液の調製は0.1 N硝酸に溶解した市販品を用いて、測定したい濃度範囲の濃度を数点選択し、希釈法にて行う。手に付着している金属イオンの混入を防ぐために、これらの作業は必ずゴム手袋を付けて行う。また、測定回ごとに標準液を作製し直すことが大切である。
標準液および測定用サンプルについて、原子吸光装置を用いて目的金属イオンを測定する。ただし、金属イオン種ごとに専用のランプが必要であるので、測定したい原子用のランプがあることを確認しておく。
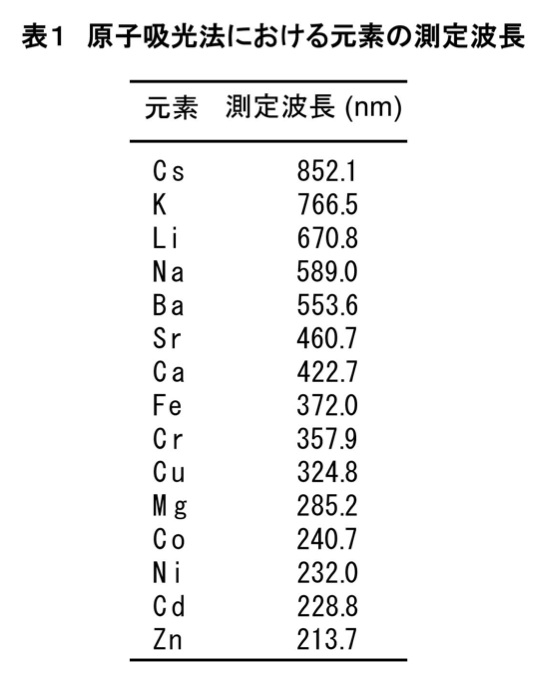
ここで紹介する例では、カルシウム、ナトリウム、リチウム、マグネシウム、カリウムについて測定した。その際に使用した光源の波長は各々422.7、589.0、670.8、285.2、766.5 nmである(表1)。ネガティブコントロールについても同様に測定し、データ整理時のバックグラウンドとして使用する。バックグランドを補正したデータ値を用いて、測定濃度値と理論濃度値の検量線を作成し、未知サンプルの濃度を決定する。
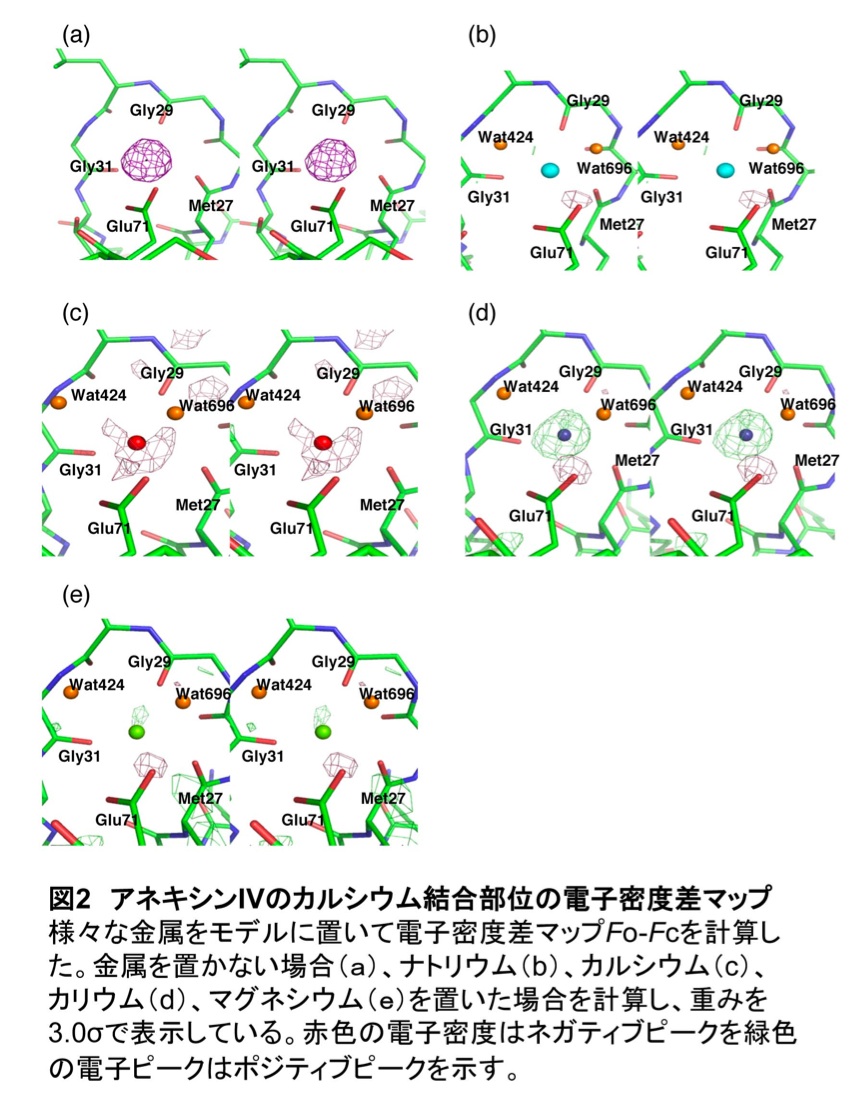
著者らは、カルシウム結合タンパク質として知られるアネキシンIVの結晶構造解析を行った(2)。結晶構造はProtein Data BankにPDB ID 2zhiと2zhjとして登録している。結晶構造を観察した結果、アネキシンIVにはカルシウム以外の金属イオンが結合している可能性が示唆された(図2)(2)。タンパク質の精製過程および結晶化過程で使用した緩衝液中には、金属イオンとしてナトリウム、カルシウム、リチウム、カリウム、マグネシウムが含まれていたため、結合している金属イオンがこれらのいずれかである可能性があった。また、電子密度差マップFo-Fcやリガンドと金属イオンの結合距離から、結合金属イオンがカルシウム、リチウム、カリウムではないことが分かり、ナトリウムである可能性が強く示唆されたが、マグネシウムである可能性も残された(図2)。
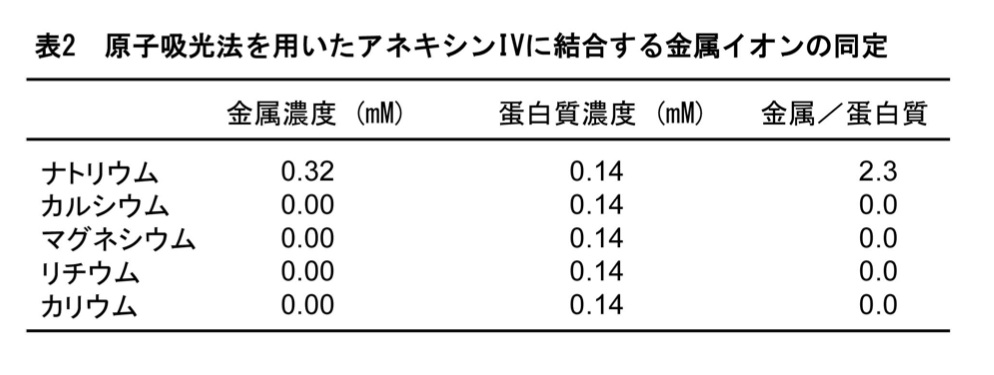
そこでナトリウムイオンの結合を調べるために、上述の原子吸光法による同定を行った。その結果、ナトリウムイオンが結合されていること、マグネシウムが結合されていないことが証明された(表2)。
著者ら以外にも、生体内での役割が鉄の結合と輸送であるタンパク質、オボトランスフェリンにアルミニウムが結合することをX線結晶構造解析と組み合わせて証明した例もある(3)ので参照されたい。
このように結晶構造解析で結合金属イオン種の決定が困難な時には、原子吸光法を組み合わせることで金属イオン種の同定が可能である。特にXAFSによる同定が困難であるナトリウムの結合の証明には有効な方法である。一方で、闇雲に結合金属イオン種を同定する方法としては不適切である。測定には相当量のサンプルが必要であるので、結合している可能性のある金属イオン種に予測がついた上で操作を行うことが大切である。また、金属種の同定は可能であるが、電子状態は決定できないので、電子状態を知りたい場合は別の方法を選択しなければならない。
工夫とコツ
- 金属イオンの混入を防ぐために、金属標準液の調製時はゴム手袋を装着する。
- 測定回ごとに新しい金属標準液を使用する。
- 測定用サンプルは調製後、冷蔵(3日)あるいは冷凍保存(1週間)が可能である。保存期間は目安であり、記載以上の保存も可能であろう。いずれにしても、密封する必要がある。
- カルシウム等の混入を防ぐ目的で、使用する器具はガラス器具を用いない。
- 測定装置は高価である。しかしながら、所属施設で施設内下水処理を行っている施設であれば、下水処理施設が装置を保有している可能性がある。問い合わせて使用を打診してみるだけの価値はあるであろう。筆者らは青山学院大学内の下水処理施設に設置されている装置をお借りした。
- 簡易脱塩カラムを使用する際、サンプルに塩がなるべく混入しないように思い切って溶出画分の後半を捨てる必要がある。後半画分にはタンパク質が含まれているが、確実な同定には不可欠である。また、同時にタンパク質標品と同じ緩衝液を使用して操作を行い、塩の混入がないこと、あるいはネガティブコントロールの値を必ず測定する必要がある。ちなみに、著者らはタンパク質の結晶化条件(50 mM クエン酸ナトリウム、pH 5.9、250 mM 硫酸マグネシウム、200 mM 硫酸リチウム溶液)という高濃度な塩が含まれている条件のタンパク質標品で実験を行った(2)。
- タンパク質を酸変性させる際に、結合金属が共沈する場合がある。従って、この方法のみで結合金属の特異性を述べることはできない。他の方法(今回は結晶構造解析)と併せて総合的に判断する必要がある。
実験の安全
- 高濃度の硝酸を使用するために取扱に注意する。
- 装置の測定部分に炎が出るために、操作中は注意する。
文献
- Koch, M. et al., J. Mol. BIol., 378, 933-42 (2008)
- Butsushita, K. et al., Biosci. Biotechnol. Biochem., in press (2009)
- Mizutani, K. et al., Acta Cryst., D61, 1636-42 (2005)
- 堀洋,蛋白質科学会アーカイブ, 1, e0037 (2008)
概要
タンパク質に結合する金属イオンは生体機能の発現に重要な役割を担う。金属結合タンパク質は分子内に特定の金属種に対する金属結合部位を有している。しかしながら、その金属結合部位に特定の金属種以外の金属を結合することが報告されており、その機能調節、機能非発現時の安定化、疾患の発症につながることが示唆されている。言い換えると、金属タンパク質に結合している金属種の同定は、生体機能発現や疾患発症を理解する上で重要な役割を担うということである。本稿では、金属タンパク質に結合する金属イオンを同定する手法の一つである原子吸光法を紹介する。本同定法は、金属タンパク質に結合する金属イオン種の同定を簡易に行うことが可能であり、直接的かつ信頼性の高い方法である。また、本同定法とX線結晶構造のデータとを組み合わせて、カルシウム結合タンパク質として知られる、アネキシンIVにナトリウムが結合していることを示した例を紹介する。本同定法は目的タンパク質が用意されていれば、調べる金属イオン種の数にもよるが1日足らずで行える簡単な方法である。
イントロダクション
金属タンパク質が、生理活性発現に必要な金属イオンと異なる金属種を結合することはよく知られている(1-3)。その意義は、生理活性に必要な金属を遊離した際にタンパク質を安定化させる(1)、膜との結合/解離の調節(2)などが示唆されている。また、異なる金属を結合することで疾患を誘引する原因となっている可能性も示唆されている(3)。このように、タンパク質にとって生体内機能を維持する上で、金属イオンの結合と結合金属種は重要な意味をもつ。
金属タンパク質に結合している金属イオンの同定には、X線吸収分光(XAFS)法、電子スピン共鳴(ESR)法(4)、電子常磁性共鳴(EPR)法、原子吸光法などが知られている。これらの方法はいずれも長所や短所を持ち合わせている。原子吸光法を用いた結合金属イオンの同定は、異なる結合条件における結合イオンの同定が手軽に行えること、サンプルの調製が簡便であること、データ解析が容易であること、などの点が魅力的である。また、X線結晶構造解析と組み合わせることで、信頼性の高い考察を行うことが可能となる(2)。ただし、この方法のみでタンパク質に金属イオンが特異的に結合していることを示すのは困難である。つまり、あるタンパク質に結合する可能性のあるいくつかの金属イオンについて、本方法を試すことで金属イオン種の同定を行い、総合的に特異的に結合していることを証明する必要がある。
本稿では、実験方法の後半にX線結晶構造の補助的データとして原子吸光法による結合金属イオンの同定を行うことで、カルシウム結合部位を有することが知られているアネキシンIVにナトリウムが結合することを証明した例を紹介する(2)。
装置・器具・試薬
- アセチレン燃焼法を利用した原子吸光装置(各社)
- 簡易脱塩カラム(GEヘルスケア バイオサイエンス社、NAP-5 Colums)
- 冷却遠心機
- ゴム手袋
- 1 N 硝酸
- 各種金属イオン標準液(和光純薬)
- Milli Q水
- 約10 mg/ml タンパク質標品(分子サイズ 36 kDa、金属結合部位 4カ所/1分子)
実験の手順
操作は以下に示す三段階の簡易な操作であり、タンパク質の取扱に不慣れな人でも可能な操作である。
1)タンパク質標品の脱塩
2)タンパク質の酸変性による金属イオンの遊離
3)原子吸光装置による測定
実験の詳細
1)タンパク質標品の脱塩
簡易脱塩カラムを十分量のMilli Q水で平衡化する。簡易脱塩カラムのマニュアルに書かれている容量のタンパク質標品をカラムに通し、緩衝液を取り除くことでタンパク質標品の溶媒をMilliQ水へ置換する。その際、緩衝液中の塩の混入をなるべく避け、タンパク質濃度を下げないようにするため、溶出画分の前半一部と後半一部を除く。例えば、ここで紹介する簡易脱塩カラム(NAP-5)では、附属マニュアルのサンプルのアプライ量は0.5 ml (5 mgタンパク質)、溶出画分の総量は1.0 mlであるが、前半の約0.1 mlと後半の約0.2 mlを除いた約0.7 mlを以後の操作に用いた。この操作を行う際に、ネガティブコントロールとしてタンパク質が溶解している緩衝液と同じ溶液を用意し、同じ操作を行う。
2)タンパク質酸変性を用いた金属イオンの遊離
脱塩したタンパク質標品に1 N硝酸を等倍量加え、酸変性させる。18,000 × g、4℃で10分間遠心し、変性タンパク質を沈殿させる。上清を回収し、硝酸最終濃度が0.1 NになるようにMilli Q水で希釈した後、氷上で5分間インキュベートしたものを測定用サンプルとする(図1)。ネガティブコントロール(緩衝液のみを脱塩した標品)についても同様の操作を行う。脱塩されたタンパク質標品についてタンパク質濃度を測定する。著者らはウシ血清アルブミンを用いてローリー法で濃度を決定した。タンパク質濃度の決定法はタンパク質の種類によるので、特に指定はしない。
3)原子吸光装置による測定とデータ整理
測定したい金属イオンの標準液を調製する。金属イオン種ごとに調製が必要である。標準液の調製は0.1 N硝酸に溶解した市販品を用いて、測定したい濃度範囲の濃度を数点選択し、希釈法にて行う。手に付着している金属イオンの混入を防ぐために、これらの作業は必ずゴム手袋を付けて行う。また、測定回ごとに標準液を作製し直すことが大切である。
標準液および測定用サンプルについて、原子吸光装置を用いて目的金属イオンを測定する。ただし、金属イオン種ごとに専用のランプが必要であるので、測定したい原子用のランプがあることを確認しておく。
ここで紹介する例では、カルシウム、ナトリウム、リチウム、マグネシウム、カリウムについて測定した。その際に使用した光源の波長は各々422.7、589.0、670.8、285.2、766.5 nmである(表1)。ネガティブコントロールについても同様に測定し、データ整理時のバックグラウンドとして使用する。バックグランドを補正したデータ値を用いて、測定濃度値と理論濃度値の検量線を作成し、未知サンプルの濃度を決定する。
著者らは、カルシウム結合タンパク質として知られるアネキシンIVの結晶構造解析を行った(2)。結晶構造はProtein Data BankにPDB ID 2zhiと2zhjとして登録している。結晶構造を観察した結果、アネキシンIVにはカルシウム以外の金属イオンが結合している可能性が示唆された(図2)(2)。タンパク質の精製過程および結晶化過程で使用した緩衝液中には、金属イオンとしてナトリウム、カルシウム、リチウム、カリウム、マグネシウムが含まれていたため、結合している金属イオンがこれらのいずれかである可能性があった。また、電子密度差マップFo-Fcやリガンドと金属イオンの結合距離から、結合金属イオンがカルシウム、リチウム、カリウムではないことが分かり、ナトリウムである可能性が強く示唆されたが、マグネシウムである可能性も残された(図2)。
そこでナトリウムイオンの結合を調べるために、上述の原子吸光法による同定を行った。その結果、ナトリウムイオンが結合されていること、マグネシウムが結合されていないことが証明された(表2)。
著者ら以外にも、生体内での役割が鉄の結合と輸送であるタンパク質、オボトランスフェリンにアルミニウムが結合することをX線結晶構造解析と組み合わせて証明した例もある(3)ので参照されたい。
このように結晶構造解析で結合金属イオン種の決定が困難な時には、原子吸光法を組み合わせることで金属イオン種の同定が可能である。特にXAFSによる同定が困難であるナトリウムの結合の証明には有効な方法である。一方で、闇雲に結合金属イオン種を同定する方法としては不適切である。測定には相当量のサンプルが必要であるので、結合している可能性のある金属イオン種に予測がついた上で操作を行うことが大切である。また、金属種の同定は可能であるが、電子状態は決定できないので、電子状態を知りたい場合は別の方法を選択しなければならない。
工夫とコツ
- 金属イオンの混入を防ぐために、金属標準液の調製時はゴム手袋を装着する。
- 測定回ごとに新しい金属標準液を使用する。
- 測定用サンプルは調製後、冷蔵(3日)あるいは冷凍保存(1週間)が可能である。保存期間は目安であり、記載以上の保存も可能であろう。いずれにしても、密封する必要がある。
- カルシウム等の混入を防ぐ目的で、使用する器具はガラス器具を用いない。
- 測定装置は高価である。しかしながら、所属施設で施設内下水処理を行っている施設であれば、下水処理施設が装置を保有している可能性がある。問い合わせて使用を打診してみるだけの価値はあるであろう。筆者らは青山学院大学内の下水処理施設に設置されている装置をお借りした。
- 簡易脱塩カラムを使用する際、サンプルに塩がなるべく混入しないように思い切って溶出画分の後半を捨てる必要がある。後半画分にはタンパク質が含まれているが、確実な同定には不可欠である。また、同時にタンパク質標品と同じ緩衝液を使用して操作を行い、塩の混入がないこと、あるいはネガティブコントロールの値を必ず測定する必要がある。ちなみに、著者らはタンパク質の結晶化条件(50 mM クエン酸ナトリウム、pH 5.9、250 mM 硫酸マグネシウム、200 mM 硫酸リチウム溶液)という高濃度な塩が含まれている条件のタンパク質標品で実験を行った(2)。
- タンパク質を酸変性させる際に、結合金属が共沈する場合がある。従って、この方法のみで結合金属の特異性を述べることはできない。他の方法(今回は結晶構造解析)と併せて総合的に判断する必要がある。
実験の安全
- 高濃度の硝酸を使用するために取扱に注意する。
- 装置の測定部分に炎が出るために、操作中は注意する。
文献
- Koch, M. et al., J. Mol. BIol., 378, 933-42 (2008)
- Butsushita, K. et al., Biosci. Biotechnol. Biochem., in press (2009)
- Mizutani, K. et al., Acta Cryst., D61, 1636-42 (2005)
- 堀洋,蛋白質科学会アーカイブ, 1, e0037 (2008)