概要
大腸菌を利用した発現系は簡便・安価であり、様々な蛋白質の大量発現に頻用されている。本プロトコールでは組換え蛋白質を T7 プロモーターを利用した系、すなわち BL-21(DE3) 系の大腸菌と pET 系のベクターの組み合わせ、で大量発現させるための標準的な方法を述べる。目的プラスミドによる大腸菌の形質転換から発現した菌体の集菌まで2日間かかる。このプロトコールにより所属研究室ではウシトリプシンインヒビター(分子量 7 K)(1)、数種類の抗体ドメイン(11〜13 K)(2,3)、Pyrococcus furiosus 由来キチナーゼの触媒及び結合ドメイン(11〜35 K)(4,5)、Aeropyrum pernix のチオレドキシンペルオキシダーゼ(モノマーの分子量 28 K で10量体を形成)(6)、マウス Caspase-Activated DNase の CAD ドメイン(10 K)(7) などの発現に成功している。
装置・器具・試薬
- 恒温振とう培養器 3 L 三角フラスコが回転振とうできるもの(各社)
- 遠心機(各社)
- 濁度計(各社)。分光光度計でも可
- オートクレーブ(各社)
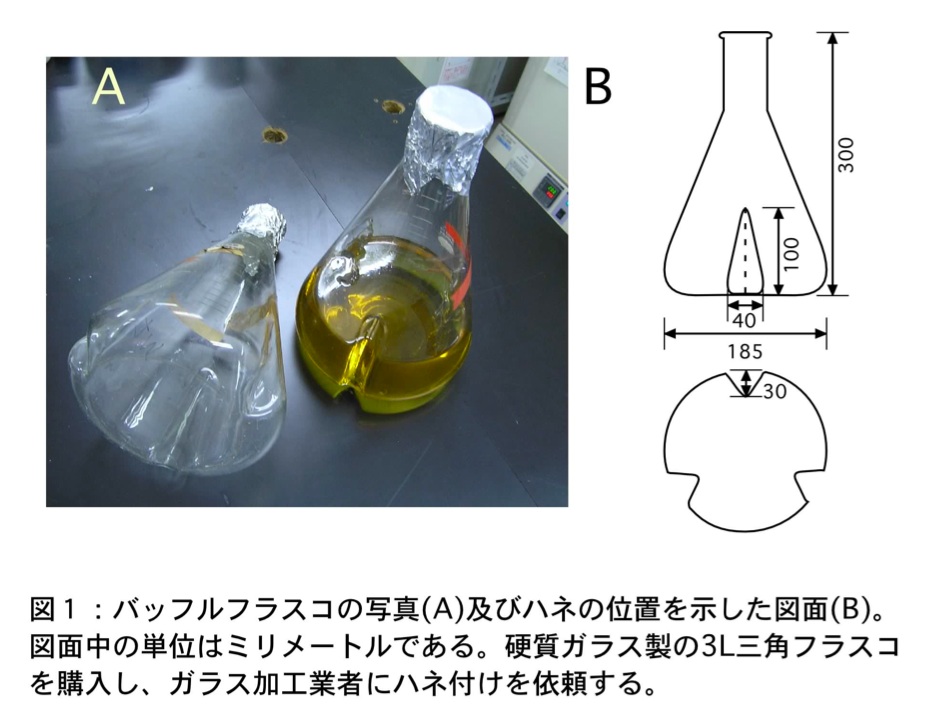
- バッフルフラスコ、3 L、1個(図1)
- 大腸菌 BL-21(DE3) pLysS コンピテントセル(ヒートショック法用)(各社)、20 μL
ここでは BL-21(DE3) pLysS を使用しているが Rosetta 等他の BL-21(DE3) 系の大腸菌も使用可 - LB 寒天培地(各社)100 μg/mL のアンピシリン含む、1枚
- LB 培地(各社)、1.6 L
- SOC 培地、1 mL(2% Tryptone、0.5% Yeast Extract、10 mM \(\ce{NaCl}\)、2.5 mM \(\ce{KCl}\)、10 mM \(\ce{MgCl2}\)、10 mM \(\ce{MgSO4}\)、20 mM グルコース)
- カルベニシリン(各社)、0.5 g
- イソプロピル-β-チオガラクトピラノシド(IPTG)(各社)、1.9 g
- 10%グリセロール、100 mL
実験手順
第1日
- 目的プラスミドの BL-21(DE3) への形質転換
- 培地の作製とオートクレーブ
第2日
- 液体培地への植菌
- 培養と蛋白質発現
- 集菌
実験の詳細
第1日
1. 目的プラスミドによる BL-21(DE3) pLysS の形質転換
ヒートショック法を用いて目的プラスミドにより BL-21(DE3) pLysS コンピテントセルを形質転換する。BL-21 の形質転換効率は低く、充分なコロニー数を得るため 0.1 μg 以上のプラスミドを使用する。エレクトロポレーションで形質転換を行うと pLysS 由来のリゾチームにより溶菌するので注意が必要である。氷上でコンピテントセル(20 μL 程度)を融解後、約 0.05 μg/mL のプラスミドを数 μL 加え、42℃で1分間インキュベートし氷上に1分間静置。SOC 培地を 0.2 mL 加えて37℃で1時間振とうし、アンピシリンを含むプレートに撒く。オーバーナイト(14時間程度を目安)で37℃静置。夕方に形質転換し、午後7時頃にインキュベーター(37℃)にプレートを移すとちょうど良い。
2. 培地の作製とオートクレーブ
大量培養用に培地を 1.6 L 作製する。著者はプレミックスの LB 培地 Lennox(1 L あたりTryptone 10 g、Yeast Extract 5 g、\(\ce{NaCl}\) 5 g)を使用している。作製する培地量に合わせた量を培地専用の家庭用電子天秤で測る。薬品用の天秤を使用しないのは、培地粉が飛び散るためである。測り取った培地は蒸留水や脱イオン水、水道水(可能であるなら湯)で溶解する(工夫とコツ参照)。溶解した培地はフラスコに移し、オートクレーブにより滅菌する。大型オートクレーブ(釜のサイズは 325×635 mm 程度)であれば 3 L のフラスコが4本入る。10%グリセロールも同時に滅菌する。IPTG は 190 mg/mL (0.8 M)を 10 cc 程度作製し-20℃で保存する。IPTG は水に可溶。本培養での抗生物質としてアンピシリンも使用可能な場合も多いが、カルベニシリンは水溶液中でより安定性が高く、蛋白質大量発現には常にこれを使用する様に心がけている。ストック溶液として 100 mg/mL になるように50%エタノールに溶解(10 cc 程度)。-20℃で保管する。50%エタノールが溶媒のため凍結しないのですぐに使えて便利。アンピシリンのストック溶液も同様にして保存している。
第2日
3. 液体培地への植菌
朝一番で以下を行う。オートクレーブから滅菌した培地入りのフラスコを取り出す。37℃以下まで冷めている場合には、ストックのカルベニシリン溶液(100 mg/mL)を培地の1/2000量加える(最終50 μg/mL)。前日に形質転換したプレートにはおそらく100個程度の大きめのコロニーが見られるはずである。このプレートに上記のフラスコから 5 mL 程度の培地を加え、コンラージ棒で全コロニーを懸濁させてから培養フラスコに戻す。フラスコから再び 5 mL 程培地を取り、プレート上を洗って培地をフラスコに戻し、37℃で培養を開始する。
4. 培養と蛋白質発現
培養液の 600 nm 付近の OD が0.7程度になったところで、20 μL 程培地を取り分ける。これは後ほど蛋白質の発現を調べるときのネガティブコントロールとなる。培養液にはストックの IPTG を1/800から1/2000量(最終 1〜0.4 mM)加え、発現を誘導する。その後37℃で4時間程度培養を続ける。エアレーションが悪いと極端に発現量が落ちる場合があり、充分なエアレーション維持のためなるべく高速(約150 rpm)で振とうする。
濁度計を用いる場合には、濁度計の OD と分光光度計での OD とでかなり差がある場合があり、時々校正すると良い。菌数が OD = 0.7 程度というのはあくまで目安であり、発現が良好な蛋白質では菌数に比例して発現量が増える場合もある。目的蛋白質が大腸菌の成長を阻害しない、かつ、形質転換したプレートに充分量(100個程度)のコロニーが見られた場合には BL21(DE3) LysS では数時間で誘導をかけることが可能である。朝の9時過ぎに培養を開始した場合には昼食後3時迄には誘導を開始できる(Rosetta は生育が遅いのでより時間がかかる)。発現する蛋白質によるのだが、誘導が遅れた時には37℃での4時間培養ではなく25℃でのオーバーナイト培養で換えることが出来る場合が多い。また、低温で培養することにより、発現蛋白質が不溶性画分から可溶性画分に移行する場合もあり、目的により誘導後の培養温度を変化させる。IPTG はかなり高価でありこれを節約するために、単一の蛋白質の発現を複数回試みる場合には、IPTG をどの程度減らすことが可能か調べると良い。
5. 集菌
夕方になり37℃、4時間培養が終わったところで、SDS-PAGE で発現を調べるため培地を 20 μL 程取り分け、残りを集菌する。1 L チューブ4本の遠心が可能なローターと遠心機では数Lまでの培養に対応出来る。集菌後の培地は空いたフラスコに入れオートクレーブで滅菌し廃棄する。菌のペレットはまず、プラスチックピペット等で掻き取れるだけ 50 mL のコニカルチューブに移す。いきなり10%グリセロールで懸濁するのはかなり難しい。遠心管に残った菌体は10%グリセロール 10 mL で2回洗い、これらも先ほどのコニカルチューブに入れ、遠心し、菌体を落とす。上清を最初に集菌した遠心管に捨て、コニカルチューブに集めた大腸菌は-20℃で保存する。使い終わった遠心管には水を7分程加えて、115℃、10分間滅菌する。
工夫とコツ
大量発現用には安価な振とう培養器
著者の研究室ではタイテック社の BR-40LF に 3 L の三角フラスコ用のツメクランプを4カ所つけ床置きで使用している。最大 8 L の培養が可能であり、この量を培養できる振とう培養器としてはコストパフォーマンスが高い。
培養用フラスコ
バッフルフラスコは 3 L 硬質ガラス製三角フラスコを購入し、別途業者に依頼しハネ(3枚)加工をしている。ハネの位置、形状については図1を参照して欲しい。
大腸菌用の培地
イーストエキストラクト、ペプトン、\(\ce{NaCl}\) がプレミックスされている培地が各社から市販されている。培地作製がかなり楽になる上に、意外に安価なものもあり、著者の研究室ではプレミックスの培地を愛用している。
プレートを直接かき取り、培地に加える
一般のプロトコールではシングルコロニーから前培養を起こす。そのため前培養が増える迄の時間が余計にかかることに加え、プラスミドを欠失したクローンが増加して蛋白質の発現量が低下する場合がある。一方、全てのコロニーを掻きとって使う手法では液体培地での培養時間が短く、プラスミドが欠失する割合を低く抑えられる。実際、この方法では培養開始後から誘導可能な菌数に至る時間(3から5時間)の再現性は高く、これはプラスミド欠失が少ないためだと考えている。全てのコロニーを用いる場合、心理的には変異の入ったものが混ざるのではないか? と気になる。しかしシングルコローからの前培養を増やす場合でも、前培養を時間が本手法より長くかかっており、変異の入る確率は同程度であろう。
培地の作製は水道水でも可
培地を溶かすために以前は蒸留水を使用していたがこれは高価であり、節約のため水道水を試みたところ大腸菌の成長速度や発現量に顕著な差は無かった。以来水道水を用いているがトラブルは皆無である。水道水には窒素分などの栄養素や鉄分などのミネラルも含まれており、むしろ蛋白質発現に向いているのでは? と思う程である。しかし、季節、地域によって水質にバラツキがあると思われるので厳密な再現性が求められる実験には精製水を用いる。また、水道水では発現がうまくいかない場合もあり得るので、その際は蒸留水などで発現を確認した方が良いであろう。
ある蛋白質について。これは我々の研究室(大阪)ではうまいこと発現するが、共同研究先では作ることが出来なかった。正確にこちらから伝えた実験手順に従っているのだが、何度やってみても目的の蛋白質は発現しない。そこで担当の学生さんが私達のラボまで来て実験をしたところ、一回でうまく行った。驚いた学生さん曰く「水持ち帰ります」。水のせいかどうなのか? 未だ謎ではある。
文献
- Hagihara, Y. & Kim, P. S., Proc. Natl. Acad. Sci. U. S. A., 99, 6619–24 (2002)
- Hagihara, Y., et al., J. Biol. Chem., 280, 24752–24758 (2005)
- Hagihara, Y. et al., J. Biol. Chem., 282, 36489–95 (2007)
- Mine, S. et al., J. Biomol. NMR, 36 Suppl 1, 70 (2006)
- Mine, S., et al., Acta Crystal., F62, 791–793 (2006)
- Nakamura, T., et al., Proteins, 62, 822–826 (2006)
- Uegaki, K., et al., Biopolymer, 79, 39–47 (2005)