概要
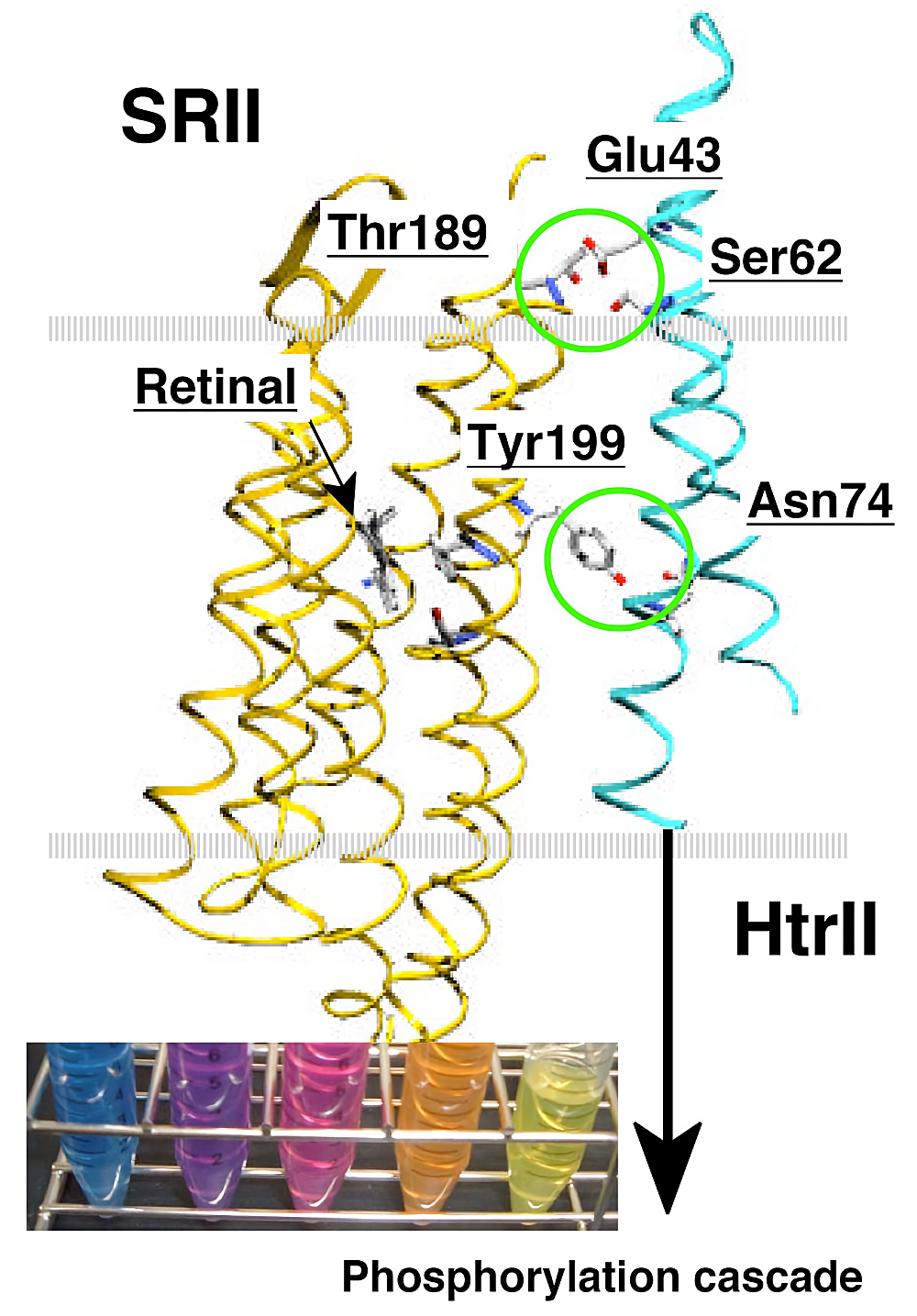
生体膜の基本構造は、リン脂質2分子層であり、細胞が生きていく上で必要な、物質輸送、エネルギー変換、情報変換などが行われる「場」として利用される (1)。細胞膜に存在する膜蛋白質は全蛋白質の30%を占め、膜結合型(膜表在性)蛋白質など膜と関係した蛋白質を含めるとその数はさらに多くなる。膜蛋白質は、その重要性から生命活動を理解するための中心課題の1つとして考えられているが、リン脂質に取り囲まれた蛋白質である性質上、その機能や構造を解析する場合、目的蛋白質を膜から抽出(可溶化)する操作が必要となる場合が多い(バクテリオロドプシンのように、膜中で2次元結晶を形成し、脂質との重量比が70%以上もの高密度に存在する蛋白質などはその限りではない (2))。膜蛋白質は、ペプチド鎖がリン脂質膜を貫通する回数から、○回膜貫通型蛋白質という定義づけがされる。本プロトコールでは、生体内に比較的多く存在し、膜蛋白質研究のモデルとして非常に良く用いられる7回膜貫通型光受容蛋白質(ロドプシン蛋白質)と、多量体(2量体)形成蛋白質として、2回膜貫通型情報伝達蛋白質(Htr)(3,4)(図参照)を例に膜蛋白質の抽出について述べる。ここで最も大事なことは、膜蛋白質の活性を保った状態で抽出することであり、今回取り上げる蛋白質は、活性確認が容易である点から、抽出操作の良いモデルであると考えられる。
装置・器具・試薬
- 遠心機(各社)(例:遠心機:HITACHI-CF15RXII、ローター:T15A41/42)
- 超遠心機(各社)(例:遠心機:HITACHI-CP60E、ローター:P45AT)
- ホモジェナイザー(例:テフロン性ホモジェナイザー T50(テックジャム))
- DNAaseI(各社)
- n-dodecyl-β-D-maltoside(Dojindo)
- n-octyl-β-D-glucoside(Dojindo)
- コール酸(各社)
- CHAPS(各社)
- フレンチプレス(Ohtake)
実験手順
- 大腸菌を用いた膜蛋白質の大量発現
- 細胞の破砕
- 膜画分の調製
- 膜蛋白質の抽出(可溶化)
- 活性確認
実験の詳細
0. 大腸菌を用いた膜蛋白質の大量発現
ここで用いたロドプシン蛋白質(SRII:忌避応答センサー、SRI:誘因応答センサー)と情報伝達蛋白質(HtrI、HtrII)は、大腸菌中(BL21(DE3) 株)でリコンビナントとして発現させることが可能である (5,6)。ベクターは Invitrogen 社の pET21(c)(もしくは pBAD24)に目的遺伝子を制限酵素サイト NdeI 下流に繋げた。蛋白質精製様に His-tag を N 末端に付加してある。オートクレーブ可能な 20 L タンクに 2 x YT 培地(16 g/L-トリプトン、10 g/L-イーストエクストラクト、5 g/L NaCl)を入れオートクレーブにかける。これに前培養 100 mL の菌体を添加し、ユニポンプ(NPK:日本理化学器械)からボールフィルター(505G:粒子番号2番-木下理化学工業)にて空気を連続的に注入し培養する(詳細は参考文献 (7) を参照)。OD660 が0.4になったところで終濃度 1 mM の IPTG(各社)にて発現誘導を行う。ロドプシン類の場合は発色団として all-trans レチナール(シグマ)を終濃度 10 μM になるように添加する。発現誘導の直前に氷上にて18℃まで冷却し、18℃にて5時間程度、発現誘導を行う。PBAD24 ベクターの場合、IPTG の代わりに終濃度0.2%のアラビノースを加える。
1. 細胞の破砕
膜蛋白質に限らず、蛋白質を抽出・精製する際には細胞を破砕する必要がある。集めた大腸菌をバッファー(Tris-Cl, pH 8.0, 5 mM \(\ce{MgCl2}\))に懸濁し、そこにスパーテルで1匙程度(数 mg/1L 培養液)の DNAaseI を入れ、フレンチプレスで菌体破砕する。その際、強さは 1,000 kg/cm2 で、完全に菌体を破砕するために、2回破砕を行う。試料が熱を持つのでこれらの操作は出来る限り氷上で行う。破砕後の菌体を低速遠心(5,000×g、10分程度)で、未破砕菌やデブリを除去する。上清を次の操作に用いる。
2. 膜画分の調製
低速遠心上清を超遠心管の9割以上を満たすように入れ(遠心管が変形するのを防ぐ)、100,000×g(35,000 rpm:例-遠心機:HITACHI-CP60E、ローター:P45AT)以上で1時間遠心分離を行う。上清を注意深く完全に捨てる。膜画分洗浄用として、沈殿成分(膜成分)にバッファーを入れ(SRI 以外は、50 mM MES (pH 6.5), 300 mM NaCl、SRI は低塩で不安定なため、50 mM MES (pH 6.5)、4 M NaCl に懸濁する)、氷上においてテフロン性ホモジェナイザーで懸濁する(最終的に 1 L 培養液由来の膜画分に対し 10 mL のバッファーに懸濁している)。最終的にシリンジ針(テルモ、18G)に通し懸濁終了とするが、黒色の成分は不純物であるため遠心管からホモジェナイザーに移す際に除去する。懸濁の際は、極力泡が入らない様に注意する。我々の用いている蛋白質の場合問題はないが、膜画分調製時や可溶化時に内在性プロテアーゼによる分解が起こることがあるため、安定性保持の観点から、Complete(ロシュ)、ペファブロック(ロシュ)や p-APMSF(各社)などのプロテアーゼインヒビターの添加も検討した方が良い。また、10%程度のグリセロールを添加しておくことで膜蛋白質の安定性が保持される例もある。
3. 膜蛋白質の抽出(可溶化)
膜蛋白質を抽出(可溶化)するために、先の操作で得られた膜画分に界面活性剤を CMC(critical micelle concentration)以上の濃度になるように添加する。DDM の場合は1% w/v、OG の場合も1% w/v で可溶化している。界面活性剤は溶液中で酸化や分解などを起こす危険があるため、粉末として保存時添加するようにしている。可溶化の際に、最も重要なことは、目的蛋白質の活性を保持した状態で取り出すことの出来る界面活性剤を選択することである。全ての膜蛋白質の可溶化に使用出来る万能界面活性剤は存在しないため、試行錯誤を繰り返しながら適した界面活性剤を絞り込んでいかなければならない。私たちは、ロドプシン蛋白質、Htr 蛋白質について、様々な界面活性剤を試したところ、親水部に糖鎖を持った非イオン性界面活性剤(n-dodecyl-β-D-maltoside(DDM), n-octyl-β-D-glucoside(OG), n-nonyl-β-D-glucoside(NG)など)で、最も機能性蛋白質が得られる割合が高いことがわかった (8,9)。この種の界面活性剤はラクトース輸送担体で古くから使用されるなど (10) 成功例が多い界面活性剤として知られている。また、コール酸や CHAPS(3-[(3-Cholamidopropyl)dimethylammonio]propanesulfonate)で可溶化した場合も、活性蛋白質が得られる。大腸菌や好塩古細菌を宿主として発現させた場合だけでなく、小麦胚芽を利用した無細胞蛋白質合成系でも、この傾向が見られることから (11)、蛋白質の性質によるものであると考えられる。
界面活性剤を添加した試料をビーカーに入れ、4℃で30分~1時間程度攪拌する。その際、激しく攪拌し泡がでることが無いように注意する。その後、この溶液を超遠心管に入れ、遠心管の9割以上になるようにメスアップ(SRI 以外は、50 mM MES (pH 6.5), 300 mM NaCl、0.1 % DDM、SRI は低塩で不安定なため、50 mM MES (pH 6.5)、4 M NaCl、0.1% DDM)し、100,000×g 以上(35000 rpm:例-遠心機:HITACHI-CP60E、ローター:P45AT)で1時間遠心分離を行う。得られた上清を次の活性確認やカラム操作等に用いる。
4. 活性確認
膜タンパク質の場合、膜中で機能を発揮することから、膜から抽出(可溶化)した段階でその活性を検出することは困難である場合が多い。私たちが使用しているロドプシン蛋白質の場合、色を持ち、変性した場合黄色を呈することから活性確認が容易である(図参照)。2回膜貫通型蛋白質である HtrI 及び HtrII は、その活性を対応する光センサー SRI、SRII との相互作用で評価している。相互作用は、SR と Htr の複合体形成依存的光反応の変化 (12)、蛋白質安定性の変化 (13)、FTIR(furrier transform infrared)の信号変化 (14)、ITC(isothermal titration calorimetry)や NMR を用いた定量的なアッセイ (15)によって確認している。HtrI と HtrII は生体内では2量体として機能しているが、HtrII の場合、界面活性剤中では単量体として存在している (16)。しかしながら2量体時と同様の部位で相互作用すること 4) から活性を保持しているものと考えられる。一方、HtrI は2量体を形成するにもかかわらず SRI との相互作用能を有さず、脂質に再構成した場合にのみ相互作用能を獲得する(未発表)。このように2量体形成と活性には必ずしも相関が無く、相互作用蛋白質の存在や脂質への再構成によって活性を取り戻すこともあること、また HtrII は SDS で可溶化し変性した状態でも巻き戻しが可能である(未発表)など、根気強く様々な条件で抽出(可溶化)を試みることが必要であると考えられる。
工夫とコツ
フレンチプレスを用いる理由
筆者が米国でポスドクをしていた際にはフレンチプレスがなかったため、超音波により破砕を行っていたが、局所温度の上昇による蛋白質の変性や、脂質成分の酸化を回避するため、蛋白質のロスよりも機能保持を優先して短時間ですませるようにした方が良い。フレンチプレスでも温度上昇が起こるので、前もって試料やフレンチプレス用のピストンを冷やしておくか、低温室で操作をすると良い。
超遠心後の膜画分
超遠心の上清を捨てる際に、半透明の成分が膜に寄り添うように付着していることがある。筆者が用いている蛋白質は、可視部に吸収を持つ(色がある)ため、この成分にも目的蛋白質があることがわかる。内在性の膜可溶化成分により、やや可溶化した蛋白質であると考えており、蛋白質の種々の性質は本来のものと全く同じであったが、念のため除去した方が良いと考えている。また、結晶化を考えた場合、リン脂質成分を含めたサンプルの単一性を重視するので、やはり除去した方がよいかもしれない。
界面活性剤選択と CMC
目的蛋白質に適した界面活性剤を選択するために、少量で多種類の界面活性剤をそろえたスターターキットが様々な会社から発売されているので、それを用いるのも一つの方法である。CMC は各種界面活性剤を取り扱う会社のカタログやホームページに記載されている。注意したいのは CMC がバッファーの条件、特に塩強度によって変化する点である。
n-dodecyl-β-D-maltoside(DDM)
我々はこの界面活性剤を好んで用いているが、SRII を Anatrace(特に sol. grade)の DDM で可溶化した場合に、これまでとは異なる光反応を示すことがある。海外のグループからも同様の現象を聞いており、吸収波長や SDS-PAGE 上でのバンドに大きな違いはないが、Dojindo の DDM を用いることにしている。また、念のため親水部に糖鎖を持った非イオン性界面活性剤についても Dojindo の製品を用いている。
可溶化時間
ものの本や論文では、オーバーナイトで可溶化すると書いてあることも多いが、筆者の経験では1時間以内での比較的短時間の可溶化が、活性蛋白質を得るのに適している。
文献
- 榎本 和生, 梅田 真郷, 蛋白質核酸酵素増刊 46, 798–805 (2001)
- 山崎 洋一, 神取 秀樹, シリーズニューバイオフィジックス II 第3巻, 109–123, 共立出版 (2000)
- 須藤 雄気, 生物物理 46, 330–335 (2006)
- Sudo, Y. and Spudich, J.L., Proc. Natl. Acad. Sci. USA 103, 16129–16134 (2006)
- Sudo, Y. et al., Biophys. J., 83, 427–432 (2002)
- Sudo, Y. et al., J. Mol. Biol., 357, 1274–1282 (2006)
- 須藤 雄気ら, 遺伝子医学 MOCK 別冊「図・写真で観るタンパク質構造・機能解析実験実践ガイド」, 41–46 (2005)
- Kandori, H. et al., Biochemistry 40, 9238–9246 (2001)
- Sudo, Y. et al., Biophys. J. in press (2008)
- Newman, M.J. et al., J. Biol. Chem. 256, 11804–11808 (1981)
- 須藤 雄気ら, 実験医学 23, 1933–1937 (2005)
- Sudo, Y. et al., Biochemistry 43, 13748–13754 (2004)
- Sudo, Y. et al., J. Biol. Chem., 281, 34239–34245 (2006)
- Sudo, Y. et al., J. Biol. Chem. 282, 15550–15558 (2007)
- Sudo, Y. et al., Biochemistry 44, 6144–6152 (2005)
- Klare, J.P. et al., J. Mol. Biol. 356, 1207–1221 (2006)