バイパラトピック抗体の合理的設計に向けて
1京都大学・大学院薬学研究科、2医薬基盤・健康・栄養研究所- 秋葉宏樹, 蛋白質科学会アーカイブ, 16, Essay 12 (2023)
- https://www.pssj.jp/archives/essay/Es_12/Es_12.html
このたび日本蛋白質科学会若手奨励賞優秀賞をいただきまして大変光栄に存じます。私は分析化学から研究の道を始め、学位取得後に蛋白質の世界に飛び込みました。現在は抗体創薬科学に蛋白質科学の面から貢献するために日夜奮闘しております。
若手奨励賞の対象研究は、TNFR2 を標的とするバイパラトピック抗体の合理的設計に向けた研究です (1)。本エッセイではこの研究に取り組んだ背景と概略、蛋白質科学の側面からの抗体創薬への貢献について考えることを述べたいと思います。
この研究は私が2016年に医薬基盤・健康・栄養研究所(医薬健栄研)創薬デザイン研究センター(CDDR)に加わり、抗体最適化研究に携わったことに始まります。AMED 創薬総合支援事業(創薬ブースター)では、アカデミアシーズを創薬につなげることを目的として、シーズに対する医薬品候補化合物の創製を進めています。医薬健栄研は、創薬ブースターの発足当初から、医薬健栄研の優れた技術を創薬ネットワーク構成機関として提供しており、CDDR は主に抗体・核酸等バイオ医薬品候補の創出と最適化の技術支援を担っています。このような背景の下、私に与えられた課題は、「抗体の医薬品としての機能を高度化するために、新しい技術を開発すること」でした。
抗体医薬品の高度化は近年目覚ましい進歩を遂げています。この中でも、二重特異性抗体は2つの標的分子への同時結合により、単独の標的分子に結合する通常抗体とは全く異なる機能をもたらします。典型的なのが T 細胞抗原と腫瘍抗原に結合するタイプの二重特異性抗体であり、これらは2つの細胞間を架橋することでT 細胞に腫瘍細胞を攻撃させ、通常抗体とは違う形で抗腫瘍効果をもたらします。もう1つの主要技術は抗体薬物複合体(ADC)であり、低分子化合物のコンジュゲート(複合)化により、抗体の免疫機能とは異なる薬理効果を引き起こすことができます。このような基盤技術の中で、私は、二重特異性抗体の一種である「バイパラトピック抗体」に着目しました。
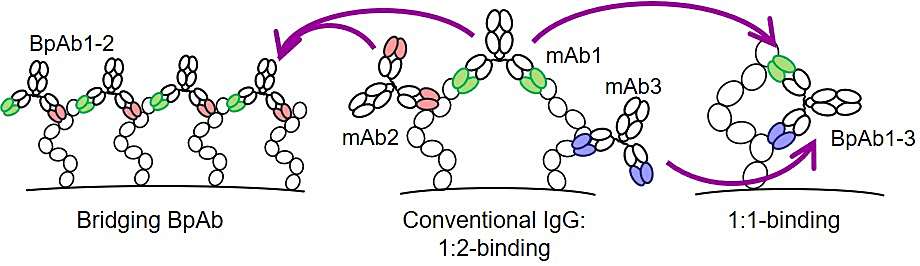
バイパラトピック抗体(BpAb)とは、抗原の異なる2つのエピトープに結合する抗体可変領域をもつ分子です。通常抗体は同一エピトープに結合する可変領域を2つ有し、標的抗原分子とは原理的に抗体:抗原=1:2の複合体を形成します。一方で、BpAb は、異なるエピトープに結合するという特性から、通常の抗体とは形成しうる複合体の構造が異なります。2つの可変領域を1つずつ有する最も単純な BpAb の場合、抗原の2つのエピトープが2つの抗体可変領域と結合する状態をとることが可能であるため、特徴的な複合体を形成することができます(図1)。この性質から、抗原分子表面において抗体の結合面積が約2倍となるので、結合能の向上を含め、従来型抗体の能力を高めることが期待できます (2)。
特に重要なのが、2つのエピトープに2分子の BpAb が結合し、分子間架橋することで巨大複合体が形成されるという性質で、このような複合体は、可溶性標的であればファゴサイトーシス促進 (3)、膜標的であれば細胞膜上での受容体密度変化に伴うシグナル活性化・不活性化やエンドサイトーシス促進といった (4–9)、従来型抗体の形成する複合体にはみられない生命現象を引き起こすことがあります。このような性質を示す BpAb は医薬品シーズとして有望です。
既に BpAb には開発例が複数あります。主要な腫瘍標的である Her2 は乳がんや胃がん等に高発現する抗体医薬品標的ですが、これに対する通常型の抗体として、Trastuzumab に始まる複数の抗体医薬品が承認されています。一方で、Her2 は異なるエピトープに結合する Pertuzumab と Trastuzumab の併用により有効性が高まることが知られ、複数のエピトープを同時に標的とすることに合理性を示すため (10)、Her2 を標的とした BpAb の開発が早くから進んできました (4,11–13)。このほかに SARS-CoV-2 ウイルス S 抗原に対してもウイルス抗原の変異による耐性を克服する設計として、BpAb が開発されていました(引用例は有効性を示せずに既に開発中止となっています)(14)。また、NAD 減少に伴う自己免疫疾患等の治療を目的として、CD38 の酵素活性阻害を狙った BpAb の開発例もあります (15)。
一方で、BpAb には(少なくとも公知情報レベルでは)あまり明確な設計指針が報告されていません。医薬健栄研 CDDR には、「エピトープ均質化抗体パネル」とよばれる、抗原分子表面を網羅する抗体探索法があります (16)。この方法を利用すると、標的抗原に対して、最小限の試行回数で多様な BpAb を取得し評価することができます。したがって、この方法を利用することで、BpAb 設計指針の提案が可能なのではないかと考えました。
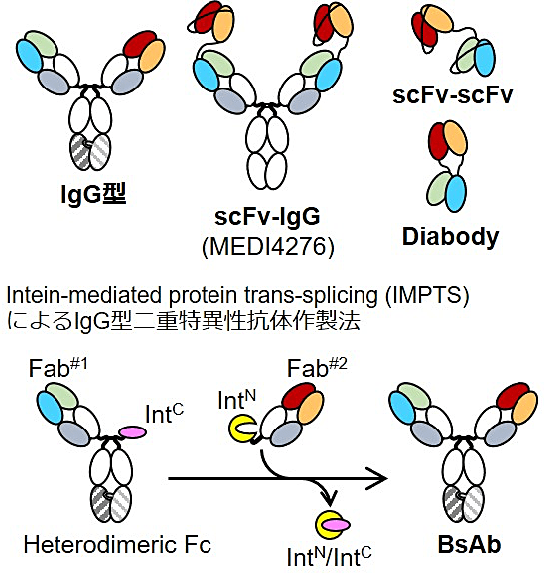
これを目指すにあたり最初に取り組んだのは、BpAb スクリーニング法の確立に必要な、以下の性質を満たす二重特異性抗体作製法の最適化でした。たとえば MEDI4276 のように (4)、2種類の可変領域を2つずつ有する BpAb では、どの可変領域が同時に抗原結合するか推定が困難です。次に、抗原抗体間の相互作用と無関係な性質による影響を最小化する必要があります。たとえば scFv-scFv や diabody は各可変領域のフォールディング安定性の影響が取得可能性に大きく影響するため、エピトープの性質を指標とした網羅的スクリーニングが困難です。この2つの条件からは、IgG 型の二重特異性抗体をとることが望ましいと考えました(図2)。
そこで、近年報告された intein-mediated protein trans-splicing(IMPTS)を利用した二重特異性抗体作製法を最適化して利用する方針としました(図2)。IMPTS は C-intein に融合されたペプチド鎖と N-intein に融合されたペプチド鎖を還元下で混合すると、触媒的にペプチド鎖置換反応が生じ融合蛋白質が作製される方法です。2つの可変領域の一方を Fc ならびに C-intein と融合、もう一方は N-intein と融合することで、IgG 型二重特異性抗体を作製することができます (17–19)。この手法の利点は4つあります。第1に、2つの可変領域を別々に発現・取得できるため、重鎖-軽鎖が正しいペアを形成したものだけが得られることです。第2に、それぞれのパーツの取得スケールを自在に操作できるため、フォールディング安定性等に起因する発現効率が最終品の純度に影響しない点です。第3に、アフィニティ精製とサイズ排除クロマトグラフィーのみで精製が完了するため、ラボスケールの取得であれば精製条件検討がほぼ不要であることです。最後に、理論的に同一可変領域を2つもつ通常 IgG 型の副生成物が生じないため、その排除に細心の注意を払う必要がないことです。通常 IgG 型抗体が混入すると、BpAb 独自の複合体形成能をかく乱し、活性評価に致命的な影響を与えるため、この性質はかなり重要です。私は、これらの特性を最大化しつつ、発現時の一様性、精製法を最適化するための構造改変を実施し、従来法と同等の取得効率を示しながらも構造的な対称性の高い IgG 型二重特異性抗体を取得する方法を確立しました (19)。この手法は精製・取得プロセスの 1 mg を超えるスケールアップが困難であるために、抗体製造には不向きであるものの、少量多品目を高純度で得る方法として有用です。
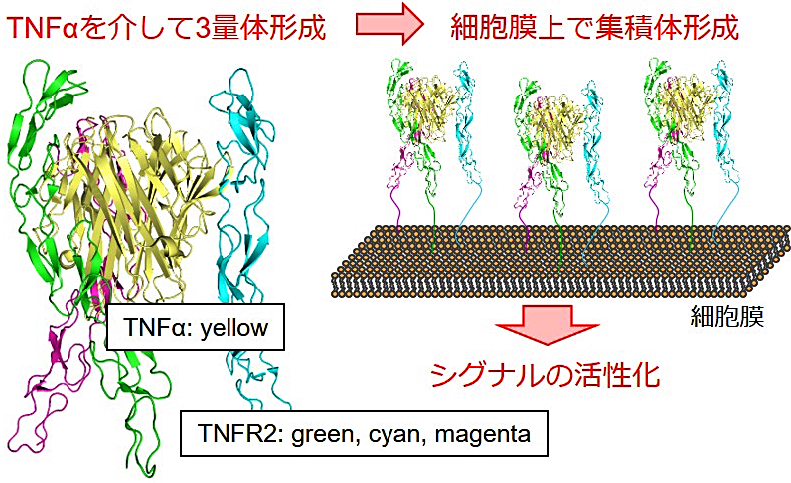
取得法が確立されたところで、BpAb 設計に向けた検討を開始しました。理想的な標的の1つとして選択したのが tumor necrosis factor receptor 2(TNFR2)です。TNFR2 は主に制御性 T 細胞に発現し、そのシグナルが発現細胞の活性化に寄与するといわれています。この機序から、アゴニストは自己免疫疾患や移植片対宿主病の治療に、アンタゴニストは腫瘍免疫の活性化を通じたがん治療に寄与すると期待されています (20,21)。重要なのが活性化メカニズムであり、3量体リガンドである TNFα との複合体形成による3量化を起点に、細胞膜上でクラスター形成し活性化することが知られています(図3)(22,23)。このような活性化メカニズムは BpAb に特徴的な巨大複合体形成とよく一致しているため、設計指針の研究に最適ではないかと考えました。
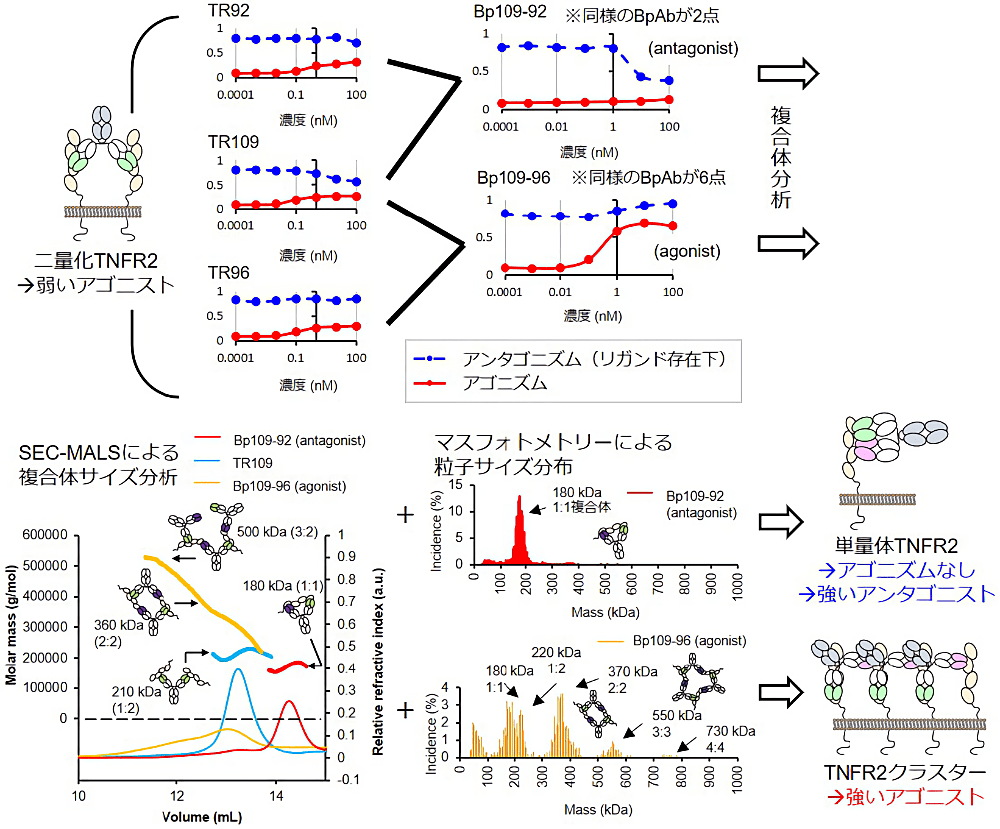
実際にエピトープ均質化抗体パネルにより見出された抗 TNFR2 抗体群の中から5抗体を選抜し、10点の BpAb の生物活性を評価したところ、通常抗体よりもすぐれたアゴニスト活性を示す BpAb が6点、すぐれたアンタゴニスト活性を示す BpAb が2点得られました(図4)。通常型の抗体はいずれも TNFR2 の2量化に由来する、低レベルのアゴニスト活性を示しますが、特にすぐれたアンタゴニスト BpAb はこの活性を抑制することで得られており、アゴニスト活性レベルが重要であることがわかります。
BpAb の分子間架橋能がこの活性を制御していることが推定されたことから、分子間架橋能を、抗原抗体複合体のサイズ排除クロマトグラフィー・多角度光散乱(SEC-MALS)によって評価しました。MALS は光散乱強度の角度依存性から分子量を算出する方法で、SEC による分離を行うことでこれを分布情報として得ることで、広い分子量範囲にわたって、共有結合の有無にかかわらず比較的高精度に高分子粒子の分子量分布が得られる方法です。同様の評価は分析超遠心法などでも実施されており、いずれも BpAb の評価法として一般的です (3,4,8,9)。本研究は多数の BpAb の詳細評価を通じた設計指針研究を目的としていますが、SEC-MALS は統計的な扱いが可能なデータが短時間で得られるので、多品目の網羅評価にも適しています。実際に本研究において複合体のサイズ分析を実施したところ、通常抗体は想定通りに抗体:抗原=1:2の複合体に相当する分子量を示しました。強いアゴニスト BpAb は 2:2 よりも大きい複合体にわたる分布を示す一方で、アゴニスト活性が弱まり、アンタゴニストとなる BpAb は 1:1 複合体のみを形成しました(図4)。すべての通常抗体、BpAb を同様に評価したところ、アゴニスト活性の高さと複合体サイズに強い関係があることがわかりました。網羅的評価を行うことで、メカニズムベースで設計指針を展開するための素地を作ることができました。
この結果を補完するのがマスフォトメトリー法による単粒子解析です。マスフォトメトリー法は、ガラス表面での散乱光の反射光との干渉を観測することで、表面に吸着した粒子の分子量を単粒子レベルで精度よく決定できる方法です (24)。実際にいくつかのBpAbについて、複合体の分子量分布を計測したところ、アゴニストは 2:2、3:3、4:4 の複合体、つまり2つの可変領域が抗原と同時結合した状態を優先的に形成することを明らかにしました(図4)。SEC-MALS を含めて粒子分布測定系は高分子やバイオ医薬品のクオリティ分析に使われることが多いですが、BpAb の場合には作用機序分析にこれらの物理化学的測定系を併用することが極めて有効です。
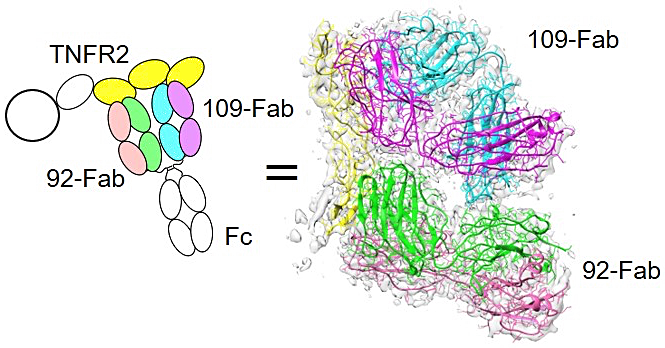
アンタゴニスト Bp109-92 が 1:1 の複合体のみを形成したことで、複合体の構造決定が可能になると考えました。糖鎖をもたない組換え TNFR2 の取得に難航したことから、結晶構造解析は難しいと考え、クライオ電子顕微鏡単粒子解析による構造決定を進めました。単独 Fab を用いた場合、あるいは Bp109-92 の F(ab′)2 を用いた場合には良好なクライオ条件が決定できなかったものの、Fc をもつ全長 Bp109-92 を利用し、また TNFR2 を MBP fusion とすることで、凝集しないクライオ条件を見出すことができ、複合体構造を 3.69 Å の解像度で決定することができました(図5)。天然リガンドである TNFα 結合領域に対して、2つの Fab が互いに接触する位置で結合し、安定な 1:1 複合体構造を形成できることが明らかとなりました。また、変異体解析によって、決められたエピトープの位置が正確であることも示されました。他の抗体も含めたエピトープ位置の情報を総合すると、BpAb を構成する2つの抗体の可変領域が認識するエピトープの相対位置によって、IgG 型抗体そのものの構造的制約と相まって、アゴニスト活性が制御されることを明らかにしました。
本研究で得られた BpAb は出願特許を導出し、実用化に向けた開発を進めています。このほかに、複数の標的に対する BpAb の開発研究に着手しており、自身の取り組みから創薬科学に貢献すべく奮闘しております。何とか、当初の課題であった「抗体医薬品実用化に必要な新しい技術の開発」に一歩ずつ近づいていると感じています。さらには、BpAb に関して獲得してきた知見を利用して、これまでの蛋白質工学とは異なる視点からの分子改変への取り組みも開始しております。
現在、京都大学薬学研究科と医薬健栄研は、組織間の連携によって新たな創薬分野を開拓する「未踏創薬」の取り組みを進めています。私は2020年から、両機関のクロスアポイントメントにより連携研究に携わっています。この中では、BpAb デザイン研究を多角度のアプローチと融合させることで、新たなサイエンスの開拓を狙っています。本研究では、実用化に向けて走って行く中で融合研究への「寄り道」をすることで偶然見出された知見から構造解析の成功に至りました。新しい風を吹き込むことで、継続的アプローチそのものも活性化されるということが、学術研究の面白さであると感じています。
最後に、私自身がこの研究に取り組んだことで感じた、蛋白質科学者がアカデミアの抗体創薬にどのように貢献できるかという点をお伝えしたいと思います。蛋白質科学といっても多様ですが、私の場合は学位取得後から2020年まで東京大学・津本浩平教授(2016年より医薬健栄研併任)の下で研究に取り組み、物性物理化学を主に、蛋白質工学を副次的な専門として身に着けてきました。本研究では二重特異性抗体としての最適化やメカニズム研究における評価法の開拓、構造解析に向けた最適化など、蛋白質科学の経験がなければ実現できなかったことは多岐にわたります。アカデミア創薬では企業ほどに分業が進んでいないために、研究の位置づけ次第ですが、自らの裁量で扱う部分が大きく、個々の研究者の経験に基づく「勘」が研究展開に大きく影響するように思います。私は、蛋白質科学者としての特性が、蛋白質分子を1分子ないし最低分子数のユニットからなる「粒子」として扱うことにあるのではないかと感じています。これは計算・実験両面の熱力学の側面からの現象理解にも、精密構造解析にも通底しています。この扱い方そのものが、BpAb という創薬モダリティには最も適切な「勘」であったことを強く感じています。同様の考え方は、抗体を改変して医薬品とするあらゆる場面で必要になります。単に専門性を「構造解析」「相互作用解析」などの一手法として位置づけることなく、蛋白質科学者としてのプライドをもって、創薬科学の世界を切り開いていきたいと私は考えていますし、本会所属の若手の皆様にも感じていただきたいと思っています。
謝辞:本稿を執筆するにあたりまして、医薬健栄研の鎌田春彦プロジェクトリーダー、京都大学薬学研究科の大野浩章教授には多大なるご助言をいただきました。ありがとうございます。また、両先生をはじめとした現所属の皆様には大きな支援をいただき、御礼申し上げます。本研究は医薬健栄研 CDDR において、津本浩平センター長、永田諭志プロジェクトリーダーと共に始めた研究であり、両先生をはじめとした共同研究者の皆様に御礼申し上げます。特にクライオ電子顕微鏡による構造解析については大阪大学藤田純三先生、難波啓一先生をはじめとした皆様にお世話になりました。また、マスフォトメトリー法に関してはレフェイン志波公平様のご支援を頂きました。ここに御礼申し上げます。
文献
- Akiba, H. et al., bioRxiv doi: 10.1101/2022.12.15.520217 (2022).
- Akiba, H. & Tsumoto, K., Translat. Regulat. Sci. 2, 1–6 (2020).
- Kasturirangan, S. et al., J. Biol. Chem. 292, 4361–4370 (2017).
- Li, J. Y. et al., Cancer Cell 29, 117–129 (2016).
- Tamaskovic, R. et al., Nat. Commun. 7, 11672 (2016).
- Yang, Y. et al., MAbs 11, 996–1011 (2019).
- Stefano, J. E. et al., J. Biol. Chem. 295, 18379–18389 (2020).
- DaSilva, J. O. et al., Clin. Cancer Res. 26, 1408–1419 (2020).
- Kast, F. et al., Nat. Commun. 12, 3790 (2021).
- De Santis, R., MAbs 12, 1725346 (2020).
- Meric-Bernstam, F. et al., Lancet Oncol. 23, 1558–1570 (2022).
- Xu, J. et al., Eur. J. Cancer 178, 1–12 (2023).
- Pegram, M. D. et al., Mol. Cancer Ther. 20, 1442–1453 (2021).
- Rothenberger, S. et al., Nat. Biotechnol. 40, 1845–1854 (2022).
- Ugamraj, H. S. et al., MAbs 14, 2095949 (2022).
- 近藤裕郷ほか、特許公開番号 WO2018/092907 (2017).
- Han, L. et al., Methods 154, 32–37 (2019).
- Hofmann, T. et al., MAbs 12, 1731938 (2020).
- Akiba, H. et al., Sci. Rep. 11, 19411 (2021).
- Faustman, D. & Davis, M., Nat. Rev. Drug Discov. 9, 482–493 (2010).
- Bai, J. et al., Front. Immunol. 13, 844931 (2022).
- Mukai, Y. et al., Sci. Signal. 3, ra83 (2010).
- Vanamee, E. S. & Faustman, D. L., Cells 9, 764 (2020).
- Young, G. et al., Science 360, 423–427 (2018).