タンパク質デザインによる機能性 2D バイオマテリアルの創生および今後の展開
京都大学・白眉センター- 鈴木雄太, 蛋白質科学会アーカイブ, 12, Essay 09 (2019)
- https://www.pssj.jp/archives/essay/Es_09/Es_09.html
この度は、第19回日本蛋白質科学会年会・第71回日本細胞生物学会大会 合同年次大会におきまして、若手奨励賞優秀賞および The EMBO Journal Award を頂き、大変光栄に思います。
本会若手奨励賞シンポジウムにおいては、タンパク質デザインにおける2次元集合体の設計、機能性の解明、およびアプリケーションに向けた研究成果について報告をさせて頂きました (1-3)。
近年、タンパク質を人工的にデザインすることで、本来の機能の向上に加え、新規機能の獲得や高次元構造体の創生を目指した研究が盛んに行われています。2018年には指向性進化法を用いた手法において、カリフォルニア工科大学の Frances Arnold 教授がノーベル賞を受賞したのは記憶に新しいことかと思います (4-6)。また、ワシントン大学の David Baker 教授らは、計算科学を用いることで人工酵素の設計 (7-8) から、タンパク質の集合体形成 (9-12) へと研究を発展させています。そのほかにも、フュージョンタンパク質を用いた集合体形成や金属結合を介した人工酵素の設計・集合体形成など、世界中で積極的に取り組まれている研究テーマであり、数多の研究成果が報告されています (13-21)(図1, 2参照)。
私自身が、2013年にカリフォルニア大学サンディエゴ校(UCSD)Akif Tezcan 教授の研究室にてポストドクターとして研究を始めた頃、既に当該研究室において金属結合を介した人工タンパク質 2D シートの作成に成功していました(図2c)(19)。そのため、所属した当初、私はこのマテリアルを用いたアプリケーション開発を目指し、応用研究に取り組んでいました。グラフェンをはじめとするこれら 2D マテリアルは構造・電子的にユニークな物性を持つことから、電子部品や医療など幅広い分野において応用が大いに期待されています。特に、ネイティブな状態で既に様々な機能・構造を保有しているタンパク質を基盤とした 2D マテリアルは、ナノスケールでの制御が可能であることから、多くの可能性を秘めていると考えられます。
しかしながら、2013年に Tezcan 教授の研究室で採用されていたデザイン(図2c)(19) を始め、当時報告されていた 2D マテリアル作成におけるタンパク質デザイン(図2a, b)(11,15) では、タンパク質構造の複雑性から、それらを制御する場合、タンパク質-タンパク質相互作用を1から人工的に設計するため、複雑かつ高度なデザインが必須となっていました。そのため、応用・拡張性を考慮した際、これらのデザインを 2D マテリアル作成の基盤技術とすることが難しい状況でした。先述したタンパク質 2D シートでの試みにおいても、構造体形成に必須となる金属結合部位が原因となり、基盤となるタンパク質への改変が大きく制限されてしまうという課題点がありました。そこで、私は新たに、より現実的な応用発展に適した全く新しい基盤となる、これまでに報告のない人工 2D タンパク質集合体のデザインに着手することとしました。
まず私は、これまでのタンパク質デザインの課題となっている点を克服するために、「タンパク質の特徴を最大限生かし、極力自然に逆らわないシンプルなデザイン」というコンセプトを提唱しました。これは、タンパク質の対称性に着目し、正方形の4量体タンパク質(C4 対称)の角にコネクター(Cysteine)となる天然アミノ酸を配置する極めてシンプルなデザインです(図3a, 4a)。このデザインをもとに研究を進めた結果、マイクロスケールにおいて欠損のない均一なタンパク質 2D シートの作製に成功しました (1)。図1上段の TEM 画像に示している ~ 2 μm × 2 μm の 2D シートは、約82000個のタンパク質(7 nm × 7 nm)が、自ら規則正しく結合し完璧に配列することで形成されており、その一部分をとらえた高倍率画像からもこの配列は見てとることができます。さらに、コネクターの変更(図3b, 4b)やこれまで難しかった基盤となるタンパク質の改変(基盤自体の改変(図3c, 4c)および酵素やペプチドタグの付与 (3))を可能としたことにより、構造の異なった 2D シートの作成に成功し、このデザインの潜在的な発展・応用の可能性を見出しました。
また、このデザインで得られた 2D シート構造(図3a, 4a)の詳細を調べていくと、様々な構造状態を取ることが確認されました(図5)。これは、Cysteine による結合の柔軟性が反映された、2D シート構造の開閉状態であることがわかり、このフレキシブルな状態変化は「沈殿(閉)⇄ 攪拌(開)」により制御可能であることを発見しました。さらに注目すべきは、この開閉可能な構造は Auxetic と呼ばれる性質を示しており、図に示す様に、外部からの衝撃を効果的に吸収できることから、ナノレベルでの衝撃吸収デザインへの応用が期待されます。また、基盤となるタンパク質に更なるデザインを加えることで、この開閉状態の駆動を制御することにも成功しています (2)。
現在のタンパク質デザインの多くは、集合体形成の構築および機能創出のどちらか一方に留まっています。本デザインも「構造」の作成から始まり、サンプルの詳細な解析により「機能」の発見・獲得・その後の制御デザインに繋がっています。一方、自然界では多くのタンパク質が「構造」と「機能」双方の役割を担うことで共存しています。タンパク質科学の研究者が、タンパク質の「構造」と「機能」双方の役割を自由にデザインできる様になれば、医薬・バイオテクノロジーなどの分野への応用を可能とし更なる発展に繋がると考えています。今後、私は本受賞研究において取り組んできた独自の「シンプルかつ合理的なデザイン」をさらに進化・発展させることで、「構造」と「機能」双方の制御を可能とした全く新しいタンパク質デザイン工学の確立を推進していきたいと考えています。さらに、得られる知見をもとに作製した機能性タンパク質集合体を組み合わせることで、将来、多くの分野で活躍が期待できる「必要な機能を必要な時、自発的に発動することができるバイオナノロボット」の創生を目指し研究を推進していきます。
文献
- Suzuki, Y. et al., Nature, 533, 369–373 (2016).
- Alberstein, R., Suzuki, Y. et al, Nat. Chem., 10, 732–739 (2018).
- Tezcan, F. A. & Suzuki. Y. PCT: WO2017011705A1, January 2017.
- Glieder A. et al, Nat. Biotech., 20, 1135–1139 (2002).
- Coelho, P. S. et al., Science, 339, 307–310 (2013).
- Kan, S. B. J. et al., Nature, 552, 132–136 (2017).
- Siegel, J. B. et. al., Science, 329, 309–313 (2010).
- Eiben, C. B. et. al., Nat. Biotech., 30, 190–192 (2012).
- King, N. P. et al., Science, 336, 1171–1174 (2012).
- King, N. P. et al., Nature, 510, 103–108 (2014).
- Gonen, S., et al., Science, 348, 1365–1368 (2015).
- Bale, J. B. et al., Science, 353, 389–394 (2016).
- Patterson, D. P. et al., RSC Advances, 1, 1004–1012 (2011).
- Sciore, A., et al., Proc. Natl. Acad. Sci. U.S.A., 113, 8681–8686 (2016).
- Sinclair, J. C. et al., Nat. Nanotechnol., 6, 558–562 (2011).
- Kitagishi, H. et al., J. Am. Chem. Soc., 129, 10326–10327 (2007).
- Oohora, K. et al., Angew. Chem. Int. Ed., 51, 3818–3821 (2012).
- Garcia-seisdedos, H. et al., Nature, 548, 244–250 (2017).
- Brodin, J. D. et al., Nat. Chem., 4, 375–382 (2012).
- Song, W. J. et al., Science, 346, 1525–1528 (2014).
- Rittle, J. et al., Nat. Chem., 11, 434–441 (2019).
-
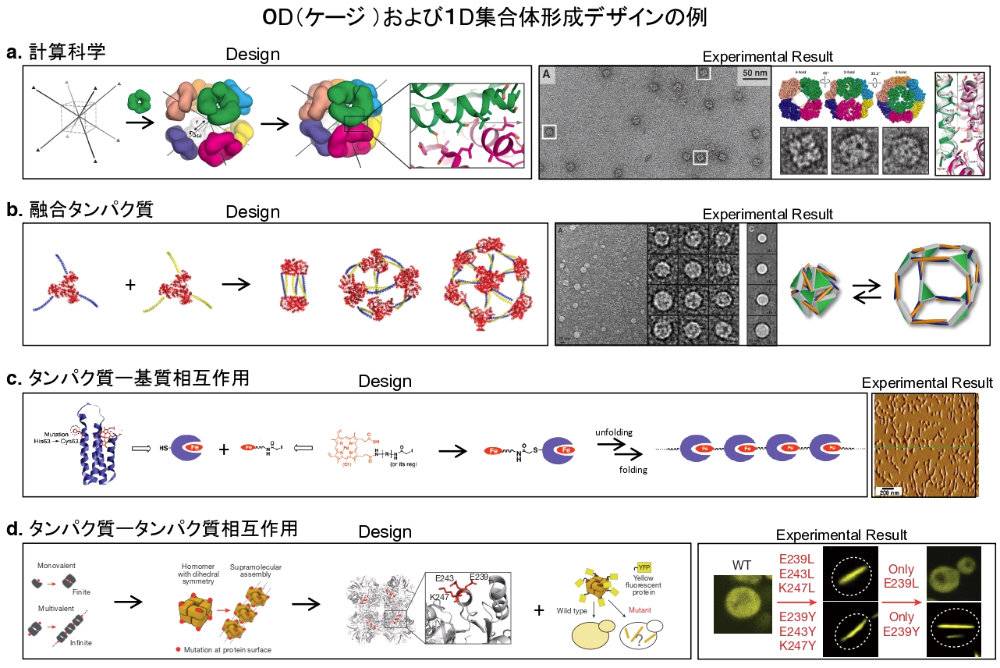
図1: 0D(ケージ)・1D 集合体形成のデザイン例。a. 計算化学によるケージデザイン。対称性(8面体)を用いることでユニットとなるタンパク質を対称軸に配置し、自己集合を可能とするタンパク質-タンパク質相互作用のデザインを採用することで、ケージを実現したデザイン。作製されたケージは電子顕微鏡により観察および解析された(文献9より改変し引用)。b. 融合タンパク質によるケージデザイン。青色と黄色のドメインが相互作用することにより、様々なケージ状構造体を組み上げることを可能にしたデザイン。作製された構造体の一つである8面体ケージ構造は Cryo 電子顕微鏡による詳細な解析から、拡張と収縮を可能とするフレキシブルなケージであることが確認された(文献13より改変し引用)。c. タンパク質とその基質の相互作用を利用した 1D 集合体デザイン。タンパク質のヘム結合部位の反対側にヘムを化学的に修飾させることで、ワイヤー状のタンパク質集合体の作製に成功したデザイン。作製されたワイヤーは AFM によりその構造を確認している(文献16より改変し引用)。d. タンパク質-タンパク質相互作用を利用した 1D 集合体デザイン. 疎水性アミノ酸を用いタンパク質-タンパク質相互作用をデザインすることで、タンパク質集合体を細胞内において作製可能にしたデザイン。蛍光タンパク質(YFP)を融合させることで細胞内での構造構築の観察を可能としている(文献18より改変し引用)。 -
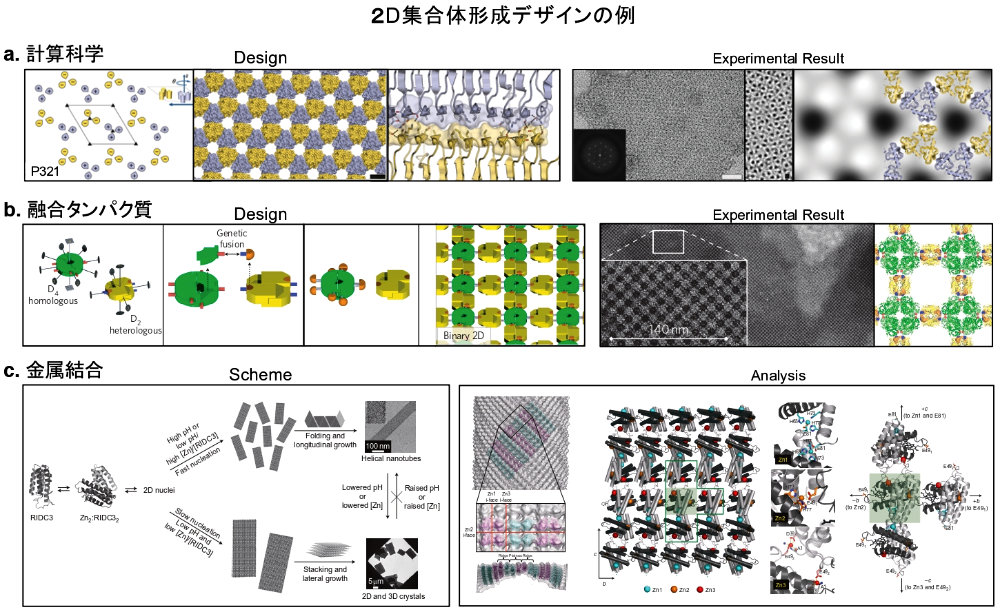
図2: 2D 集合体のデザイン例。a. 計算科学による 2D 集合体デザイン。図1a. のケージ作製を平面状に配列させることを試みた応用デザイン。計算科学によって62の集合体をデザインした。図は、実際に集合体形成に成功した3例のうちの一つ。(文献11より改変し引用)b. 融合タンパク質による 2D 集合体デザイン。2つのタンパク質を融合し、それらが本来の多量体を形成することを利用した集合体デザイン。電子顕微鏡により、デザイン通りの 2D 集合体の形成が確認されている。(文献15より改変し引用)c. 金属結合を利用した 2D 集合体デザイン。タンパク質の外側に金属結合を可能とする変異を導入し、金属との結合を介して集合体を形成するデザイン。溶液のコンディションにより、3D チューブおよび 2D の作製に成功し、その詳細な構造解析が Cryo 電子顕微鏡を用い解明されている。左:3D チューブ、右:2D 集合体および構造体の形成に重要な金属結合が示されている。(文献19より改変し引用)a および b でのデザインにおいては限られた範囲での観察にとどまっている。また、c においても集合体のサイズを μm まで大きくすることに成功しているが、多くの金属結合部位が必要である。したがって、これらの例は、マテリアルの基盤としての利用には未だ多くの課題が残っている。 -
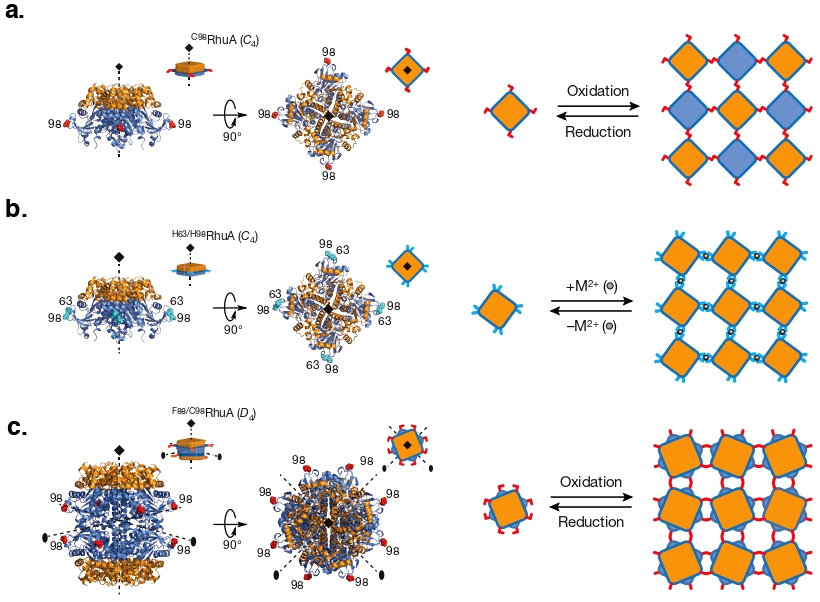
図3: (a) タンパク質の対称性に着目し正方形の4量体(C4 対称)の角にコネクター(システイン)を配置するシンプルなデザインによるタンパク質集合体の形成。(b) ジスルフィド結合から金属(Zn2+)結合へと改変し作成した金属結合による集合体。(c) ベースタンパク質の改変(4量体 C4→8量体 D4)によりデザインの発展性を示した集合体。文献1より引用 -

図4: タンパク質構造(図3 a-c)に対応した透過型顕微鏡による集合体の観察及び考察。(i) 低倍率像、(ii) 高倍率像、(iii) 2D 再構築方法に基づく立体構造モデル(黒枠: Unit Cell)。文献1より引用 -
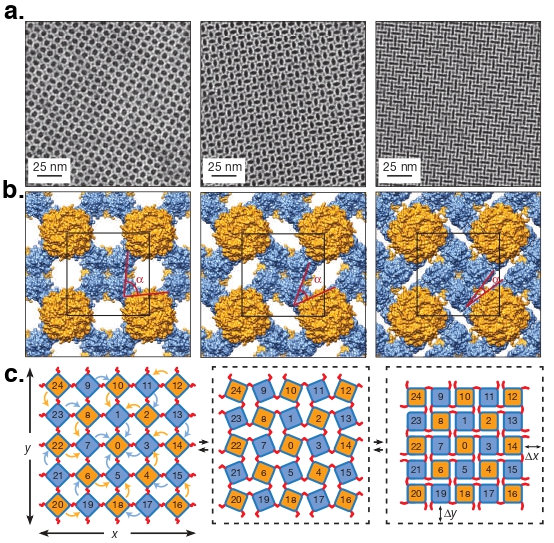
図5: Auxetic 構造体。(a) Auxetic 構造を保有するタンパク質2次元構造体の透過型顕微鏡による観察、(b) 2D 再構成法と既存の X 線構造に基づく立体構造モデル(黒枠:Unit cell、赤:角度変化)および、(c) 格子のダイナミクスを表す回転する正方形モデルの模式図。ΔX とΔY が共に同じ方向に収縮をしている。タンパク質「0」に何かしらの衝撃が加えられた時、シートは収縮される。この収縮が衝撃吸収に反映される。文献1より引用


