概要
タンパク質発現系には大腸菌などの微生物を宿主とする発現系や、昆虫細胞や哺乳細胞を用いた細胞系、小麦胚芽等を用いた無細胞系、近年では植物を用いた発現システムが開発されている。カイコ–バキュロウイルス発現系は、カイコに目的遺伝子を導入した組換えバキュロウイルスを感染させるタンパク質生産方法である。発現するタンパク質の品質の高さやスケーラビリティ等に特徴があり、タンパク質生産における有用な選択肢の一つである。本アーカイブでは本発現系の紹介や産業利用としての弊社事例を紹介し、本発現系への理解の一助になれば幸いである。
発現系の紹介
カイコとバキュロウイルスを用いた発現系の歴史は1984年に前田先生らがカイコ幼虫にヒトインターフェロンαを生産させた報告が最初である(文献1、2)。その後、組換え技術の発展や本発現系を用いた製品の上市など、医薬品をはじめとした広い分野において有用性が知られている。
カイコ–バキュロウイルス発現系の大まかな流れとしては、まず目的遺伝子を転移用ベクターに組換えたのち、Bacmid(バクミド)と呼ばれるシャトルベクターにのせ組換えバクミドを作製する。次に昆虫培養細胞にバクミドを導入し、組換えバキュロウイルスを作製する。これをカイコ幼虫または蛹に注入し感染させることで、カイコ体内で目的遺伝子が大量に発現する。その後、各種精製を行い、目的タンパク質を得る(図1)。カイコ–バキュロウイルス発現系は企業受託が基本であり、詳細なプロトコールに関しては各企業により最適化されているが、参考として以前のタンパク質アーカイブの記事(蛋白質科学会アーカイブ, 4, e063 (2011))に佐々木先生らが詳しく紹介されているため、そちらをご参考いただきたい。
カイコは個々がバイオリアクターとしての機能を有することから、カイコに種々のウイルスを感染させることで多品目のタンパク質作製に対応しやすい特徴をもつ。また、カイコという生体を用いるため毒性タンパク質の発現に強いとされる。産業利用の観点からもタンパク質生産に向いており、理由としてカイコ自体は大量飼育が容易であること、人工飼料での飼育も可能であること、大型の培養装置を必要とせずカイコの頭数を増やすだけでスケールアップが可能である点が挙げられる。高い発現成功率も利点の一つであり、45種類のタンパク質を対象に発現量を調査したところ90%程度のタンパク質発現が確認できたと報告されている(文献3)。
カイコ系統によりタンパク質生産能が向上することも知られている。九州大学は世界最大のカイコバイオリソース機関であり、100年間にわたり遺伝子突然変異系統を収集しており、450系統の近郊系カイコを保管している。それらバイオリソースを用いた行われた組換えタンパク質生産能についての系統スクリーニングによると、非常に優れたタンパク質生産能を有する系統が存在していた(文献4)。
他発現系との比較や利点
大腸菌、酵母、昆虫培養細胞、哺乳類培養細胞、無細胞生産系、植物生産系との比較をまとめた(表1)。カイコを用いた生産系はコスト、品質、スケール性、安全性の面でバランスよく高い発現量の組換えタンパク質を生産する有用なプラットフォームである。品質という点では、天然に存在するタンパク質と同等の構造や機能をもつことが多く、大腸菌ではみられないタンパク質翻訳後修飾も起こる。糖鎖修飾の糖鎖はアスパラギン残基が修飾される N-結合型糖鎖やセリン・トレオニン残基が修飾される O-結合型糖鎖が知られており、カイコ生産系では少マンノース構造であること、またフコースの結合様式がいくつかあるなど、哺乳類系の複合型構造とやや異なる。糖鎖修飾以外の修飾については動物細胞と同等である。
カイコを用いた生産系において、カイコ–バキュロウイルス生産系以外に、カイコの染色体に目的遺伝子を組み込んだ遺伝子組換えカイコ生産系がある(文献5)。遺伝子組換えカイコ生産系では、絹タンパク質の合成組織である絹糸腺で目的タンパク質を発現する。メリットはタンパク質精製が容易であること、大量生産に向いていること、バキュロウイルスを使わないためカルタヘナ法に非該当である点が挙げられる。一方で、遺伝子組換えカイコの構築に時間がかかること、また系統維持管理の問題がある。
発現例
カイコ–バキュロウイルス発現系の事例として、弊社のノロウイルスのカプシドタンパク質 VP1 から形成されるウイルス様粒子(Virus Like Particle;VLP)の調製が挙げられる。本アーカイブでは、Group II に属する4型株(以下、ノロウイルス GII.4)の VP1/VLP 作製の例を紹介したい。ただし、生産上のノウハウも含まれるため、主に一般的な情報とコツの言及にとどまってしまうことご容赦いただきたい。
トランスファーベクターの構築
供与核酸はノロウイルス GII.4 の VP1 領域をコードする遺伝子配列を使用し、トランスファーベクターは Thermo Fisher Scientific 社の pDEST™8(製品番号:11804010)より生成される pEXP8 を使用する。pDEST™8 にノロウイルス GII.4 VP1 の人工合成 DNA 断片を Gibson assembly(文献6)によるシームレスクローニングしたものを pEXP8-NoV GII.4 VP1 とする。DNA 合成する際のコドンについては、カイコへの最適化を行う場合があるものの、最終収量を増やすためには発現コンストラクトのデザインや精製方法の検討がより重要である。本 VLP に関しては、VLP 構造に影響を与えるためアフィニティー精製用タグは付加しない。
遺伝子組換えバキュロウイルス液の調製
バキュロウイルスベクター BbQ4-D00 は九州大学にて分離された核多角体ウイルスに由来する。大腸菌内で BbQ4-D00 に pEXP8-NoV GII.4 VP1 を Bac-to-Bac システムで導入したものを BbQ4-D00/NoV GII.4 VP1 とする。BbQ4-D00/NoV GII.4 VP1 をリポフェクション法によってカイコ培養細胞に導入する。この培養上清を2回新たな BmN 細胞に植え継ぐことで、高力価の遺伝子組換えバキュロウイルス Bombyx mori nucleopolyhedrovirus(BmNPV)isolate Q4/NoV GII.4 VP1 の粒子を得る。BmNPV のバクミド DNA 1.0 μg を 8 × 105 個のカイコ培養細胞に導入すると、27°Cにおいて72時間程度でプラークアッセイ法による 1 × 106 〜1 × 107 プラーク形成単位(Plaque-Forming Unit;pfu)/mL のウイルス粒子が得られる。このウイルス液を 2 × 106 個のカイコ培養細胞に感染させると72時間程度でおよそ10〜100倍の力価のウイルス液が得られる。
カイコ蛹へのウイルス感染
本遺伝子組換えバキュロウイルス液をカイコ蛹に注射針等を用いて数 μL〜10 μL 接種し、一定日数インキュベートすることで、カイコ体内に GII.4 VP1/VLP タンパク質が作られる。感染させる蛹については、繭から取り出した際に、色調や形態に問題がないかを観察する。色調が黒かったり、体の一部が幼虫のままとなっているような蛹化が完全に終わっていない半身モザイク個体は用いない。
タンパク質の精製
弊社のラボスケール(小スケール)の生産においてはカイコ5頭または10頭を精製単位としている。感染蛹を 50 mL チューブに移し、Tris-HCl バッファー 20 mL を加える。この際、ごく少量(10 mg 程度)のチオウレアを加える。バイオマッシャー等で個体をある程度破砕し、超音波破砕にかける。8,000g-30分間の遠心を行い、上清画分を回収してフィルターろ過を行い 50 mL にメスアップする。
一般的にカイコ-バキュロウイルス発現系はタンパク質発現量が優れているものの、蛹から精製する場合には個体全体を破砕することにより内在性タンパク質が多く持ち込まれてしまうため、目的タンパク質のみを分離する精製方法や pH・塩濃度など溶液条件の検討が極めて重要となる。GII.4 VLP に関しては、アフィニティー精製用タグを必要としない硫安沈殿、超遠心、イオン交換、ゲルろ過などによる精製方法が報告されており、弊社ではその中から複数の方法を選択・組み合わせて、精製を行なっている。
生産上の注意点としては、組換えバキュロウイルスを用いる発現系の場合、超音波破砕時の飛散・作業従事者への曝露を考慮する必要がある。弊社では、密閉型の超音波破砕装置を使うことで、拡散防止並びに作業従事者の安全性を担保している。
評価
SDS-PAGE での CBB 染色でのバンドパターン、特異的抗体を用いた Western Blot による検出、動的光散乱による粒子径の解析や電子顕微鏡を用いた撮像にて物性評価を行う(図2)。
上記ノロウイルスの精製 VLP は試薬としての販売を行っているので、もしご興味ある場合は弊社 HP よりお問合せいただきたい。
トピックス
弊社技術導出元である九州大学日下部研究室にて、カイコ–バキュロウイルス発現系を用いた新型コロナウイルスのスパイクタンパク質三量体の作製に成功している(文献7)。本知見をもとに、埼玉のバイオベンチャーであるプロテックス社と弊社との共同開発を行い、スパイクタンパク質を用いた新型コロナウイルス抗体検出キットを完成させた(図3)。2020年10月よりプロテックス社にてB to B向けの指先採血型の郵送抗体検査サービスを提供しており、B to C向け同サービスについて2021年7月にプロテックス社から、9月に弊社にて開始する。またワクチン抗原として、動物試験での有効性が確認できている。こうした速やかな製品開発ができたのは、研究開始から大量生産系構築まで約3ヶ月と短期間で調製に成功しているからであり、カイコ–バキュロウイルス発現系の開発スピードや産業利用への応用性を示せた好例といえる。 また、本発現系の産業利用としてのトピックに、経済産業省から昨年通知された「バキュロウイルス生産系を用いて生産された試薬の取扱い見直し(2020年11月)」が挙げられる。バキュロウイルス生産系を用いて生産された試薬のうち、アフィニティ精製を経たもの(注)については、当該バキュロウイルスが残存しないことが学術論文においても示されている(文献8)。さらに遺伝子組換えバキュロウイルスは、紫外線や乾燥から粒子を保護する機能をもつポリヘドリンの遺伝子を目的遺伝子に置き換えており、一般環境中で存在できないことや、ヒトを含む哺乳類では増殖しないことなど科学的知見の蓄積があることを踏まえ、当該タンパク質を含む試薬をカルタヘナ法規制非対象品として扱うことができることが明記された。 本規制見直しにより、当該試薬を扱う社内整備体制や委託先の管理負担、あるいは動物に投与する場合の不活化処理の負担が解消されるため、今後、カイコ–バキュロウイルス発現系を用いた研究開発の発展が期待される。
注)ターゲット分子と特異的かつ可逆的に結合する分子の反応を利用して、ターゲット・タンパク質あるいはその複合体を分離・精製する手法。
受託サービスの紹介
カイコを用いたタンパク質生産について下記会社が受託開発を行っているので、委託や相談がある際には下記URLよりお問い合わせ頂きたい。
文献
- Maeda, S. et al., Proc. Japan Acad. Ser., B60, 423–426 (1984)
- Maeda, S. et al., Nature, 315, 592–594 (1985)
- Usami, A. et al., J. Biochem., 149, 219–227 (2011)
- Lee, J. et al., J. Insect Biotech. Seric., 76, 101–106 (2007)
- Tamura, T. et al., Nature Biotech., 18, 81–84 (2000)
- Gibson, D. et al., Nature Methods, 6, 343–345 (2009)
- Fujita, S. et al., Biochem. Biophys. Res. Commun., 529, 257–262 (2020)
- Ono, C. et al., Microbiol. Immunol., 62, 200–204 (2018)
-
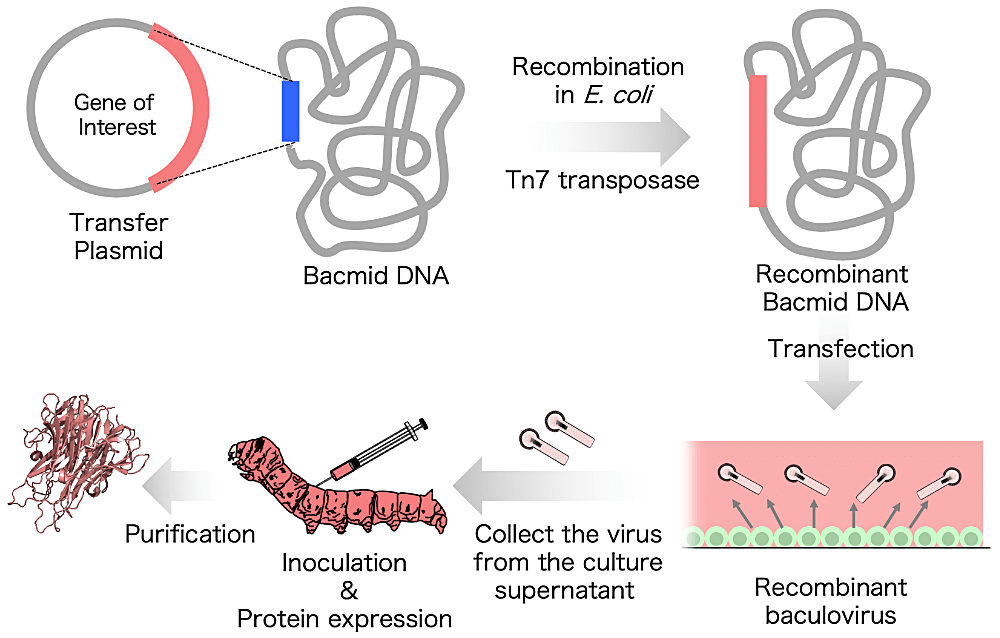
図1:カイコ‒バキュロウイルス発現系 -

表1:タンパク質生産プラットフォームの比較 -
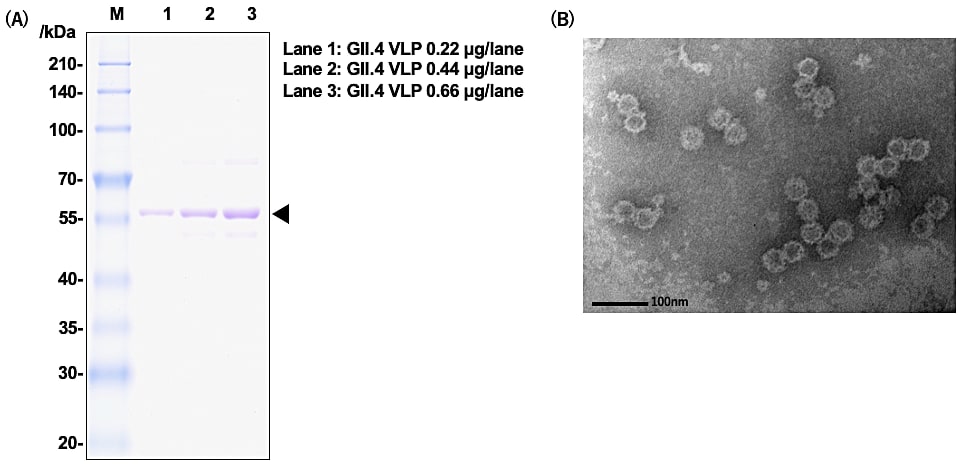
図2:ノロウイルス GII.4 VP1 及び VLP の物性評価の例。(A)GII.4 VP1 の SDS-PAGE バンドパターン、(B)GII.4 VLP の電子顕微鏡像 -
図3:新型コロナウイルス抗体検出キット
概要
タンパク質発現系には大腸菌などの微生物を宿主とする発現系や、昆虫細胞や哺乳細胞を用いた細胞系、小麦胚芽等を用いた無細胞系、近年では植物を用いた発現システムが開発されている。カイコ–バキュロウイルス発現系は、カイコに目的遺伝子を導入した組換えバキュロウイルスを感染させるタンパク質生産方法である。発現するタンパク質の品質の高さやスケーラビリティ等に特徴があり、タンパク質生産における有用な選択肢の一つである。本アーカイブでは本発現系の紹介や産業利用としての弊社事例を紹介し、本発現系への理解の一助になれば幸いである。
発現系の紹介
カイコとバキュロウイルスを用いた発現系の歴史は1984年に前田先生らがカイコ幼虫にヒトインターフェロンαを生産させた報告が最初である(文献1、2)。その後、組換え技術の発展や本発現系を用いた製品の上市など、医薬品をはじめとした広い分野において有用性が知られている。
カイコ–バキュロウイルス発現系の大まかな流れとしては、まず目的遺伝子を転移用ベクターに組換えたのち、Bacmid(バクミド)と呼ばれるシャトルベクターにのせ組換えバクミドを作製する。次に昆虫培養細胞にバクミドを導入し、組換えバキュロウイルスを作製する。これをカイコ幼虫または蛹に注入し感染させることで、カイコ体内で目的遺伝子が大量に発現する。その後、各種精製を行い、目的タンパク質を得る(図1)。カイコ–バキュロウイルス発現系は企業受託が基本であり、詳細なプロトコールに関しては各企業により最適化されているが、参考として以前のタンパク質アーカイブの記事(蛋白質科学会アーカイブ, 4, e063 (2011))に佐々木先生らが詳しく紹介されているため、そちらをご参考いただきたい。
カイコは個々がバイオリアクターとしての機能を有することから、カイコに種々のウイルスを感染させることで多品目のタンパク質作製に対応しやすい特徴をもつ。また、カイコという生体を用いるため毒性タンパク質の発現に強いとされる。産業利用の観点からもタンパク質生産に向いており、理由としてカイコ自体は大量飼育が容易であること、人工飼料での飼育も可能であること、大型の培養装置を必要とせずカイコの頭数を増やすだけでスケールアップが可能である点が挙げられる。高い発現成功率も利点の一つであり、45種類のタンパク質を対象に発現量を調査したところ90%程度のタンパク質発現が確認できたと報告されている(文献3)。
カイコ系統によりタンパク質生産能が向上することも知られている。九州大学は世界最大のカイコバイオリソース機関であり、100年間にわたり遺伝子突然変異系統を収集しており、450系統の近郊系カイコを保管している。それらバイオリソースを用いた行われた組換えタンパク質生産能についての系統スクリーニングによると、非常に優れたタンパク質生産能を有する系統が存在していた(文献4)。
他発現系との比較や利点
大腸菌、酵母、昆虫培養細胞、哺乳類培養細胞、無細胞生産系、植物生産系との比較をまとめた(表1)。カイコを用いた生産系はコスト、品質、スケール性、安全性の面でバランスよく高い発現量の組換えタンパク質を生産する有用なプラットフォームである。品質という点では、天然に存在するタンパク質と同等の構造や機能をもつことが多く、大腸菌ではみられないタンパク質翻訳後修飾も起こる。糖鎖修飾の糖鎖はアスパラギン残基が修飾される N-結合型糖鎖やセリン・トレオニン残基が修飾される O-結合型糖鎖が知られており、カイコ生産系では少マンノース構造であること、またフコースの結合様式がいくつかあるなど、哺乳類系の複合型構造とやや異なる。糖鎖修飾以外の修飾については動物細胞と同等である。
カイコを用いた生産系において、カイコ–バキュロウイルス生産系以外に、カイコの染色体に目的遺伝子を組み込んだ遺伝子組換えカイコ生産系がある(文献5)。遺伝子組換えカイコ生産系では、絹タンパク質の合成組織である絹糸腺で目的タンパク質を発現する。メリットはタンパク質精製が容易であること、大量生産に向いていること、バキュロウイルスを使わないためカルタヘナ法に非該当である点が挙げられる。一方で、遺伝子組換えカイコの構築に時間がかかること、また系統維持管理の問題がある。
発現例
カイコ–バキュロウイルス発現系の事例として、弊社のノロウイルスのカプシドタンパク質 VP1 から形成されるウイルス様粒子(Virus Like Particle;VLP)の調製が挙げられる。本アーカイブでは、Group II に属する4型株(以下、ノロウイルス GII.4)の VP1/VLP 作製の例を紹介したい。ただし、生産上のノウハウも含まれるため、主に一般的な情報とコツの言及にとどまってしまうことご容赦いただきたい。
トランスファーベクターの構築
供与核酸はノロウイルス GII.4 の VP1 領域をコードする遺伝子配列を使用し、トランスファーベクターは Thermo Fisher Scientific 社の pDEST™8(製品番号:11804010)より生成される pEXP8 を使用する。pDEST™8 にノロウイルス GII.4 VP1 の人工合成 DNA 断片を Gibson assembly(文献6)によるシームレスクローニングしたものを pEXP8-NoV GII.4 VP1 とする。DNA 合成する際のコドンについては、カイコへの最適化を行う場合があるものの、最終収量を増やすためには発現コンストラクトのデザインや精製方法の検討がより重要である。本 VLP に関しては、VLP 構造に影響を与えるためアフィニティー精製用タグは付加しない。
遺伝子組換えバキュロウイルス液の調製
バキュロウイルスベクター BbQ4-D00 は九州大学にて分離された核多角体ウイルスに由来する。大腸菌内で BbQ4-D00 に pEXP8-NoV GII.4 VP1 を Bac-to-Bac システムで導入したものを BbQ4-D00/NoV GII.4 VP1 とする。BbQ4-D00/NoV GII.4 VP1 をリポフェクション法によってカイコ培養細胞に導入する。この培養上清を2回新たな BmN 細胞に植え継ぐことで、高力価の遺伝子組換えバキュロウイルス Bombyx mori nucleopolyhedrovirus(BmNPV)isolate Q4/NoV GII.4 VP1 の粒子を得る。BmNPV のバクミド DNA 1.0 μg を 8 × 105 個のカイコ培養細胞に導入すると、27°Cにおいて72時間程度でプラークアッセイ法による 1 × 106 〜1 × 107 プラーク形成単位(Plaque-Forming Unit;pfu)/mL のウイルス粒子が得られる。このウイルス液を 2 × 106 個のカイコ培養細胞に感染させると72時間程度でおよそ10〜100倍の力価のウイルス液が得られる。
カイコ蛹へのウイルス感染
本遺伝子組換えバキュロウイルス液をカイコ蛹に注射針等を用いて数 μL〜10 μL 接種し、一定日数インキュベートすることで、カイコ体内に GII.4 VP1/VLP タンパク質が作られる。感染させる蛹については、繭から取り出した際に、色調や形態に問題がないかを観察する。色調が黒かったり、体の一部が幼虫のままとなっているような蛹化が完全に終わっていない半身モザイク個体は用いない。
タンパク質の精製
弊社のラボスケール(小スケール)の生産においてはカイコ5頭または10頭を精製単位としている。感染蛹を 50 mL チューブに移し、Tris-HCl バッファー 20 mL を加える。この際、ごく少量(10 mg 程度)のチオウレアを加える。バイオマッシャー等で個体をある程度破砕し、超音波破砕にかける。8,000g-30分間の遠心を行い、上清画分を回収してフィルターろ過を行い 50 mL にメスアップする。
一般的にカイコ-バキュロウイルス発現系はタンパク質発現量が優れているものの、蛹から精製する場合には個体全体を破砕することにより内在性タンパク質が多く持ち込まれてしまうため、目的タンパク質のみを分離する精製方法や pH・塩濃度など溶液条件の検討が極めて重要となる。GII.4 VLP に関しては、アフィニティー精製用タグを必要としない硫安沈殿、超遠心、イオン交換、ゲルろ過などによる精製方法が報告されており、弊社ではその中から複数の方法を選択・組み合わせて、精製を行なっている。
生産上の注意点としては、組換えバキュロウイルスを用いる発現系の場合、超音波破砕時の飛散・作業従事者への曝露を考慮する必要がある。弊社では、密閉型の超音波破砕装置を使うことで、拡散防止並びに作業従事者の安全性を担保している。
評価
SDS-PAGE での CBB 染色でのバンドパターン、特異的抗体を用いた Western Blot による検出、動的光散乱による粒子径の解析や電子顕微鏡を用いた撮像にて物性評価を行う(図2)。
上記ノロウイルスの精製 VLP は試薬としての販売を行っているので、もしご興味ある場合は弊社 HP よりお問合せいただきたい。
トピックス
弊社技術導出元である九州大学日下部研究室にて、カイコ–バキュロウイルス発現系を用いた新型コロナウイルスのスパイクタンパク質三量体の作製に成功している(文献7)。本知見をもとに、埼玉のバイオベンチャーであるプロテックス社と弊社との共同開発を行い、スパイクタンパク質を用いた新型コロナウイルス抗体検出キットを完成させた(図3)。2020年10月よりプロテックス社にてB to B向けの指先採血型の郵送抗体検査サービスを提供しており、B to C向け同サービスについて2021年7月にプロテックス社から、9月に弊社にて開始する。またワクチン抗原として、動物試験での有効性が確認できている。こうした速やかな製品開発ができたのは、研究開始から大量生産系構築まで約3ヶ月と短期間で調製に成功しているからであり、カイコ–バキュロウイルス発現系の開発スピードや産業利用への応用性を示せた好例といえる。 また、本発現系の産業利用としてのトピックに、経済産業省から昨年通知された「バキュロウイルス生産系を用いて生産された試薬の取扱い見直し(2020年11月)」が挙げられる。バキュロウイルス生産系を用いて生産された試薬のうち、アフィニティ精製を経たもの(注)については、当該バキュロウイルスが残存しないことが学術論文においても示されている(文献8)。さらに遺伝子組換えバキュロウイルスは、紫外線や乾燥から粒子を保護する機能をもつポリヘドリンの遺伝子を目的遺伝子に置き換えており、一般環境中で存在できないことや、ヒトを含む哺乳類では増殖しないことなど科学的知見の蓄積があることを踏まえ、当該タンパク質を含む試薬をカルタヘナ法規制非対象品として扱うことができることが明記された。 本規制見直しにより、当該試薬を扱う社内整備体制や委託先の管理負担、あるいは動物に投与する場合の不活化処理の負担が解消されるため、今後、カイコ–バキュロウイルス発現系を用いた研究開発の発展が期待される。
注)ターゲット分子と特異的かつ可逆的に結合する分子の反応を利用して、ターゲット・タンパク質あるいはその複合体を分離・精製する手法。
受託サービスの紹介
カイコを用いたタンパク質生産について下記会社が受託開発を行っているので、委託や相談がある際には下記URLよりお問い合わせ頂きたい。
文献
- Maeda, S. et al., Proc. Japan Acad. Ser., B60, 423–426 (1984)
- Maeda, S. et al., Nature, 315, 592–594 (1985)
- Usami, A. et al., J. Biochem., 149, 219–227 (2011)
- Lee, J. et al., J. Insect Biotech. Seric., 76, 101–106 (2007)
- Tamura, T. et al., Nature Biotech., 18, 81–84 (2000)
- Gibson, D. et al., Nature Methods, 6, 343–345 (2009)
- Fujita, S. et al., Biochem. Biophys. Res. Commun., 529, 257–262 (2020)
- Ono, C. et al., Microbiol. Immunol., 62, 200–204 (2018)


