概要
G タンパク質共役型受容体(GPCR)は、細胞外に存在する様々な物質を受容し、その情報を細胞内へと伝達する膜受容体の一群である。この10年余りの間に GPCR の構造解析研究は飛躍的に進展し、50種類以上の異なる GPCR の構造情報が現在までに報告されてきた。これにより、各 GPCR が持つ特徴的なリガンド認識機構や受容体活性化機構の理解が進むと同時に、GPCR 間での構造類似性や構造多様性について議論することが可能となってきている。中でも、脂質分子を受容する GPCR の構造が複数報告されてきたことで、この一群の受容体の多くが、細胞外側が “lid” 構造により塞がったリガンド結合ポケット、あるいは脂質膜に向かって開いた “gap” 構造を持つリガンド結合ポケット、という従来の GPCR のイメージからは予想されてこなかった構造的特徴を持つことが分かってきた。この特徴的なリガンド結合ポケットの形状は、受容体に対する脂質性リガンドのアクセス経路について示唆を与えるものであり、脂質受容 GPCR の機能の理解にとって重要である。しかし、全ての GPCR は7回膜貫通構造を共通して持っており、個々の GPCR 構造を一見したのみでは、どの脂質受容 GPCR がどのような構造的特徴を持っているのか、を把握することは難しい。そこで本稿では、筆者が研究対象としてきたこの脂質受容 GPCR について、現在までに報告されてきた構造情報とそれらが持つ構造的特徴についてご紹介する。異なる脂質性リガンドを受容する GPCR 間での構造類似性や相違点を明確にすることで、いかに “lid” 構造や “gap” 構造が脂質受容 GPCR の一群に広く見られるものであるか、をお示ししていきたい。
はじめに
GPCR は、細胞外に存在するリガンドを受容すると、細胞内側で三量体 G タンパク質と相互作用し、これを活性化する。このGタンパク質の活性化が引き金となって細胞内側にて各種シグナル伝達が起こることで、リガンドの情報に応じた細胞応答が引き起こされる。生体内にはアミン、ペプチド、核酸など様々なリガンドを特異的に受容する多様な GPCR が存在しており、それらが多岐にわたる生命現象の制御に関与している。その生理的な重要性に加えて、細胞膜表面に存在する膜受容体としての性質から、GPCR は薬剤標的としても高い注目を集めてきた。GPCR の立体構造からは、リガンド結合部位の形状や、薬剤の受容体に対する結合様式など、薬剤開発の基盤となる様々な情報が得られる。この有用性から、近年 GPCR の構造解析研究は盛んに進められており、現在までに50種を超える GPCR について立体構造情報が報告されてきた。
主に脂質二重膜の構成要素として知られる脂質分子であるが、特定の化学構造を持った脂質分子は細胞間でのシグナル伝達物質として機能し、特定の GPCR を活性化する。このようなシグナル伝達に関与する脂質分子は「脂質メディエーター」と総称され、炎症応答や細胞増殖など幅広い細胞応答に関与することが報告されている(文献1)。脂質メディエーターの中には、膜を構成するリン脂質から炭化水素鎖が一本取り除かれることによって合成されるリゾリン脂質(スフィンゴシン-1-リン酸、リゾホスファチジン酸など)や、多価不飽和脂肪酸から酵素反応を経て合成されるプロスタグランジンやロイコトリエンなど、様々な化学構造を持つ脂質分子が含まれる(図1)。また、単純な脂肪酸も脂質メディエーターとして機能することが知られている。ヒトが持つ350種を超える GPCR の内、脂質メディエーターを受容する GPCR は現在までに30種以上同定されている(図2; 文献1、2、3)。また、生理的なリガンドが明らかになってはいないオーファン GPCR の中にも、脂質分子を受容する可能性が指摘されているものが存在しており、今後の機能解析研究が待たれる分野となっている。
図2に示した系統樹から見て取れるように、脂質受容 GPCR は、そのアミノ酸配列に基づきいくつかのクラスターに分けられる。大体の場合、共通のリガンドを受容する GPCR が同一のクラスターに属する一方で、リゾホスファチジン酸の受容体やプロスタグランジン受容体 DP2 のように、類似のリガンドを受容する GPCR が系統樹上で全く異なる場所に位置している場合も散見される。また逆に、配列上近縁な関係にある GPCR が、化学構造が大きく異なる脂質メディエーターの受容体として機能していることも見て取れる。このように、配列相同性とリガンド選択性が単純に一致していない点が、脂質受容GPCRの特徴の一つと言える。
脂質受容 GPCR の既知構造
2012年にスフィンゴシン-1-リン酸(S1P)の受容体 S1P1 の結晶構造が報告されたのを皮切りに(文献4)、2018年末現在までにリゾホスファチジン酸(LPA)受容体である LPA1(文献5)と LPA6(文献6)、長鎖脂肪酸受容体 FFAR1(GPR40)(文献7、8、9)、カンナビノイド受容体 CB1(文献10、11、12)、ロイコトリエン B4 受容体 BLT1(文献13)、血小板活性化因子(platelet-activating-factor)受容体 PAFR(文献14)、プロスタグランジン D2 受容体 DP2(CRTH2)(文献15)、プロスタグランジン E2 受容体 EP3(文献16、17)と EP4(文献18)、トロンボキサン A2 受容体 TP(文献19)、と11種の脂質受容 GPCR の結晶構造が報告されている(図3)。GPCR の構造解析研究では、受容体に対する高い親和性を持つ作動薬(アゴニスト)または阻害剤(アンタゴニスト・インバースアゴニスト)が結合した状態で構造決定を行うのが一般的である。脂質受容 GPCR の場合も例外ではなく、LPA6 を除く10種では、受容体作動薬または阻害剤の結合状態で構造が決定されている。この内 EP3 では、受容体作動薬結合構造に加えて、生理的なリガンドであるプロスタグランジン E2 結合状態の構造も報告されており(文献16)、生理的リガンドの認識機構を構造的に明らかにすることに成功している。また CB1 については阻害剤結合状態と作動薬結合状態の両構造が報告されており(文献10、12)、受容体活性化機構についての示唆が得られた。筆者が構造解析を行った LPA6 のみ、例外的に作動薬や阻害剤を加えることなく結晶構造が決定されている(文献6)。LPA6 の場合、化合物の代わりに、結晶化条件に含まれていたモノアシルグリセロールが受容体のリガンド結合ポケットに結合しており、これが生理的なリガンドの結合状態を模しているという考えに基づき、リガンド認識機構についての示唆を得ている。
図2の系統樹に基づくと、これら11種の GPCR は S1P1、LPA1、CB1、という近縁な一群、TP、EP3、EP4 というプロスタグランジン受容体の一群、上記6種とは配列相同性を持たない FFAR1、LPA6、PAFR という一群、そして、上記3グループのいずれからも外れた BLT1 と DP2、という4グループに分けられるだろう。それでは、これらの4グループ内ではどのような構造的特徴が共有されているのだろうか。また、グループ間ではどのような構造的違いがあるのだろうか。この構造的な共通性・多様性を理解する上で軸となるのが、脂質受容 GPCR の一群に頻繁に見られる2つの構造的特徴の存在である。一般的に GPCR は7回膜貫通構造の中央に、細胞外側に対して開いたリガンド結合ポケットを持つとして理解されてきており、これまでに報告されてきた GPCR 構造の多くもこの理解に合致した状態をとっていた。しかし、脂質受容 GPCR 構造中には、1) 細胞外側のループがリガンド結合ポケットの上部を覆う “lid” 構造を形成しており、それに伴いリガンド結合ポケットが細胞外側に対して完全に閉じている、2) 受容体のうち脂質二重膜に埋まった領域に “gap” 構造が存在し、リガンド結合ポケットがその “gap” 構造を介して脂質二重膜に向かって開いている、という2つのユニークな特徴が頻繁に見られ、これが脂質性リガンドを受容する上で機能的に重要であると予想されている。そこで以下、これらの脂質受容GPCRに特有の構造的特徴である1) “lid” 構造の有無、並びに2) “gap” 構造の有無、の2点に着目して、脂質受容 GPCR 構造間での共通点と相違点についてまとめていく。その後、脂質受容 GPCR の活性化機構について、現在までに得られている知見についても簡単にまとめる。なお、個々の構造に基づき議論されている、リガンド認識機構や受容体阻害機構の詳細は、それぞれの参考文献に詳しいので、そちらをご参照頂きたい。
N末端が作る “lid” 構造の有無
GPCR は一般に、7回膜貫通構造の中央部分にリガンド結合ポケットを持つ。このポケットは多くの場合で細胞外側に向かって開いており、細胞外に存在するリガンドを受容する上で適した構造を取っている。しかし、脂質受容 GPCR の既知構造の中には、このリガンド結合ポケットの上部が、ヘリックス構造やループ構造によって覆われているものが存在する(図4)。S1P1、LPA1 では、ヘリックス構造をとったN末端がリガンド結合ポケット上部を覆っており、非常に類似な構造を取っている。この2種に近縁な CB1 の構造でも同様で、ループ状の伸びきった構造を取った N 末端がリガンド結合ポケットの上部を覆っている。すなわち、N 末端が形成する “lid” 構造は S1P1、LPA1、CB1 という近縁な受容体間で共有されている構造的特徴と言える。S1P1 と LPA1 の場合、これらの “lid” にはリガンド認識に重要なアミノ酸残基が位置しており、受容体の機能的にもN末端領域が重要と考えられている(文献4、5)。
上記の3種に比較的近縁な EP3、EP4、TP では、N末端ではなく、膜貫通ヘリックス(TM)の内 TM4 と TM5 の間に位置する細胞外ループ(Extracellular loop 2; ECL2)がリガンド結合ポケット上部を覆う “lid” 構造を形成している。これらの受容体では、ECL2 は逆平行βヘアピン構造を取った上で、脂質二重膜に対して平行な向きを取ってリガンド結合ポケット上部に位置しており、TM3 との間に形成されたジスルフィド結合により安定化されている。なお TP の場合、この ECL2 の上部にさらに N 末端が覆いかぶさる二重構造を取っており、より安定な “lid” 構造が形成されていた。EP3、EP4、TPの全てで、ECL2上のアミノ酸残基がリガンド認識に関わることが構造、変異体実験の両面から示されており(文献16、17、18、19)、“lid”領域が持つ機能的重要性が明らかとなっている。
一方、FFAR1とLPA6に目を移すと、N末端はリガンド結合ポケットの上部を覆ってはいない。FFAR1の場合、TM1より前側にN末端領域をほとんど持っておらず、“lid”構造を作れない状態となっている。リガンド結合ポケット上部はECL2によって半分程度覆われているが、前述のような完全な “lid” 構造は形成されていない。LPA6の場合は、N末端には構造を取っていない10から20残基程度のループが存在するが、ヒト、マウス、チキン、ゼブラフィッシュ間でアミノ酸配列を比較するとこの領域の長さ・配列の保存性は低い。よって、リガンド認識に際してN末端がリガンド結合ポケットの上部を覆うような構造をとるとは考えにくい。また、ECL2もリガンド結合ポケットの周縁部に位置しており、“lid” 構造を形成してはいない。しかし、これらの受容体と近縁なPAFRの場合、ECL2が作るβヘアピン構造がリガンド結合ポケット上部を半分程度覆っており、これとN末端の短いループ が相互作用することで結果的にリガンド結合ポケット上部に蓋状の構造が形成されている。このように、“lid” 構造の観点から見たときに、FFAR1、LPA6、PAFRの3種の間に明確な構造的共通性は無いと言える。
残るBLT1とDP2の内、DP2ではPAFR同様にN末端ループとECL2が “lid” 構造を形成している。DP2のN末端ループはヘリックス構造を取っており、これがβヘアピン構造をとったECL2と平行に並ぶことで完全な “lid” 構造が形成されている。βヘアピン構造をとったECL2は、同じプロスタグランジン受容体であるEP3、EP4、TPに比べるとリガンド結合ポケット周縁部寄りに位置しており、“lid” 構造の形成にはN末端ループが大きく寄与している。よってDP2は、ECL2のみにより “lid” 構造が形成されている他のプロスタグランジン受容体とは異なる構造的特徴を持つと言える。一方、BLT1はFFAR1やLPA6に近く、ECL2はリガンド結合ポケットの周縁部に位置しており、リガンド結合ポケットの上部は大きく細胞外に向かって開いている。BLT1の場合もN末端に構造を取っていないループが存在するが、その短さから、LPA6同様にリガンド結合ポケットを覆う構造をとるとは考えられていない。
以上をまとめると、脂質受容体の構造の多く(11種中8種)はリガンド結合ポケット上部を覆う “lid” 構造を共通して持つと言える。この “lid” 構造を構成する要素は受容体によって異なり、N末端が “lid” 構造を作るもの(S1P1、LPA1、CB1)、ECL2が “lid” 構造を作るもの(EP3、EP4、TP)、N末端とECL2が相互作用して “lid” 構造を形成するもの(PAFR、DP2)と多様である。受容体中のどの領域が関与するか、を問わず、リガンド結合ポケットの上部が覆われている、という特徴自体が脂質受容GPCRの機能にとって重要であると言えるだろう。配列相同性が低い脂質受容GPCR間でも “lid” 構造が共有されていることを踏まえると、“lid” 構造は系統的な近さによらず、脂質受容体としての機能を得る過程で、異なる系統に属するGPCRが個別に獲得していった特徴なのかもしれない。一方で、FFAR1、LPA6、BLT1のように “lid” 構造を持たない脂質受容GPCR構造も報告されている。これらが脂質受容GPCRとしては例外的な構造なのか、また “lid” 構造の有無が脂質受容GPCRとしての性質にどのような影響を及ぼすのか、については今後の構造、機能解析研究が待たれる領域である。
脂質二重膜に向かって開いた “gap” 構造の有無
前項で、リガンド結合ポケット上部の “lid” 構造が一部の脂質受容GPCRで見られることを紹介した。これらの GPCR の場合、“lid” によって細胞外から隔絶されたリガンド結合ポケットに対し、リガンドがどのようにしてアクセスするのか、が大きな疑問として挙がる。その手がかりとなるのが、脂質二重膜に対して開いた “gap” の存在である(図4、図5)。
脂質二重膜に向かって開いた “gap” は、S1P1 の構造中で最初に見出された。S1P1 のリガンド結合ポケットは前述の通りN末端が作るヘリックス構造によって覆われている。その一方で、膜貫通領域に目を向けると、TM1 と TM7 の間に “gap” ができており、リガンド結合ポケットがその “gap” を介して脂質二重膜に向かって開いていることが見出された。この “gap” が、リガンド結合ポケットが外界に向かって開いている唯一の開口部であったことから、S1P のような脂質性のリガンドはこの “gap” を通って受容体の側面からリガンド結合ポケットにアクセスするのではないか、という可能性が提唱された(文献4)。
この TM1 と TM7 の間の領域に着目すると、S1P1 に類似の LPA1 の場合、TM1 と TM7 の間の間隙は S1P1 に比べて狭く、脂質二重膜に向かって開いてはいない。LPA1 の構造決定に付随して行われた分子動力学シミュレーションからも、この領域が脂質二重膜に向かって閉じたままであることが示唆された(文献5)。そのため LPA1 の場合、リガンドは N 末端が作る ”lid“ と膜貫通領域の間に形成されたわずかな隙間からリガンド結合ポケットにアクセスすると考えられている。一方、同様に S1P1 に近縁の CB1 の場合、阻害剤結合状態の構造では TM1 と TM7 の間、S1P1 と同じ位置に “gap” が形成されており、S1P1 に近い構造を取っている。
プロスタグランジン受容体の場合、前述の通り “lid” 構造は ECL2 により形成されており、細胞外ループの観点では上記の S1P1、CB1 との構造的類似性は低い。しかし、TM1 と TM7 の間に目を向けると、EP4 と TP は同じ位置に “gap” を持っている。特に EP4 の構造中では、阻害剤化合物は TM1 と TM7 の間の “gap” に挟まるような位置に結合しており、この構造情報に基づく分子動力学シミュレーションから、リガンドが脂質膜中より “gap” を通って受容体にアクセスする可能性が示唆された(文献18)。加えて、S1P1、CB1、EP4、TP と配列相同性が低く、“lid” 構造の類似性も低い DP2 の場合でも、同じ位置に “gap” が形成されていた。この構造的特徴と、リガンド結合ポケット周辺の化学的環境に基づき、“gap” をリガンドアクセス経路として想定した、DP2 に対するプロスタグランジン D2 結合機構のモデルが提唱されている(文献15)。
以上のように、TM1 と TM7 の間の “gap” 構造は S1P1、CB1、EP4、TP、DP2 で明確に確認されている。複数の脂質受容 GPCR が共通して同じ位置に “gap” を持つことから、TM1 と TM7 の間が一般に、脂質二重膜に向かって開いた構造を取りやすい領域であると言えるだろう。配列相同性に基づくと、他の S1P 受容体やプロスタグランジン受容体でも、同じ位置に “gap” を持つ可能性が高い。一方で LPA1 のように、この領域が閉じた構造を取る、と考えられている事例もあり、TM1 と TM7 の間の “gap” 構造が近縁な脂質受容 GPCR の間でどの程度共有されているのか、を理解する上では、他の脂質受容 GPCR の構造情報が待たれる。
なお、CB1 の作動薬結合構造中では、阻害剤結合構造とは異なり TM1 と TM7 の間の “gap” が閉じていたことから、この “gap” が開閉可能な、フレキシブルなものである可能性が示唆されている(文献12)。また、EP3 の作動薬結合構造中でも TM1 と TM7 の間の “gap” は閉じており、さらに ECL2 により作動薬が完全に外界から隔絶されていたことから、TM1 と TM7 の間が CB1 の場合と同様に開閉可能なリガンドアクセス経路として機能する可能性が示唆されている(文献17)。しかし、この “gap” 構造の柔軟性については現時点でも構造的な裏付けが乏しく、明確な議論は為されていない。この論点に迫る上では、作動薬結合状態と阻害剤結合状態の両方の構造決定と、それらの構造比較に基づく議論が必要だろう。
残る4種、FFAR1、LPA6、PAFR、BLT1 は、いずれも TM1 と TM7 の間に明確な “gap” 構造は持っていない。この内 LPA6 と PAFR は共通して、TM1 と TM7 の間とは異なる位置、TM4 と TM5 の間に “gap” を持つ。S1P1 や CB1 などに見られた “gap” とは異なり、LPA6 と PAFR の “gap” は縦に細長く、TM4 と TM5 の細胞外末端から膜貫通領域の中央部分に渡って溝状の “gap” が形成されている(図5)。LPA6 と PAFR の構造に共通して、この溝内部には結晶化条件に含まれる脂質分子が結合していた。さらに LPA6 と PAFR の両者についてドッキングシミュレーションが行われており、その両方で、生理的なリガンドが持つ炭化水素鎖部分がこの溝内部に挿入される、という結果が得られている(文献6、14)。以上より、LPA6 と PAFR の場合、TM4 と TM5 の間の “gap” は脂質二重膜からのリガンドアクセス経路として機能すると同時に、リガンドを収容するポケットの一部としても機能する可能性が提唱されている。類似の結果は、LPA6 や PAFR に比較的近縁なリゾホスファチジルセリン受容体 GPR34/LPS1 の構造モデルを用いてのドッキングシミュレーションでも得られている(文献20)。一方、LPA6、PAFR と近縁な FFAR1 は、TM3 と TM4 の間に結合する受容体作動薬の結合状態で構造が決定されており、TM3 と TM4 の間に “gap” を持つ一方、TM4 と TM5 の間には “gap” を持たない。また、異なる作動薬の結合状態で決定された FFAR1 の構造中では TM3 と TM4 の間の “gap” も閉じており(文献9)、構造情報の解釈が困難となっている。TM4 と TM5 の間の “gap” が、配列相同性上近縁な脂質受容 GPCR 間でどの程度共有されている特徴なのか、は興味深い点であり、今後の脂質受容 GPCR の構造解析が待たれる。
前述のような脂質膜に向いて開いた “gap” を、BLT1 は持たない。受容体中央に形成されたリガンド結合ポケットは、周囲を取り囲む7本の膜貫通ヘリックスにより脂質二重膜から隔絶されている。また、前項で述べた通り BLT1 は “lid” 構造も持っておらず、故にリガンド結合ポケットは細胞外側の環境に向かってのみ開いている。この観点で BLT1 は、構造が報告されている脂質受容 GPCR の中で、最も一般的な GPCR に近い構造をとっていると言える。
このように、複数の脂質受容GPCRの構造が報告されることで、脂質二重膜に向かって開いた “gap” が特定の受容体に限って見られる例外的なものではなく、脂質受容 GPCR の特定の位置(TM1-TM7 間、または TM4-TM5 間)に見られる、広く共有された構造的特徴であることが明らかになってきた。このような “gap” が脂質受容 GPCR の構造中に共通して見られることは、疎水的なリガンドを受容する GPCR として機能する上で “gap” が重要な意義を持つことを示唆している。脂質性リガンドは疎水的な性質を持つことから、一定の割合が脂質二重膜にささった状態で存在する可能性がある。このような脂質膜中に蓄積したリガンドに対して応答する上で、脂質二重膜に向かって開いた “gap” を持つことが重要なのかもしれない。一方で、LPA1 や BLT1 は脂質二重膜に向かって開いた “gap” を持たず、EP3 や FFAR1 の場合は “gap” 構造の有無が依然明確では無い。また、“gap” がリガンドアクセス経路として機能する、という仮説は構造的な妥当性から徐々に受け入れられているものの、間接的な実験や分子動力学シミュレーションによるサポートがあるのみであり、実験的検証は不十分である。これまでに得られた脂質受容 GPCR の構造を基盤情報として、リガンドアクセス経路や、“gap” が持つ機能的意義についてさらに解析していくことで、脂質受容GPCRによるリガンド認識機構の理解が進展していくと期待される。
受容体活性化機構
近年の構造解析技術の発展により、複数のGPCRについて、作動薬結合状態と阻害剤結合状態の両方の構造が明らかになってきた。また、一部の GPCR では細胞内側でGタンパク質と結合した活性化状態の構造も報告されており、これらを通して GPCR の活性化機構についての理解が大きく進んでいる。一方で、脂質受容 GPCR の場合、作動薬結合状態の構造情報は少なく、活性化機構についての知見は現時点で限られている。本項では、これまでに得られた活性化機構についての示唆について、前述してきた受容体間での構造的共通性と関連させつつまとめていく。
これまでに構造決定された11種の脂質受容 GPCR の内、作動薬結合状態と阻害剤結合状態の両方が報告されているものはCB1のみである(文献10、11、12)。この CB1 の阻害剤結合構造と作動薬結合構造を比較すると、作動薬が結合した場合に TM1 と TM2 の細胞外末端が受容体中央方向に向かって移動している(図6)。この動きに伴い、阻害剤結合状態で見られていた TM1 と TM7 の間の “gap” が、作動薬結合状態では閉じた状態となっていた。このことから、リガンドの結合に伴い TM1 と TM2 の細胞外側での動きが起こることが受容体活性化に重要であると提唱されている(文献12)。
同様の構造変化が起こる可能性は、プロスタグランジン受容体の構造からも示唆されている。プロスタグランジン受容体のうち、阻害剤結合状態の EP4 と作動薬結合状態の EP3 の構造を比較すると、作動薬結合状態の EP3 構造では TM1 が受容体中央により近い位置をとっていた(図6;文献16)。また、EP4 では TM1 と TM7 の間に “gap” が見られたのに対し、EP3 ではこの領域は閉じた構造をとっている。このように、EP3 と EP4 の間で見られる構造の違いは、CB1 で作動薬の結合に伴い起こる構造変化に類似している。
一方で、CB1、EP3 の両者について、TM1 に見られた動きと受容体活性化との詳細な関係性は明らかではない。GPCR は共通して、高度に保存された相互作用ネットワークをその中央部分に保持しており、この相互作用ネットワークの組み換えが、GPCR の活性化をもたらす主要な引き金であると考えられている。前述の TM1 の動きは相互作用ネットワーク周辺に大きな構造変化をもたらしておらず、TM1 の動きが受容体活性化を引き起こす直接の引き金なのか、リガンド結合に付随して起こる構造変化に過ぎないのか、は不明である。特にプロスタグランジン E2 結合状態のEP3構造中では、リガンドが持つ炭化水素鎖の末端が受容体中央の相互作用ネットワークと直接相互作用しており、この相互作用が受容体活性化に重要と提唱されている(文献16)。TM1 の動きが受容体活性化にとって必須な構造変化なのか、また、類似の受容体活性化機構が近縁な脂質受容 GPCR 間でどこまで共有されているのか、を理解する上ではさらなる構造情報が必要である。
TM1 と TM7 の間に “gap” 構造を持たない脂質受容 GPCR の一群に目を向けると、LPA6 の構造から受容体活性化機構についての示唆が得られている。LPA6 や PAFR の一群は、核酸受容体であるP2Yファミリーの GPCR に近縁である。この P2Y ファミリーに属する受容体の構造から、TM6 が受容体の内側に向かって倒れこむ動きが受容体中央の相互作用ネットワークに伝わり受容体活性化を引き起こす、という機構が提唱されていた(文献21、22)。この P2Y ファミリー受容体との構造類似性と、ドッキングシミュレーション、変異体解析に基づき、LPA6 の場合でも TM6 が受容体中央に向かって倒れこむことで受容体活性化が引き起こされる可能性が提唱されている(図6;文献6)。しかし、LPA6 の構造は前述の通り阻害剤、作動薬のどちらも結合していない状態で決定されており、この受容体活性化機構を明確に支持する構造情報が得られているわけではない。LPA6、またはそれに近縁な脂質受容 GPCR について、活性化状態の構造を決定することが求められる。
以上のように、脂質受容 GPCR の受容体活性化機構について現時点で得られている情報は依然乏しい。特に、作動薬結合状態の構造が乏しいことから、活性化機構について議論するための構造比較が十分にできない点が大きな難点と言える。活性化機構のさらなる理解にとっては、CB1 と EP3 に続く、作動薬結合状態の脂質受容 GPCR 構造が必要であるだろう。特に CB1 や EP3 に見られた TM1 の動きは、これまでに報告されている他の GPCR 構造では見られていない特徴的なものである。この構造変化が受容体活性化にとってどのような意義を持つか、は、脂質受容 GPCR の理解の観点からも、GPCR の活性化機構の多様性の観点からも、興味深いテーマであるだろう。
おわりに
多くの脂質受容 GPCR の構造情報が報告されてきたことで、これらの受容体がある程度共通して、リガンド結合ポケット上部の “lid” 構造と受容体側面に形成された “gap” 構造を持つことが明らかになってきた。これらの特徴はどちらも、一般的な GPCR のイメージでは想定されてこなかったものであり、複数の受容体の構造解析を通して初めて明らかになった、脂質受容 GPCR 特有のユニークさであると言える。これらの構造的特徴に注目することで、配列相同性からは伺えなかった受容体間での予想外の構造類似性や差異も明らかになってきた。例えば、プロスタグランジン受容体 DP2 は、他の8種のプロスタグランジン受容体との配列相同性が低い一方で、強固に形成された “lid” 構造とTM1とTM7の間に形成された “gap” という特徴を他のプロスタグランジン受容体と共有しており、この構造的特徴がプロスタグランジン受容という共通の機能を獲得する上で必須な条件であった可能性を示唆している。他方、同じLPA受容体であるLPA1とLPA6は、配列相同性も低く “lid” や “gap” の観点からも大きく異なる構造をとっており、根本的に異なる作動原理に基づいてLPAを受容していることを示唆しているだろう。
このように、構造的な共通性・多様性が明らかになってきた一方で、それらの特徴が持つ機能的な意義はあまり明確に議論されていない。リガンド結合ポケット上部の “lid” 構造に関していえば、この構造の有無がリガンド結合・解離にどのような影響を及ぼすのか、また脂質受容GPCRにおいて特にこの “lid” 構造がよく見られるのはなぜか、など、その機能的な役割について疑問は多く残っている。また、側面に開いた “gap” 構造はリガンドアクセス経路として受け入れられつつあるものの、生体内におけるリガンドの動態と関連づけた時の妥当性、機能的意義については更なる解析や検証が不可欠である。複数の脂質受容 GPCR の構造より、脂質二重膜中からのリガンドアクセスの可能性が強く示唆された一方、疎水的な性質を持つ脂質性リガンドが、生体内において産生された後どのような状態で存在するのか、どのリガンドが脂質膜内に存在し得るのか、についての理解は不足している。各脂質性リガンドによって産生経路は異なっており、LPAのように細胞外の産生酵素によって産生されるものもあれば、S1P のように細胞内で産生されたのち輸送体によって細胞外へと分泌されるものも存在する(文献23、24)。関与する産生酵素や輸送体の性質次第で、リガンドが遊離状態を経て近傍の受容体に受け渡される場合もあれば、産生されたリガンドが脂質二重膜の内部に直接分泌される場合も考えられる。さらに、細胞外における脂質性リガンドの輸送には、脂質結合タンパク質や脂質小胞も関与しており、これらを経由してリガンドが標的細胞へと受け渡される可能性も考えられている(文献25、26)。各脂質性リガンドの生体内での振る舞いに着目し、そのリガンドが生体内で実際に脂質二重膜中に存在するのか、対応する受容体はそのリガンドを受容するのに適した “gap” を持っているのか、を関連づけて議論していくことが、“gap” 構造が持つ機能的な意義の理解、ひいては脂質性リガンドによるシグナル伝達の全容の理解にとって、今後必要になってくるだろう。加えて、“gap” 構造が持つダイナミクス、すなわち、“gap” 構造が常に形成されているのか、開閉を繰り返しているのか、についても、検証を進める必要がある。特に、TM1 と TM7 の間の “gap” 構造が持つダイナミクスについては、受容体活性化機構との関連も示唆されている。この構造的特徴が受容体活性化にとってどのような影響を及ぼすか、を理解する上でも、脂質受容GPCRにおける受容体活性化機構の解明が期待される。このように、各受容体の構造情報とその受容体の性質をつなぎ合わせて理解していくことが、脂質性リガンドとその受容体によるシグナル伝達をより深く理解していく上での今後の課題なのかもしれない。
近年、多数の GPCR 構造が報告されており、それらの全てについて最新の情報を把握し続けることは、特に構造生物学者以外にとっては難しい。事実、本稿の改訂中にもカンナビノイド受容体 CB2 の阻害剤結合状態の構造(文献27)と、作動薬結合状態の CB1 と三量体 G タンパク質 Gi との複合体構造(文献28)が報告されており、今後も脂質受容 GPCR の構造情報は多数報告されてくるだろう。本稿は、このように急激に構造解析研究が進展していく中で、脂質受容 GPCR に関わる研究者が、現状を大まかに把握する上での一助となれば、という思いに基づき作成した。直近に報告された前述の二報の内容は本稿に反映できていないものの、本稿を2018年末までの現状をまとめたものとして、個別の論文に当たる上での入り口として活用いただければ幸いである。
文献
- Shimizu, T. Annu. Rev. Pharmacol. Toxicol. 49, 123–150 (2009)
- Alexander, S. P. et al., Br. J. Pharmacol. 174 Suppl, S17–S129 (2017)
- Kihara, Y., Maceyka, M., Spiegel, S. & Chun, J. Br. J. Pharmacol. 171, 3575–3594 (2014)
- Hanson, M. A. et al., Science 335, 851–855 (2012)
- Chrencik, J. E. et al., Cell 161, 1633–1643 (2015)
- Taniguchi, R. et al., Nature 548, 356–360 (2017)
- Srivastava, A. et al., Nature 513, 124–127 (2014)
- Lu, J. et al., Nat. Struct. Mol. Biol. 24, 570–577 (2017)
- Ho, J. D. et al., Nat. Commun. 9, 1645 (2018)
- Hua, T. et al., Cell 167, 750–762 (2016)
- Shao, Z. et al., Nature 540, 602–606 (2016)
- Hua, T. et al., Nature 547, 468–471 (2017)
- Hori, T. et al., Nat. Chem. Biol. 14, 262–269 (2018)
- Cao, C. et al., Nat. Struct. Mol. Biol. 25, 488–495 (2018)
- Wang, L. et al., Mol. Cell 72, 48–59 (2018)
- Morimoto, K. et al., Nat. Chem. Biol. 15, 8–10 (2019)
- Audet, M. et al., Nat. Chem. Biol. 15, 11–17 (2019)
- Toyoda, Y. et al., Nat. Chem. Biol. 15, 18–26 (2019)
- Fan, H. et al., Nat. Chem. Biol. 15, 27–33 (2019)
- Sayama, M. et al., J. Med. Chem. 60, 6384–6399 (2017)
- Zhang, K. et al., Nature 509, 115–118 (2014)
- Zhang, J. et al., Nature 509, 119–122 (2014)
- Aoki, J., Inoue, A. & Okudaira, S. Biochim. Biophys. Acta - Mol. Cell Biol. Lipids 1781, 513–518 (2008)
- Takabe, K. & Spiegel, S. J. Lipid Res. 55, 1839–1846 (2014)
- Christoffersen, C. et al., Proc. Natl. Acad. Sci. U. S. A. 108, 9613–9618 (2011)
- Record, M., Silvente-Poirot, S., Poirot, M. & Wakelam, M. J. O. J. Lipid Res. 59, 1316–1324 (2018)
- Li, X. et al., Cell 176, 459–467 (2019)
- Krishna Kumar, K. et al., Cell 176, 448–458 (2019)
-
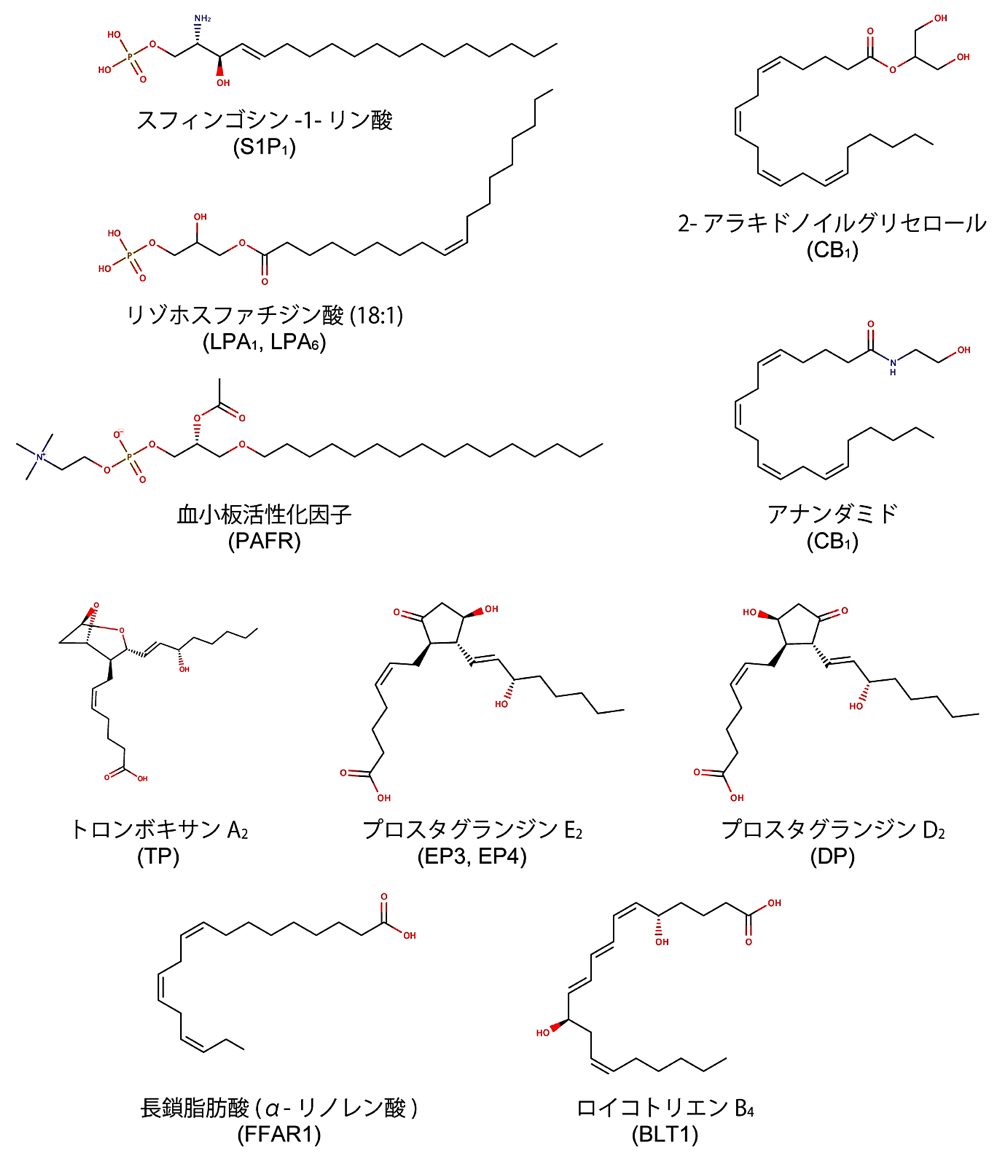
図1:主要な脂質メディエーターの化学構造。構造情報が報告されている脂質受容 GPCR について、これらを活性化する生理的リガンドの内、代表的なものを示した。括弧内は各リガンドを受容する脂質受容 GPCR 名。 -
![図2:脂質受容GPCRの系統樹。受容体のアミノ酸配列全長でのアラインメン卜に基づき作成。構造が現在までに報告されているものを赤字でハイライ卜した(2018年末時点)。分類は文献[2]、[3]に則した。オーファン受容体とステロイド構造を持つ脂質分子の受容体は除外した。](/archives/images/GPCR_01/GPCR_01_Fig_02.png)
図2:脂質受容 GPCR の系統樹。受容体のアミノ酸配列全長でのアラインメン卜に基づき作成。構造が現在までに報告されているものを赤字でハイライ卜した(2018年末時点)。分類は文献[2]、[3]に則した。オーファン受容体とステロイド構造を持つ脂質分子の受容体は除外した。 -
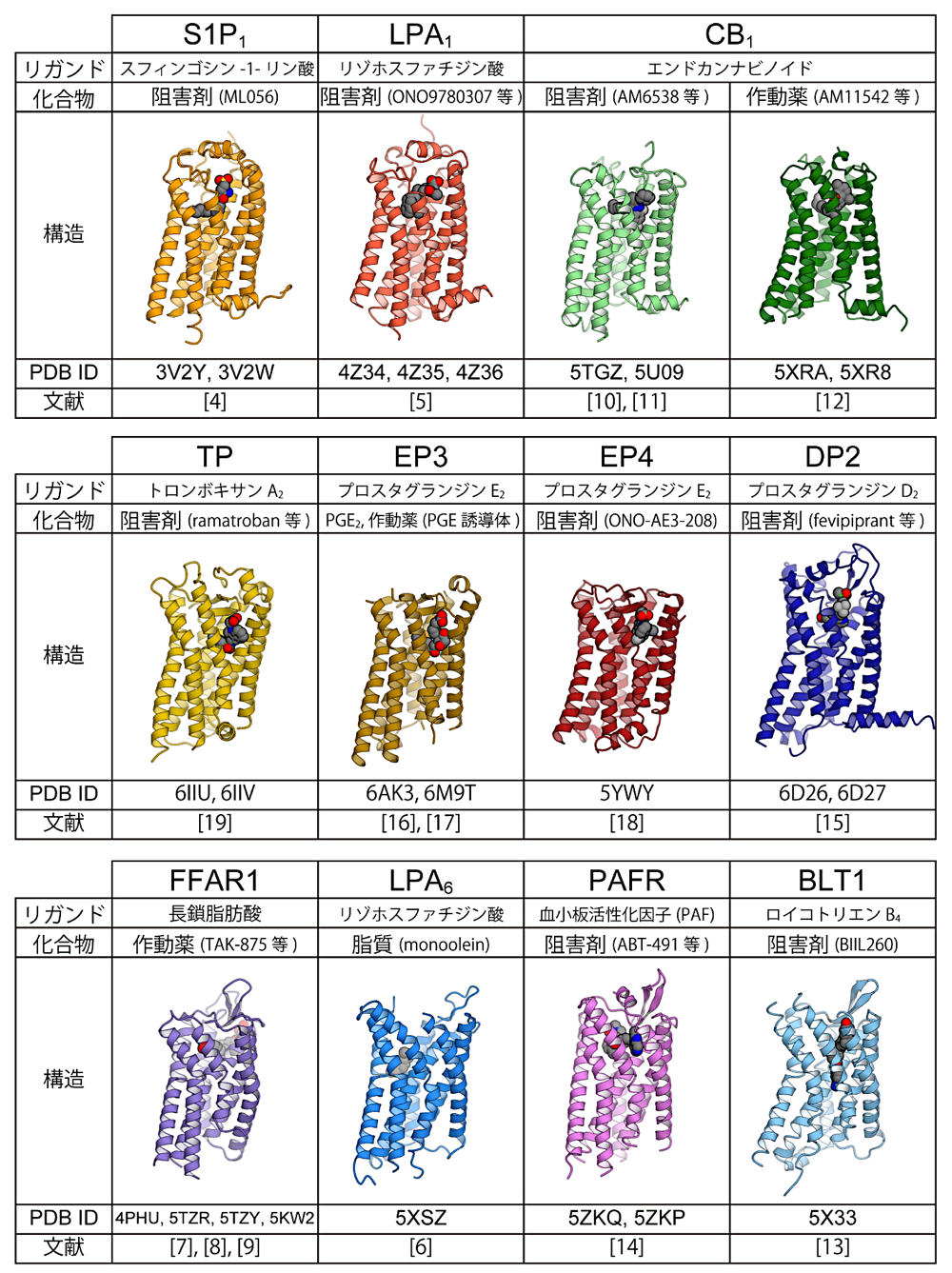
図3:脂質受容 GPCR の既知構造(TM7 側から見た図)。文献番号は本文に対応。リガンド:生理的リガンド、化合物:共結晶化された化合物。 -
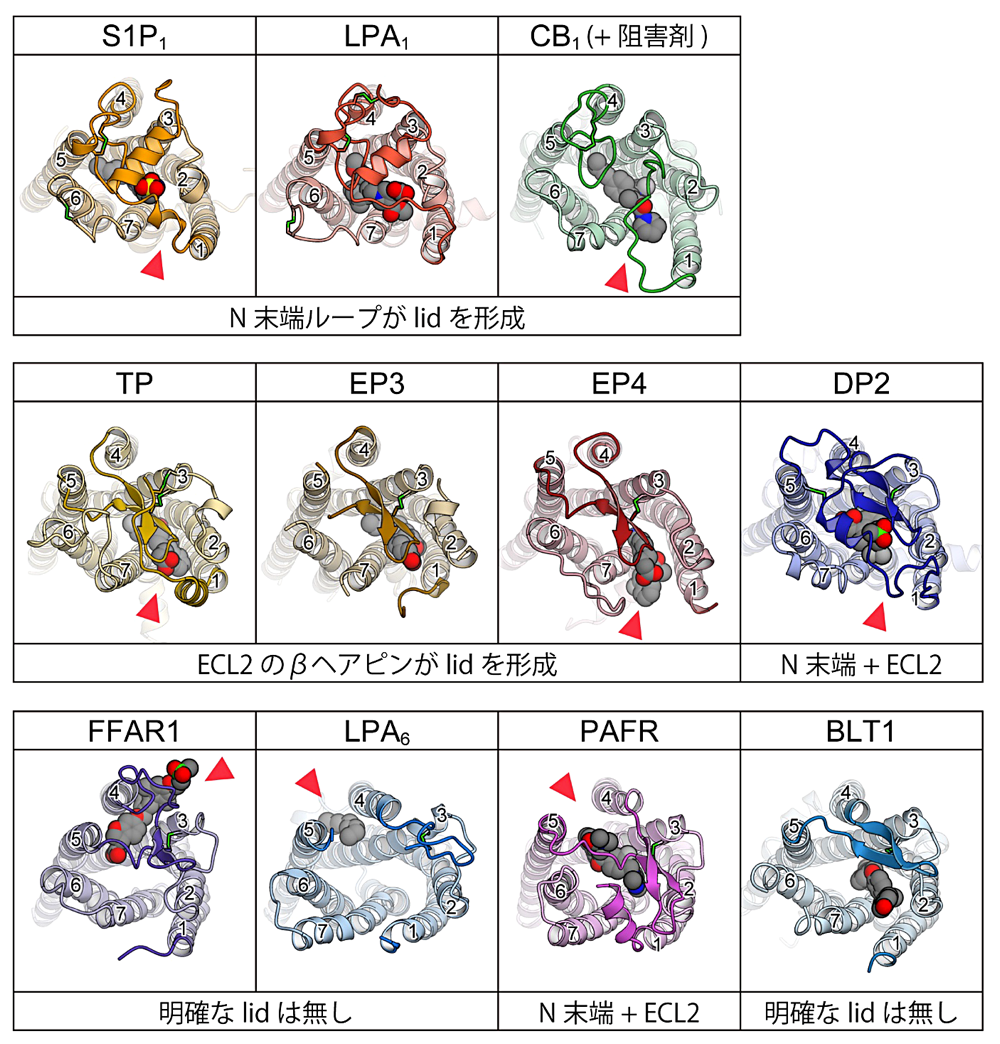
図4:脂質受容 GPCR の細胞外ループ構造。N末端ループと TM4-TM5 聞の ECL2 を濃い色でハイライ卜してある。また細胞外ループを安定化しているジスルフィド結合は黄緑色で示した。赤三角は脂質二重膜に向かって開いた開口部の位置に、各番号は TM 番号に、それぞれ対応。 -

図5:脂質受容 GPCR が持つ gap 構造。受容体側面から見た分子表面中にて、gap の位置を赤丸で示した。FFAR1、LPA6、PAFR 以外では、図2と同じ TM7 側から見た図を、FFAR1、LPA6、PAFR は gap が中央に来るアングルから見た図を示した。 -
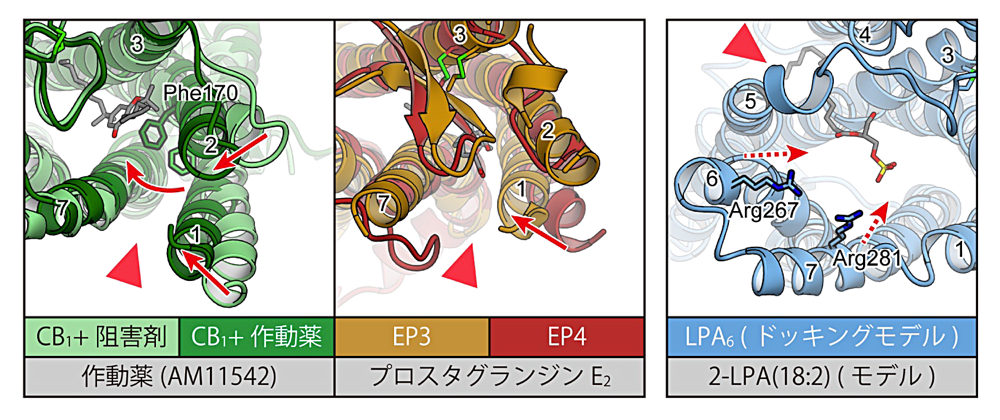
図6:活性化機構について示唆を与える脂質受容 GPCR の構造。CB1 の2つの構造、並びに EP3 と EP4 の構造は、それぞれ重ね合わせた上で TM1、TM2 の動きを赤矢印で示した。LPA6 は結晶構造より得られたドッキングモデル中にて、想定される TM6、TM7 の動きを赤の破線矢印で示した。赤三角は脂質二重膜に向かって聞いた開口部の位置に、各番号は TM 番号に、それぞれ対応。
概要
G タンパク質共役型受容体(GPCR)は、細胞外に存在する様々な物質を受容し、その情報を細胞内へと伝達する膜受容体の一群である。この10年余りの間に GPCR の構造解析研究は飛躍的に進展し、50種類以上の異なる GPCR の構造情報が現在までに報告されてきた。これにより、各 GPCR が持つ特徴的なリガンド認識機構や受容体活性化機構の理解が進むと同時に、GPCR 間での構造類似性や構造多様性について議論することが可能となってきている。中でも、脂質分子を受容する GPCR の構造が複数報告されてきたことで、この一群の受容体の多くが、細胞外側が “lid” 構造により塞がったリガンド結合ポケット、あるいは脂質膜に向かって開いた “gap” 構造を持つリガンド結合ポケット、という従来の GPCR のイメージからは予想されてこなかった構造的特徴を持つことが分かってきた。この特徴的なリガンド結合ポケットの形状は、受容体に対する脂質性リガンドのアクセス経路について示唆を与えるものであり、脂質受容 GPCR の機能の理解にとって重要である。しかし、全ての GPCR は7回膜貫通構造を共通して持っており、個々の GPCR 構造を一見したのみでは、どの脂質受容 GPCR がどのような構造的特徴を持っているのか、を把握することは難しい。そこで本稿では、筆者が研究対象としてきたこの脂質受容 GPCR について、現在までに報告されてきた構造情報とそれらが持つ構造的特徴についてご紹介する。異なる脂質性リガンドを受容する GPCR 間での構造類似性や相違点を明確にすることで、いかに “lid” 構造や “gap” 構造が脂質受容 GPCR の一群に広く見られるものであるか、をお示ししていきたい。
はじめに
GPCR は、細胞外に存在するリガンドを受容すると、細胞内側で三量体 G タンパク質と相互作用し、これを活性化する。このGタンパク質の活性化が引き金となって細胞内側にて各種シグナル伝達が起こることで、リガンドの情報に応じた細胞応答が引き起こされる。生体内にはアミン、ペプチド、核酸など様々なリガンドを特異的に受容する多様な GPCR が存在しており、それらが多岐にわたる生命現象の制御に関与している。その生理的な重要性に加えて、細胞膜表面に存在する膜受容体としての性質から、GPCR は薬剤標的としても高い注目を集めてきた。GPCR の立体構造からは、リガンド結合部位の形状や、薬剤の受容体に対する結合様式など、薬剤開発の基盤となる様々な情報が得られる。この有用性から、近年 GPCR の構造解析研究は盛んに進められており、現在までに50種を超える GPCR について立体構造情報が報告されてきた。
主に脂質二重膜の構成要素として知られる脂質分子であるが、特定の化学構造を持った脂質分子は細胞間でのシグナル伝達物質として機能し、特定の GPCR を活性化する。このようなシグナル伝達に関与する脂質分子は「脂質メディエーター」と総称され、炎症応答や細胞増殖など幅広い細胞応答に関与することが報告されている(文献1)。脂質メディエーターの中には、膜を構成するリン脂質から炭化水素鎖が一本取り除かれることによって合成されるリゾリン脂質(スフィンゴシン-1-リン酸、リゾホスファチジン酸など)や、多価不飽和脂肪酸から酵素反応を経て合成されるプロスタグランジンやロイコトリエンなど、様々な化学構造を持つ脂質分子が含まれる(図1)。また、単純な脂肪酸も脂質メディエーターとして機能することが知られている。ヒトが持つ350種を超える GPCR の内、脂質メディエーターを受容する GPCR は現在までに30種以上同定されている(図2; 文献1、2、3)。また、生理的なリガンドが明らかになってはいないオーファン GPCR の中にも、脂質分子を受容する可能性が指摘されているものが存在しており、今後の機能解析研究が待たれる分野となっている。
図2に示した系統樹から見て取れるように、脂質受容 GPCR は、そのアミノ酸配列に基づきいくつかのクラスターに分けられる。大体の場合、共通のリガンドを受容する GPCR が同一のクラスターに属する一方で、リゾホスファチジン酸の受容体やプロスタグランジン受容体 DP2 のように、類似のリガンドを受容する GPCR が系統樹上で全く異なる場所に位置している場合も散見される。また逆に、配列上近縁な関係にある GPCR が、化学構造が大きく異なる脂質メディエーターの受容体として機能していることも見て取れる。このように、配列相同性とリガンド選択性が単純に一致していない点が、脂質受容GPCRの特徴の一つと言える。
脂質受容 GPCR の既知構造
2012年にスフィンゴシン-1-リン酸(S1P)の受容体 S1P1 の結晶構造が報告されたのを皮切りに(文献4)、2018年末現在までにリゾホスファチジン酸(LPA)受容体である LPA1(文献5)と LPA6(文献6)、長鎖脂肪酸受容体 FFAR1(GPR40)(文献7、8、9)、カンナビノイド受容体 CB1(文献10、11、12)、ロイコトリエン B4 受容体 BLT1(文献13)、血小板活性化因子(platelet-activating-factor)受容体 PAFR(文献14)、プロスタグランジン D2 受容体 DP2(CRTH2)(文献15)、プロスタグランジン E2 受容体 EP3(文献16、17)と EP4(文献18)、トロンボキサン A2 受容体 TP(文献19)、と11種の脂質受容 GPCR の結晶構造が報告されている(図3)。GPCR の構造解析研究では、受容体に対する高い親和性を持つ作動薬(アゴニスト)または阻害剤(アンタゴニスト・インバースアゴニスト)が結合した状態で構造決定を行うのが一般的である。脂質受容 GPCR の場合も例外ではなく、LPA6 を除く10種では、受容体作動薬または阻害剤の結合状態で構造が決定されている。この内 EP3 では、受容体作動薬結合構造に加えて、生理的なリガンドであるプロスタグランジン E2 結合状態の構造も報告されており(文献16)、生理的リガンドの認識機構を構造的に明らかにすることに成功している。また CB1 については阻害剤結合状態と作動薬結合状態の両構造が報告されており(文献10、12)、受容体活性化機構についての示唆が得られた。筆者が構造解析を行った LPA6 のみ、例外的に作動薬や阻害剤を加えることなく結晶構造が決定されている(文献6)。LPA6 の場合、化合物の代わりに、結晶化条件に含まれていたモノアシルグリセロールが受容体のリガンド結合ポケットに結合しており、これが生理的なリガンドの結合状態を模しているという考えに基づき、リガンド認識機構についての示唆を得ている。
図2の系統樹に基づくと、これら11種の GPCR は S1P1、LPA1、CB1、という近縁な一群、TP、EP3、EP4 というプロスタグランジン受容体の一群、上記6種とは配列相同性を持たない FFAR1、LPA6、PAFR という一群、そして、上記3グループのいずれからも外れた BLT1 と DP2、という4グループに分けられるだろう。それでは、これらの4グループ内ではどのような構造的特徴が共有されているのだろうか。また、グループ間ではどのような構造的違いがあるのだろうか。この構造的な共通性・多様性を理解する上で軸となるのが、脂質受容 GPCR の一群に頻繁に見られる2つの構造的特徴の存在である。一般的に GPCR は7回膜貫通構造の中央に、細胞外側に対して開いたリガンド結合ポケットを持つとして理解されてきており、これまでに報告されてきた GPCR 構造の多くもこの理解に合致した状態をとっていた。しかし、脂質受容 GPCR 構造中には、1) 細胞外側のループがリガンド結合ポケットの上部を覆う “lid” 構造を形成しており、それに伴いリガンド結合ポケットが細胞外側に対して完全に閉じている、2) 受容体のうち脂質二重膜に埋まった領域に “gap” 構造が存在し、リガンド結合ポケットがその “gap” 構造を介して脂質二重膜に向かって開いている、という2つのユニークな特徴が頻繁に見られ、これが脂質性リガンドを受容する上で機能的に重要であると予想されている。そこで以下、これらの脂質受容GPCRに特有の構造的特徴である1) “lid” 構造の有無、並びに2) “gap” 構造の有無、の2点に着目して、脂質受容 GPCR 構造間での共通点と相違点についてまとめていく。その後、脂質受容 GPCR の活性化機構について、現在までに得られている知見についても簡単にまとめる。なお、個々の構造に基づき議論されている、リガンド認識機構や受容体阻害機構の詳細は、それぞれの参考文献に詳しいので、そちらをご参照頂きたい。
N末端が作る “lid” 構造の有無
GPCR は一般に、7回膜貫通構造の中央部分にリガンド結合ポケットを持つ。このポケットは多くの場合で細胞外側に向かって開いており、細胞外に存在するリガンドを受容する上で適した構造を取っている。しかし、脂質受容 GPCR の既知構造の中には、このリガンド結合ポケットの上部が、ヘリックス構造やループ構造によって覆われているものが存在する(図4)。S1P1、LPA1 では、ヘリックス構造をとったN末端がリガンド結合ポケット上部を覆っており、非常に類似な構造を取っている。この2種に近縁な CB1 の構造でも同様で、ループ状の伸びきった構造を取った N 末端がリガンド結合ポケットの上部を覆っている。すなわち、N 末端が形成する “lid” 構造は S1P1、LPA1、CB1 という近縁な受容体間で共有されている構造的特徴と言える。S1P1 と LPA1 の場合、これらの “lid” にはリガンド認識に重要なアミノ酸残基が位置しており、受容体の機能的にもN末端領域が重要と考えられている(文献4、5)。
上記の3種に比較的近縁な EP3、EP4、TP では、N末端ではなく、膜貫通ヘリックス(TM)の内 TM4 と TM5 の間に位置する細胞外ループ(Extracellular loop 2; ECL2)がリガンド結合ポケット上部を覆う “lid” 構造を形成している。これらの受容体では、ECL2 は逆平行βヘアピン構造を取った上で、脂質二重膜に対して平行な向きを取ってリガンド結合ポケット上部に位置しており、TM3 との間に形成されたジスルフィド結合により安定化されている。なお TP の場合、この ECL2 の上部にさらに N 末端が覆いかぶさる二重構造を取っており、より安定な “lid” 構造が形成されていた。EP3、EP4、TPの全てで、ECL2上のアミノ酸残基がリガンド認識に関わることが構造、変異体実験の両面から示されており(文献16、17、18、19)、“lid”領域が持つ機能的重要性が明らかとなっている。
一方、FFAR1とLPA6に目を移すと、N末端はリガンド結合ポケットの上部を覆ってはいない。FFAR1の場合、TM1より前側にN末端領域をほとんど持っておらず、“lid”構造を作れない状態となっている。リガンド結合ポケット上部はECL2によって半分程度覆われているが、前述のような完全な “lid” 構造は形成されていない。LPA6の場合は、N末端には構造を取っていない10から20残基程度のループが存在するが、ヒト、マウス、チキン、ゼブラフィッシュ間でアミノ酸配列を比較するとこの領域の長さ・配列の保存性は低い。よって、リガンド認識に際してN末端がリガンド結合ポケットの上部を覆うような構造をとるとは考えにくい。また、ECL2もリガンド結合ポケットの周縁部に位置しており、“lid” 構造を形成してはいない。しかし、これらの受容体と近縁なPAFRの場合、ECL2が作るβヘアピン構造がリガンド結合ポケット上部を半分程度覆っており、これとN末端の短いループ が相互作用することで結果的にリガンド結合ポケット上部に蓋状の構造が形成されている。このように、“lid” 構造の観点から見たときに、FFAR1、LPA6、PAFRの3種の間に明確な構造的共通性は無いと言える。
残るBLT1とDP2の内、DP2ではPAFR同様にN末端ループとECL2が “lid” 構造を形成している。DP2のN末端ループはヘリックス構造を取っており、これがβヘアピン構造をとったECL2と平行に並ぶことで完全な “lid” 構造が形成されている。βヘアピン構造をとったECL2は、同じプロスタグランジン受容体であるEP3、EP4、TPに比べるとリガンド結合ポケット周縁部寄りに位置しており、“lid” 構造の形成にはN末端ループが大きく寄与している。よってDP2は、ECL2のみにより “lid” 構造が形成されている他のプロスタグランジン受容体とは異なる構造的特徴を持つと言える。一方、BLT1はFFAR1やLPA6に近く、ECL2はリガンド結合ポケットの周縁部に位置しており、リガンド結合ポケットの上部は大きく細胞外に向かって開いている。BLT1の場合もN末端に構造を取っていないループが存在するが、その短さから、LPA6同様にリガンド結合ポケットを覆う構造をとるとは考えられていない。
以上をまとめると、脂質受容体の構造の多く(11種中8種)はリガンド結合ポケット上部を覆う “lid” 構造を共通して持つと言える。この “lid” 構造を構成する要素は受容体によって異なり、N末端が “lid” 構造を作るもの(S1P1、LPA1、CB1)、ECL2が “lid” 構造を作るもの(EP3、EP4、TP)、N末端とECL2が相互作用して “lid” 構造を形成するもの(PAFR、DP2)と多様である。受容体中のどの領域が関与するか、を問わず、リガンド結合ポケットの上部が覆われている、という特徴自体が脂質受容GPCRの機能にとって重要であると言えるだろう。配列相同性が低い脂質受容GPCR間でも “lid” 構造が共有されていることを踏まえると、“lid” 構造は系統的な近さによらず、脂質受容体としての機能を得る過程で、異なる系統に属するGPCRが個別に獲得していった特徴なのかもしれない。一方で、FFAR1、LPA6、BLT1のように “lid” 構造を持たない脂質受容GPCR構造も報告されている。これらが脂質受容GPCRとしては例外的な構造なのか、また “lid” 構造の有無が脂質受容GPCRとしての性質にどのような影響を及ぼすのか、については今後の構造、機能解析研究が待たれる領域である。
脂質二重膜に向かって開いた “gap” 構造の有無
前項で、リガンド結合ポケット上部の “lid” 構造が一部の脂質受容GPCRで見られることを紹介した。これらの GPCR の場合、“lid” によって細胞外から隔絶されたリガンド結合ポケットに対し、リガンドがどのようにしてアクセスするのか、が大きな疑問として挙がる。その手がかりとなるのが、脂質二重膜に対して開いた “gap” の存在である(図4、図5)。
脂質二重膜に向かって開いた “gap” は、S1P1 の構造中で最初に見出された。S1P1 のリガンド結合ポケットは前述の通りN末端が作るヘリックス構造によって覆われている。その一方で、膜貫通領域に目を向けると、TM1 と TM7 の間に “gap” ができており、リガンド結合ポケットがその “gap” を介して脂質二重膜に向かって開いていることが見出された。この “gap” が、リガンド結合ポケットが外界に向かって開いている唯一の開口部であったことから、S1P のような脂質性のリガンドはこの “gap” を通って受容体の側面からリガンド結合ポケットにアクセスするのではないか、という可能性が提唱された(文献4)。
この TM1 と TM7 の間の領域に着目すると、S1P1 に類似の LPA1 の場合、TM1 と TM7 の間の間隙は S1P1 に比べて狭く、脂質二重膜に向かって開いてはいない。LPA1 の構造決定に付随して行われた分子動力学シミュレーションからも、この領域が脂質二重膜に向かって閉じたままであることが示唆された(文献5)。そのため LPA1 の場合、リガンドは N 末端が作る ”lid“ と膜貫通領域の間に形成されたわずかな隙間からリガンド結合ポケットにアクセスすると考えられている。一方、同様に S1P1 に近縁の CB1 の場合、阻害剤結合状態の構造では TM1 と TM7 の間、S1P1 と同じ位置に “gap” が形成されており、S1P1 に近い構造を取っている。
プロスタグランジン受容体の場合、前述の通り “lid” 構造は ECL2 により形成されており、細胞外ループの観点では上記の S1P1、CB1 との構造的類似性は低い。しかし、TM1 と TM7 の間に目を向けると、EP4 と TP は同じ位置に “gap” を持っている。特に EP4 の構造中では、阻害剤化合物は TM1 と TM7 の間の “gap” に挟まるような位置に結合しており、この構造情報に基づく分子動力学シミュレーションから、リガンドが脂質膜中より “gap” を通って受容体にアクセスする可能性が示唆された(文献18)。加えて、S1P1、CB1、EP4、TP と配列相同性が低く、“lid” 構造の類似性も低い DP2 の場合でも、同じ位置に “gap” が形成されていた。この構造的特徴と、リガンド結合ポケット周辺の化学的環境に基づき、“gap” をリガンドアクセス経路として想定した、DP2 に対するプロスタグランジン D2 結合機構のモデルが提唱されている(文献15)。
以上のように、TM1 と TM7 の間の “gap” 構造は S1P1、CB1、EP4、TP、DP2 で明確に確認されている。複数の脂質受容 GPCR が共通して同じ位置に “gap” を持つことから、TM1 と TM7 の間が一般に、脂質二重膜に向かって開いた構造を取りやすい領域であると言えるだろう。配列相同性に基づくと、他の S1P 受容体やプロスタグランジン受容体でも、同じ位置に “gap” を持つ可能性が高い。一方で LPA1 のように、この領域が閉じた構造を取る、と考えられている事例もあり、TM1 と TM7 の間の “gap” 構造が近縁な脂質受容 GPCR の間でどの程度共有されているのか、を理解する上では、他の脂質受容 GPCR の構造情報が待たれる。
なお、CB1 の作動薬結合構造中では、阻害剤結合構造とは異なり TM1 と TM7 の間の “gap” が閉じていたことから、この “gap” が開閉可能な、フレキシブルなものである可能性が示唆されている(文献12)。また、EP3 の作動薬結合構造中でも TM1 と TM7 の間の “gap” は閉じており、さらに ECL2 により作動薬が完全に外界から隔絶されていたことから、TM1 と TM7 の間が CB1 の場合と同様に開閉可能なリガンドアクセス経路として機能する可能性が示唆されている(文献17)。しかし、この “gap” 構造の柔軟性については現時点でも構造的な裏付けが乏しく、明確な議論は為されていない。この論点に迫る上では、作動薬結合状態と阻害剤結合状態の両方の構造決定と、それらの構造比較に基づく議論が必要だろう。
残る4種、FFAR1、LPA6、PAFR、BLT1 は、いずれも TM1 と TM7 の間に明確な “gap” 構造は持っていない。この内 LPA6 と PAFR は共通して、TM1 と TM7 の間とは異なる位置、TM4 と TM5 の間に “gap” を持つ。S1P1 や CB1 などに見られた “gap” とは異なり、LPA6 と PAFR の “gap” は縦に細長く、TM4 と TM5 の細胞外末端から膜貫通領域の中央部分に渡って溝状の “gap” が形成されている(図5)。LPA6 と PAFR の構造に共通して、この溝内部には結晶化条件に含まれる脂質分子が結合していた。さらに LPA6 と PAFR の両者についてドッキングシミュレーションが行われており、その両方で、生理的なリガンドが持つ炭化水素鎖部分がこの溝内部に挿入される、という結果が得られている(文献6、14)。以上より、LPA6 と PAFR の場合、TM4 と TM5 の間の “gap” は脂質二重膜からのリガンドアクセス経路として機能すると同時に、リガンドを収容するポケットの一部としても機能する可能性が提唱されている。類似の結果は、LPA6 や PAFR に比較的近縁なリゾホスファチジルセリン受容体 GPR34/LPS1 の構造モデルを用いてのドッキングシミュレーションでも得られている(文献20)。一方、LPA6、PAFR と近縁な FFAR1 は、TM3 と TM4 の間に結合する受容体作動薬の結合状態で構造が決定されており、TM3 と TM4 の間に “gap” を持つ一方、TM4 と TM5 の間には “gap” を持たない。また、異なる作動薬の結合状態で決定された FFAR1 の構造中では TM3 と TM4 の間の “gap” も閉じており(文献9)、構造情報の解釈が困難となっている。TM4 と TM5 の間の “gap” が、配列相同性上近縁な脂質受容 GPCR 間でどの程度共有されている特徴なのか、は興味深い点であり、今後の脂質受容 GPCR の構造解析が待たれる。
前述のような脂質膜に向いて開いた “gap” を、BLT1 は持たない。受容体中央に形成されたリガンド結合ポケットは、周囲を取り囲む7本の膜貫通ヘリックスにより脂質二重膜から隔絶されている。また、前項で述べた通り BLT1 は “lid” 構造も持っておらず、故にリガンド結合ポケットは細胞外側の環境に向かってのみ開いている。この観点で BLT1 は、構造が報告されている脂質受容 GPCR の中で、最も一般的な GPCR に近い構造をとっていると言える。
このように、複数の脂質受容GPCRの構造が報告されることで、脂質二重膜に向かって開いた “gap” が特定の受容体に限って見られる例外的なものではなく、脂質受容 GPCR の特定の位置(TM1-TM7 間、または TM4-TM5 間)に見られる、広く共有された構造的特徴であることが明らかになってきた。このような “gap” が脂質受容 GPCR の構造中に共通して見られることは、疎水的なリガンドを受容する GPCR として機能する上で “gap” が重要な意義を持つことを示唆している。脂質性リガンドは疎水的な性質を持つことから、一定の割合が脂質二重膜にささった状態で存在する可能性がある。このような脂質膜中に蓄積したリガンドに対して応答する上で、脂質二重膜に向かって開いた “gap” を持つことが重要なのかもしれない。一方で、LPA1 や BLT1 は脂質二重膜に向かって開いた “gap” を持たず、EP3 や FFAR1 の場合は “gap” 構造の有無が依然明確では無い。また、“gap” がリガンドアクセス経路として機能する、という仮説は構造的な妥当性から徐々に受け入れられているものの、間接的な実験や分子動力学シミュレーションによるサポートがあるのみであり、実験的検証は不十分である。これまでに得られた脂質受容 GPCR の構造を基盤情報として、リガンドアクセス経路や、“gap” が持つ機能的意義についてさらに解析していくことで、脂質受容GPCRによるリガンド認識機構の理解が進展していくと期待される。
受容体活性化機構
近年の構造解析技術の発展により、複数のGPCRについて、作動薬結合状態と阻害剤結合状態の両方の構造が明らかになってきた。また、一部の GPCR では細胞内側でGタンパク質と結合した活性化状態の構造も報告されており、これらを通して GPCR の活性化機構についての理解が大きく進んでいる。一方で、脂質受容 GPCR の場合、作動薬結合状態の構造情報は少なく、活性化機構についての知見は現時点で限られている。本項では、これまでに得られた活性化機構についての示唆について、前述してきた受容体間での構造的共通性と関連させつつまとめていく。
これまでに構造決定された11種の脂質受容 GPCR の内、作動薬結合状態と阻害剤結合状態の両方が報告されているものはCB1のみである(文献10、11、12)。この CB1 の阻害剤結合構造と作動薬結合構造を比較すると、作動薬が結合した場合に TM1 と TM2 の細胞外末端が受容体中央方向に向かって移動している(図6)。この動きに伴い、阻害剤結合状態で見られていた TM1 と TM7 の間の “gap” が、作動薬結合状態では閉じた状態となっていた。このことから、リガンドの結合に伴い TM1 と TM2 の細胞外側での動きが起こることが受容体活性化に重要であると提唱されている(文献12)。
同様の構造変化が起こる可能性は、プロスタグランジン受容体の構造からも示唆されている。プロスタグランジン受容体のうち、阻害剤結合状態の EP4 と作動薬結合状態の EP3 の構造を比較すると、作動薬結合状態の EP3 構造では TM1 が受容体中央により近い位置をとっていた(図6;文献16)。また、EP4 では TM1 と TM7 の間に “gap” が見られたのに対し、EP3 ではこの領域は閉じた構造をとっている。このように、EP3 と EP4 の間で見られる構造の違いは、CB1 で作動薬の結合に伴い起こる構造変化に類似している。
一方で、CB1、EP3 の両者について、TM1 に見られた動きと受容体活性化との詳細な関係性は明らかではない。GPCR は共通して、高度に保存された相互作用ネットワークをその中央部分に保持しており、この相互作用ネットワークの組み換えが、GPCR の活性化をもたらす主要な引き金であると考えられている。前述の TM1 の動きは相互作用ネットワーク周辺に大きな構造変化をもたらしておらず、TM1 の動きが受容体活性化を引き起こす直接の引き金なのか、リガンド結合に付随して起こる構造変化に過ぎないのか、は不明である。特にプロスタグランジン E2 結合状態のEP3構造中では、リガンドが持つ炭化水素鎖の末端が受容体中央の相互作用ネットワークと直接相互作用しており、この相互作用が受容体活性化に重要と提唱されている(文献16)。TM1 の動きが受容体活性化にとって必須な構造変化なのか、また、類似の受容体活性化機構が近縁な脂質受容 GPCR 間でどこまで共有されているのか、を理解する上ではさらなる構造情報が必要である。
TM1 と TM7 の間に “gap” 構造を持たない脂質受容 GPCR の一群に目を向けると、LPA6 の構造から受容体活性化機構についての示唆が得られている。LPA6 や PAFR の一群は、核酸受容体であるP2Yファミリーの GPCR に近縁である。この P2Y ファミリーに属する受容体の構造から、TM6 が受容体の内側に向かって倒れこむ動きが受容体中央の相互作用ネットワークに伝わり受容体活性化を引き起こす、という機構が提唱されていた(文献21、22)。この P2Y ファミリー受容体との構造類似性と、ドッキングシミュレーション、変異体解析に基づき、LPA6 の場合でも TM6 が受容体中央に向かって倒れこむことで受容体活性化が引き起こされる可能性が提唱されている(図6;文献6)。しかし、LPA6 の構造は前述の通り阻害剤、作動薬のどちらも結合していない状態で決定されており、この受容体活性化機構を明確に支持する構造情報が得られているわけではない。LPA6、またはそれに近縁な脂質受容 GPCR について、活性化状態の構造を決定することが求められる。
以上のように、脂質受容 GPCR の受容体活性化機構について現時点で得られている情報は依然乏しい。特に、作動薬結合状態の構造が乏しいことから、活性化機構について議論するための構造比較が十分にできない点が大きな難点と言える。活性化機構のさらなる理解にとっては、CB1 と EP3 に続く、作動薬結合状態の脂質受容 GPCR 構造が必要であるだろう。特に CB1 や EP3 に見られた TM1 の動きは、これまでに報告されている他の GPCR 構造では見られていない特徴的なものである。この構造変化が受容体活性化にとってどのような意義を持つか、は、脂質受容 GPCR の理解の観点からも、GPCR の活性化機構の多様性の観点からも、興味深いテーマであるだろう。
おわりに
多くの脂質受容 GPCR の構造情報が報告されてきたことで、これらの受容体がある程度共通して、リガンド結合ポケット上部の “lid” 構造と受容体側面に形成された “gap” 構造を持つことが明らかになってきた。これらの特徴はどちらも、一般的な GPCR のイメージでは想定されてこなかったものであり、複数の受容体の構造解析を通して初めて明らかになった、脂質受容 GPCR 特有のユニークさであると言える。これらの構造的特徴に注目することで、配列相同性からは伺えなかった受容体間での予想外の構造類似性や差異も明らかになってきた。例えば、プロスタグランジン受容体 DP2 は、他の8種のプロスタグランジン受容体との配列相同性が低い一方で、強固に形成された “lid” 構造とTM1とTM7の間に形成された “gap” という特徴を他のプロスタグランジン受容体と共有しており、この構造的特徴がプロスタグランジン受容という共通の機能を獲得する上で必須な条件であった可能性を示唆している。他方、同じLPA受容体であるLPA1とLPA6は、配列相同性も低く “lid” や “gap” の観点からも大きく異なる構造をとっており、根本的に異なる作動原理に基づいてLPAを受容していることを示唆しているだろう。
このように、構造的な共通性・多様性が明らかになってきた一方で、それらの特徴が持つ機能的な意義はあまり明確に議論されていない。リガンド結合ポケット上部の “lid” 構造に関していえば、この構造の有無がリガンド結合・解離にどのような影響を及ぼすのか、また脂質受容GPCRにおいて特にこの “lid” 構造がよく見られるのはなぜか、など、その機能的な役割について疑問は多く残っている。また、側面に開いた “gap” 構造はリガンドアクセス経路として受け入れられつつあるものの、生体内におけるリガンドの動態と関連づけた時の妥当性、機能的意義については更なる解析や検証が不可欠である。複数の脂質受容 GPCR の構造より、脂質二重膜中からのリガンドアクセスの可能性が強く示唆された一方、疎水的な性質を持つ脂質性リガンドが、生体内において産生された後どのような状態で存在するのか、どのリガンドが脂質膜内に存在し得るのか、についての理解は不足している。各脂質性リガンドによって産生経路は異なっており、LPAのように細胞外の産生酵素によって産生されるものもあれば、S1P のように細胞内で産生されたのち輸送体によって細胞外へと分泌されるものも存在する(文献23、24)。関与する産生酵素や輸送体の性質次第で、リガンドが遊離状態を経て近傍の受容体に受け渡される場合もあれば、産生されたリガンドが脂質二重膜の内部に直接分泌される場合も考えられる。さらに、細胞外における脂質性リガンドの輸送には、脂質結合タンパク質や脂質小胞も関与しており、これらを経由してリガンドが標的細胞へと受け渡される可能性も考えられている(文献25、26)。各脂質性リガンドの生体内での振る舞いに着目し、そのリガンドが生体内で実際に脂質二重膜中に存在するのか、対応する受容体はそのリガンドを受容するのに適した “gap” を持っているのか、を関連づけて議論していくことが、“gap” 構造が持つ機能的な意義の理解、ひいては脂質性リガンドによるシグナル伝達の全容の理解にとって、今後必要になってくるだろう。加えて、“gap” 構造が持つダイナミクス、すなわち、“gap” 構造が常に形成されているのか、開閉を繰り返しているのか、についても、検証を進める必要がある。特に、TM1 と TM7 の間の “gap” 構造が持つダイナミクスについては、受容体活性化機構との関連も示唆されている。この構造的特徴が受容体活性化にとってどのような影響を及ぼすか、を理解する上でも、脂質受容GPCRにおける受容体活性化機構の解明が期待される。このように、各受容体の構造情報とその受容体の性質をつなぎ合わせて理解していくことが、脂質性リガンドとその受容体によるシグナル伝達をより深く理解していく上での今後の課題なのかもしれない。
近年、多数の GPCR 構造が報告されており、それらの全てについて最新の情報を把握し続けることは、特に構造生物学者以外にとっては難しい。事実、本稿の改訂中にもカンナビノイド受容体 CB2 の阻害剤結合状態の構造(文献27)と、作動薬結合状態の CB1 と三量体 G タンパク質 Gi との複合体構造(文献28)が報告されており、今後も脂質受容 GPCR の構造情報は多数報告されてくるだろう。本稿は、このように急激に構造解析研究が進展していく中で、脂質受容 GPCR に関わる研究者が、現状を大まかに把握する上での一助となれば、という思いに基づき作成した。直近に報告された前述の二報の内容は本稿に反映できていないものの、本稿を2018年末までの現状をまとめたものとして、個別の論文に当たる上での入り口として活用いただければ幸いである。
文献
- Shimizu, T. Annu. Rev. Pharmacol. Toxicol. 49, 123–150 (2009)
- Alexander, S. P. et al., Br. J. Pharmacol. 174 Suppl, S17–S129 (2017)
- Kihara, Y., Maceyka, M., Spiegel, S. & Chun, J. Br. J. Pharmacol. 171, 3575–3594 (2014)
- Hanson, M. A. et al., Science 335, 851–855 (2012)
- Chrencik, J. E. et al., Cell 161, 1633–1643 (2015)
- Taniguchi, R. et al., Nature 548, 356–360 (2017)
- Srivastava, A. et al., Nature 513, 124–127 (2014)
- Lu, J. et al., Nat. Struct. Mol. Biol. 24, 570–577 (2017)
- Ho, J. D. et al., Nat. Commun. 9, 1645 (2018)
- Hua, T. et al., Cell 167, 750–762 (2016)
- Shao, Z. et al., Nature 540, 602–606 (2016)
- Hua, T. et al., Nature 547, 468–471 (2017)
- Hori, T. et al., Nat. Chem. Biol. 14, 262–269 (2018)
- Cao, C. et al., Nat. Struct. Mol. Biol. 25, 488–495 (2018)
- Wang, L. et al., Mol. Cell 72, 48–59 (2018)
- Morimoto, K. et al., Nat. Chem. Biol. 15, 8–10 (2019)
- Audet, M. et al., Nat. Chem. Biol. 15, 11–17 (2019)
- Toyoda, Y. et al., Nat. Chem. Biol. 15, 18–26 (2019)
- Fan, H. et al., Nat. Chem. Biol. 15, 27–33 (2019)
- Sayama, M. et al., J. Med. Chem. 60, 6384–6399 (2017)
- Zhang, K. et al., Nature 509, 115–118 (2014)
- Zhang, J. et al., Nature 509, 119–122 (2014)
- Aoki, J., Inoue, A. & Okudaira, S. Biochim. Biophys. Acta - Mol. Cell Biol. Lipids 1781, 513–518 (2008)
- Takabe, K. & Spiegel, S. J. Lipid Res. 55, 1839–1846 (2014)
- Christoffersen, C. et al., Proc. Natl. Acad. Sci. U. S. A. 108, 9613–9618 (2011)
- Record, M., Silvente-Poirot, S., Poirot, M. & Wakelam, M. J. O. J. Lipid Res. 59, 1316–1324 (2018)
- Li, X. et al., Cell 176, 459–467 (2019)
- Krishna Kumar, K. et al., Cell 176, 448–458 (2019)


