概要
X 線結晶構造解析は、タンパク質の構造から機能を明らかにするために重要な解析手法である。一般的に、回折実験を行うために作製されたタンパク質の結晶は、結晶化溶液中から取り出す必要があり、抗凍結剤を用いたクライオ凍結の処理が施される。この凍結処理により、放射光からの損傷を著しく低減したデータ収集が可能となり、また、ドライシッパーでの輸送や保存、そして高効率なデータ収集として自動測定や遠隔測定が可能となった。しかしながら、タンパク質の結晶は多くの水分を含むため、抗凍結剤の添加などに弱く、試料ごとに最適なクライオ条件の検討が必要とされる。また、これまでに、多くのタンパク質結晶についてクライオ条件での構造解析が行われてきたが、室温で解析された構造と比較すると薬剤結合部位において側鎖構造が異なることも報告されている(1,2)。このような状況に加えて、近年、短パルス X 線源である X 線自由電子レーザー(XFEL)を光源とした動的構造解析(3,4)の手法が進展したことで、非凍結環境での測定が見直され、室温測定の手法開発が進んでいる。
我々が開発を進めてきた Humid-Air and Glue-coating Method(HAG 法)は、水溶性高分子で結晶をコーティングし、調湿気流を結晶に吹き付けることで、結晶周辺の水分を高分子が取り込み、結晶の質を安定に保持する手法である。本法は、室温だけでなく、凍結操作にも対応可能である(5)。開発当初の調湿装置は室温での調湿制御のみであったが、改良が進み温度4℃~20℃の間で50~100%RH(relative humidity)の湿度を制御することが可能となった(図1A)(6)。温度制御可能なワークベンチも開発したことにより、4℃~20℃の間で結晶をハンドリング可能となった(図1B)。これらの手法と装置を用いることで、4℃で結晶が生成されるチトクロム酸化酵素(CcO)の結晶を、温度条件を変えることなく回折実験に供することが可能となった。また、SACLA においては、4℃で CcO 結晶の光励起による時分割実験を行い、一酸化炭素と CcO との反応に伴う CcO の立体構造の時間変化を追跡し、水素イオンの逆流防止機構を明らかにすることができた(7)。
SPring-8 では、土壌細菌由来の銅含有アミン酸化酵素(AGAO)の結晶を用いて、温度を(4–20℃)制御し、設定した環境(温度、pH)で平衡状態に達した構造を決定することで、熱力学的パラメータを求めている(8)。
本稿では、HAG 法で回折実験を行う際の結晶のハンドリング操作から調湿条件の最適化と回折データ収集を行うまでを解説する。
装置・器具・試薬
HAG 法を用いた回折実験には、通常の回折計の装置群に加えて、クライオ気流の退避機構、調温調湿ガス吹き付け装置が必要である。また、結晶のハンドリングを行うための温度制御ワークベンチも試料を測定する回折計の近くに設置する必要がある。
これらの実験環境は、SPring-8 のビームライン BL26B1 で使用可能であり、BL41XU においても実験環境の準備を進めている(2022年現在の環境)。
結晶のコーティングに使用する水溶性高分子の溶液としてポリビニルアルコール(PVA)の溶液を使用する。この溶液もビームラインで準備しており、詳しい組成などは実験手順に記載する。
実験手順
- 実験の準備
- 試料のハンドリング
- PVA 溶液の選定
- PVA をループに張る操作
- 結晶のマウントと回折計への結晶の設置
- 湿度の最適条件検討と非凍結データ測定
- 結晶の質を保てる湿度範囲の検討
- 最適湿度の検討
- 条件検討で確認する事項
- 非凍結データ測定
- クライオでの凍結操作
実験の詳細
1. 実験の準備
温度制御ワークベンチは、4–20℃の間でベンチ内を調温できる(図1B)。このワークベンチは、周囲の温度を一定に保ったまま素手で試料をハンドリングできることが特徴である。結晶のハンドリングを行う前に、ワークベンチ内に使用する機器(ループ、ワンド、トング、ピペット、チップ、PVA 溶液など)を全て入れ、ワークベンチ内で温度を平衡化しておく。
SPring-8 では現在、平均重合度4500の PVA(日本酢ビポバール社製)を使用している。PVA 溶液の粘度は、同じ濃度%(w/v)で比較すると重合度が低いほど低下する。PVA 溶液の粘度が低下すると、結晶をピックアップした際に PVA 溶液中の水が結晶へ浸透して損傷し易くなるため、注意が必要である。他の近い重合度の PVA は、平均重合度3500の PVA が富士フィルム和光純薬株式会社などでも購入できる。
2. 試料のハンドリング
我々は、標準の Glue として重合度4500の10%(w/v)PVA 溶液を使用している。結晶をコーティングした PVA 溶液は、湿潤空気と結晶の間で Buffer となり急激な湿度変化から結晶を保護する。さらに、調湿して PVA 溶液が濃縮されるとフィルム状になり、結晶の位置を固定することができる。しかし、結晶化溶液に含まれる多価陰イオン(たとえば、\(\ce{PO4^{3-}}\),\(\ce{SO4^{2-}}\))は PVA と結合してゲル化し、コーティングする機能を失ってしまう。その場合には、Glycerol と Ethylene glycol を、PVA の可塑剤として作用させる。この Glycerol や Ethylene glycol を PVA 溶液に事前に混ぜて調整して使用することで、ゲル化を防ぐことができる。SPring-8 では、Glycerol や Ethylene glycol を0,5,10,20%(w/v)添加した複数の PVA 溶液を準備している。一般的に、Glycerol や Ethylene glycol を5%程度加えた結晶化溶液に結晶をソーキングすると、PVAのゲル化をより効果的に防ぐことができる。
2-1. PVA 溶液の選定
結晶化溶液に含まれる陰イオンの種類や濃度によって、初めに使用する PVA 溶液を選定する。
- a)結晶化溶液に多価の陰イオンを含まない
- PVA を10%(w/v)含む溶液、もしくは、PVA に Glycerol や Ethylene glycol を5%(w/v)添加した PVA 10%(w/v)溶液を使用する。
- b)結晶化溶液に2価の陰イオン数百 mM を含む
- Glycerol や Ethylene glycol を5%程度加えた結晶化溶液に結晶をソーキングした後、PVA に Glycerol や Ethylene glycol を 5 or 10%(w/v)ほど添加した PVA の10%(w/v)溶液を使用する。
- c)結晶化溶液に2価の陰イオン 1 M を超える濃度を含む
- Glycerol や Ethylene glycol を5%程度加えた結晶化溶液に結晶をソーキングした後、PVA に Glycerol や Ethylene glycol を10または20%(w/v)ほど添加した PVA の10%(w/v)溶液を使用する。
2-2. PVA をループに張る操作
PVA 溶液を爪楊枝の先で 5–10 µL 程度(米粒程度)すくい取り、ガラス板上に移す。続いて、PVA 溶液をループ内に貼る(図2A,B)。ループ内の PVA の厚さは、40–60 µm 程度に調整する。使用するループは、結晶よりも大きいサイズを選定する。ループが小さく、結晶がループの中に収まらないと、結晶がループに当たり損傷を受けることがある。
2-3. 結晶のマウントと回折計への結晶の設置
結晶はループ内の PVA 溶液の部分に貼り付けて取り出す(図2C,D)。この操作時に結晶と周囲の溶液も一緒に取り出してしまうが、ある程度の量であれば溶媒は PVA に取り込まれる。温度制御ワークベンチ内で結晶のハンドリングを行った後は、ワークベンチ内の温度で平衡化しておいたトングで試料ピンを挟み(図2E)、ワークベンチから取り出して直ぐに目的温度に調整した保冷剤で保護しながら(図2F)、実験ハッチ内のゴニオメータに取り付け(図2G)、調温調湿気流を吹き付ける(図2H)。温度を適切に管理することで、4℃などの低温を含む幅広い温度で生成された結晶などに対応できる。
3. 湿度の最適条件検討と非凍結データ測定
非凍結での X 線回折実験による放射線損傷は、クライオ測定と比較して50–100倍にもなる。我々は、HAG 法を用いた室温での Serial Synchrotron Rotation Crystallography(SS-ROX)実験の結果より、Dose 量 200 kGy 以下での実験を推奨している(9)。Dose 計算は RADOSE3D(http://www.raddo.se/)を使用し、RADOSE3D で算出された MAX DOSE の値を用いている。
3-1. 結晶の質を保てる湿度範囲の検討
開始湿度は、85–90%RHに設定する。結晶マウント後から、以下の 3-3 に記載した3点を3–5分毎に連続して確認し、結晶の質を保てる湿度範囲を検討する。この検討は、2.5–5.0%ずつ湿度を変更しながら行う。質の確認ができないほど損傷を受けた場合、新しい結晶で検討を再開する。
3-2. 最適湿度の検討
次に、0.5–2.5%RH の範囲で湿度を変更し、最適湿度を決定する。PVA 溶液中の水分が揮発して飽和水蒸気圧に達した後に、結晶の位置が固定されるため、最適湿度で15–20分程度の放置時間が必要である。リゾチーム結晶を PVA 溶液(5% Ethylene glycol 添加)でマウントし、湿度 85%RH の調湿環境下に設置した例を図3に示す。適した湿度条件下では結晶周囲の PVA 溶液が乾燥し、収縮する。20分程度まで放置すると、結晶周囲の PVA 溶液はフィルム化し、結晶の位置が固定される。
固定化後にクライオ凍結する場合、結晶周囲の PVA 中の水分が均一でないと、凍結時に ice-ring を形成して結晶を損傷してしまう。この場合も同様に予め15–20分程度放置してからクライオ凍結の操作を行う。
3-3. 条件検討で確認する事項
- a)結晶周囲の PVA 溶液の体積変化
- 結晶観察開始時に比べて PVA 溶液の体積が減る場合、安定湿度範囲もしくは乾燥側の不安定な湿度である可能性がある。PVA 溶液の体積が減り続けている状態では、PVA 溶液がバッファーとなって結晶の乾燥を防いでいる。しかし、数分でフィルム化が進み、結晶も湿度に応答するため、回折像の確認と共に判断する必要がある。
体積が増える場合は過湿側の不安定な湿度であり、早急に湿度を下げる必要がある。
また PVA がゲル化した場合、溶液と結晶が閉じ込められた状態となり、大きく湿度を下げても PVA の体積が変わらず回折像に変化がない。このような場合、可塑剤の添加量を増やして再度結晶をマウントする必要がある。 - b)結晶表面の変化
- 過湿側、乾燥側共に不安定な湿度範囲の場合、結晶表面にヒビが入る事がある。安定側の湿度に変更することでヒビの回復が見られる事もある。回折像の確認と共に判断する必要がある。
可塑剤の濃度が高すぎる、過湿側の不安定な湿度範囲などの場合、結晶が溶ける事がある。この様な状態は回復できない状態である事が多いため、添加した可塑剤の濃度が低い PVA 溶液へ変更する、開始の湿度を下げるなどして再度結晶を設置する必要がある。 - c)回折像の分解能、回折点の形状、Mosaicity、格子長の変化
- 回折像で分解能や回折点の形状を確認するのであれば、1枚の画像を取得すれば可能である。しかし、格子長の確認を行うために、XDS(https://xds.mr.mpg.de/)などのプログラムで処理を行うためには、5–10° 程度の範囲のデータ測定を行う必要がある。
3-4. 非凍結データ測定
これまでの条件検討で照射した Dose 量を計算し、その分も含めて Max Dose 200 kGy 以下となる条件でのデータ収集を推奨する。X 線のビームサイズよりも結晶が大きい場合、回転軸方向に対して垂直な方向(SPring-8 であれば Y 軸方向)へ移動が可能な結晶体積があれば、ヘリカル測定を実施することで、より効率的なデータ収集が可能である。(SPring-8 での回折データ収集の詳細については、高輝度光科学研究センター構造生物学推進室のホームページ(http://stbio.spring8.or.jp/)に詳細な記載がある)。
4. クライオでの凍結操作
調湿状態の結晶は、クライオ気流へ素早く切り替えることで凍結が可能。我々は実験の再現性を得るために、自動でflash-coolingとre-humidity controlledへの切り替え動作をする機構を導入した。切替システムの全体動作は20秒であるが、気流が切り替わる時間は 0.1 sec 程度である。
実験例
リゾチーム結晶は、幅広い湿度範囲(70~90%RH 程度)で安定に保持できる(5)。リゾチーム結晶を8%(w/v)PVA 溶液でマウントし、湿度 80.4%RH の調湿気流中で静置し、結晶の格子定数、Mosaisity の経時変化を確認した(図4)。
20分までは2分毎、それ以降140分まで6分毎に回折像を取得し、HKL2000 で処理を行い、格子定数、Mosaicity を求めた。格子定数、Mosaisity は、20分程度まで変化し続けた。20分を過ぎると結晶の格子定数、Mosaisity 共に安定した。図3に示した調湿気流中の結晶観察の結果においても、結晶に調湿気流を吹き付けた直後から20分経過するまで PVA 溶液は収縮し続けた。その間、PVA 溶液に包埋された結晶は PVA 溶液の収縮によってループ内で位置が移動していた。20分後、結晶周囲の PVA 溶液は周囲の湿度と平衡となり、濃縮されてフィルム化(図3 20 min 後の様子)して結晶の位置も固定され、非凍結の環境で高精度なデータ測定が可能な状態となった。
工夫とコツ
1. 実験の準備
これまでの実験から、結晶は温度変化により質が劣化するケースが多く見受けられた。特に4℃などの低温で生成された結晶は、結晶観察を室温で行う、結晶のハンドリングを室温で行うなどの昇温による損傷により、調温調湿環境で結晶の質を保持できなかった。20℃で作成した結晶についても、室温が26–27℃で損傷するケースもあるため、結晶成長を確認する際の温度にも気をつける必要がある。結晶を SPring-8 へ運搬する際など長時間の保温を必要とする場合には、発泡スチロールの箱の中に結晶化プレートとともに保冷剤を使用するなどを勧める。また、イソプロパノールなど揮発性溶媒を結晶が条件に含む場合、調湿実験中に揮発して結晶が劣化する場合がある。
2. 試料のハンドリング
2-1. PVA 溶液の選定
今回記載した PVA 溶液は、ビームラインに準備しているため、ユーザーは結晶化溶液に添加する Glycerol や Ethylene glycol を準備すれば良い。
事前にクライオ実験を行ったことがある結晶については、抗凍結剤として Glycerol と Ethylene glycol のどちらが低損傷で凍結できたかの情報があれば、PVA に加える可塑剤としてどちらが適当か判断できる。可塑剤としての効果は Ethylene glycol の方が強い。
2-2. PVA をループに張る
ガラス板に取り出した PVA は、10分程度で乾燥して粘度が増してフィルム化するため、再利用できない。
2-3. 結晶のマウントと回折計への結晶の設置
結晶周囲の溶液の量が多すぎる場合、PVA のゲル化が促進されて溶媒と共に結晶を閉じ込めてしまい、調湿による環境変化が起きにくくなる。結晶を取り出した際には、クライオ凍結操作を行う時と同様に、ループを立ててガラス板へ余分な溶液を移すなどの操作を行うと溶媒減らすことができる。また、結晶化ドロップに膜が張っている場合、膜を除去してからマウントの操作を行う。
3. 湿度の最適条件検討と非凍結データ測定
PVA がゲル化して溶液と結晶を閉じ込めた状態は、周囲の湿度変化に鈍感となり、結晶を結晶化溶液から取り出した時に近い状態を保持しているので、回折像を確認して結晶の質を確認しておくことは、湿度の検討を行う上で重要な情報である。
実験の安全
- 温度制御チャンバー内で作業を行う際に、アクリル板越しに操作を行うため、操作を行う距離感がずれて感じることがある。事前に作業内容を確認してから行うこと。
- 温度制御チャンバーを4℃など低温で使用する際は、未使用時に手を導入するポートを必ず封じること。開けたままで放置すると、外部から水分を吸い込み内部が結露する原因となる。
文献
- Fraser, J.S. et al., Nature, 462, 669–673 (2009)
- Fraser, J.S. et al., Proc. Natl. Acad. Sci. USA, 108, 16247–16252 (2011)
- Chapman, H.N. et al., Nature, 470, 73–77 (2011)
- Nango, E. et al., Science, 354, 1552–1557 (2016)
- Baba, S. et al., Acta Cryst., D69, 1839–1849 (2013)
- Baba, S. et al., J. Appl. Cryst., 52, 699–705 (2019)
- Shimada, A. et al., Sci. Adv., 3, e1603042 (2017)
- Murakawa, T. et al., Proc. Natl. Acad. Sci. USA, 116, 135–140 (2019)
- Hasegawa K, et al., Acta Cryst., D77, 300–312 (2021)
-

図1:使用する装置の外観
(A)回折計に設置した温度制御調湿装置。(B)温度制御ワークベンチ。 -

図2:試料のハンドリングの様子
(A),(B)PVA 溶液をループ内に貼る操作。(C),(D)PVA 溶液を張ったプールを使用し、結晶化ドロップから結晶を取り出す操作。(E)温度制御ワークベンチ内で温度を平衡化したトングへ試料ピンを取り付ける。(F)ワークベンチの外での温度変化を防ぐために、トングを保冷剤で保護する。(G)トングで回折計に試料ピンを設置する。(H)試料位置に調温調湿気流のノズルを設置する。 -

図3:結晶を設置した調湿気流中(湿度85%RH)での経時変化
結晶を設置し、調湿気流中でセンタリング操作を行った後の結晶の様子を回折計の同軸カメラで記録。結晶を設置した時間を起点として1分後から20分後までの変化の様子。 -
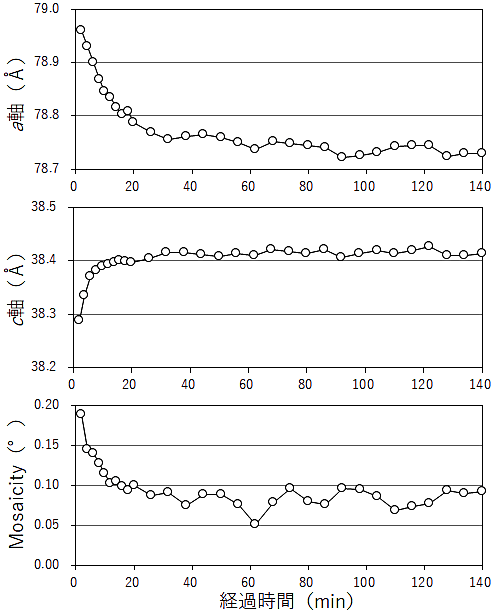
図4:結晶を設置した調湿気流中(湿度80%RH)での格子定数、Mosaisity の経時変化


