概要
イオン交換カクロマトグラフィーは、大量のタンパク質を高い分解能で分画することができることから、タンパク質の初期精製から最終精製まで、非常に幅広く使用されるクロマトグラフィーである。現在、イオン交換クロマトグラフィーに使用されるイオン交換体には、さまざまな担体があり、タンパク質を精製する時に、これらの担体を使いこなすことにより、純度の高いタンパク質を得ることができる。本プロトコールでは、タンパク質精製の鍵となるイオン交換クロマトグラフィーの使用方法について一例を挙げて解説する。
原理
イオン交換クロマトグラフィーは、タンパク質の表面電荷とpHの関係が固有であることを利用して分離する手法である。イオン交換クロマトグラフィーの担体であるイオン交換体は、陰イオン交換体(正に帯電した担体)と陽イオン交換体(負に帯電した担体)の2つに分けられる。タンパク質は、等電点(pI)と等しいpHでは、電荷がゼロとなるため、可溶化しない。pIより塩基性のpHに可溶化したタンパク質は、負に荷電し陰イオン交換体と結合する。また、pIより酸性のpHに可溶化したタンパク質は、正に荷電し陽イオン交換体と結合する。
装置・器具・試薬
- AKTA explorer 10S (GE Healthcare)
- MonoQ 5/50 GL (GE Healthcare)
- バッファーA [20 mM Tris-HCl(pH7.5), 5 mM EDTA, 5 mM 2-mercaptoethanol, 10% glycerol] 200 mL
- バッファー B [20 mM Tris-HCl(pH7.5), 5 mM EDTA, 5 mM 2-mercaptoethanol, 10% glycerol, 1M NaCl] 200 mL
バッファーには、2-mercaptoethanolが含まれているため長期保存したい場合には、2-mercaptoethanolを抜いた組成で4℃保存し、使用する直前に加えると良い。
実験手順
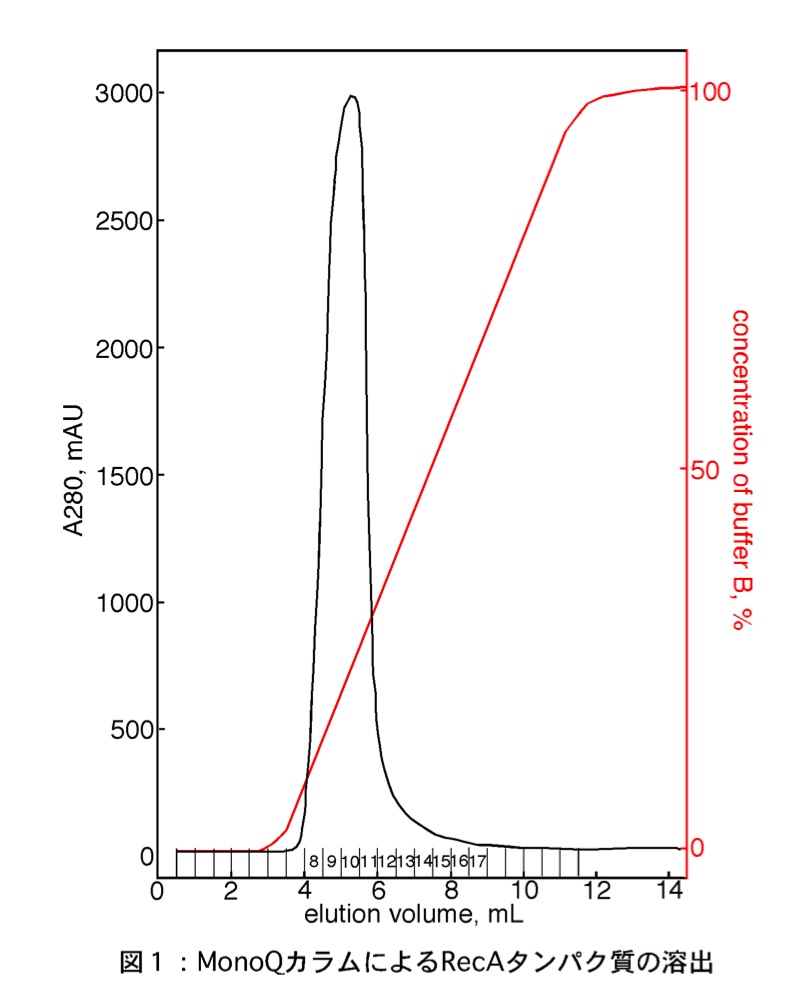
イオン交換クロマトグラフィーを使用したタンパク質精製の一例として、相同的DNA組換えタンパク質である大腸菌RecAタンパク質の最終精製課程における陰イオン交換体を用いた精製について紹介する。RecAタンパク質は、分子量37,973、pI 5.09のタンパク質である。RecAタンパク質の可溶化バッファーをpH 7.5とすると、pI値よりも高いため陰イオン交換体に吸着することが考えられる。本プロトコールでは、陰イオン交換体の1つであるMonoQ 5/50 GL(GE Healthcare)を使用する。MonoQは、非常に高い分離能と高い結合容量を有する多孔性粒子であるMonoビーズ基盤とし、イオン交換体としてQuaternary ammonium (Q)を持つ強陰イオン交換体である。メーカーの取り扱い説明書によるとMono Qの結合容量は、HSAを用いた場合65 mg/ml gelである。MonoQ 5/50 GLは、カラム容量が約1 mLであり、スケールアップしたい場合は、カラム容量が8 mLのMonoQ 10/100 GL を使用するとよい。MonoQカラムに使用するバッファーおよび添加するタンパク質は、HPLCの流路の詰まりを防ぐため、あらかじめ0.22μmのフィルターに通しておく。
1)カラムの平衡化
2)タンパク質の添加
3)カラムの洗浄
4)タンパク質の溶出、分画
5)溶出されたタンパク質の確認
6)カラムの洗浄
実験の詳細
- MonoQカラムを10カラム量のバッファーA で平衡化する。MonoQのメーカー推奨流速は、0.5~3.0 mL/min、限界圧が4 MPaである。バッファーの組成やタンパク質の量により圧が上がってしまうことがあるので、筆者は流速0.5 mL/minで行うことが多い。
- 10カラム量のバッファーAで平衡化されたMonoQカラムにRecAタンパク質(バッファーAに透析済み)を添加する。
- 10カラム量のバッファーAでカラムを洗い非吸着タンパク質を取り除く。
- バッファーAとバッファーBを用いてリニアグラジエントにより、10 カラム量でRecAタンパク質をフラクションコレクターで分画しながら溶出する(図1)。
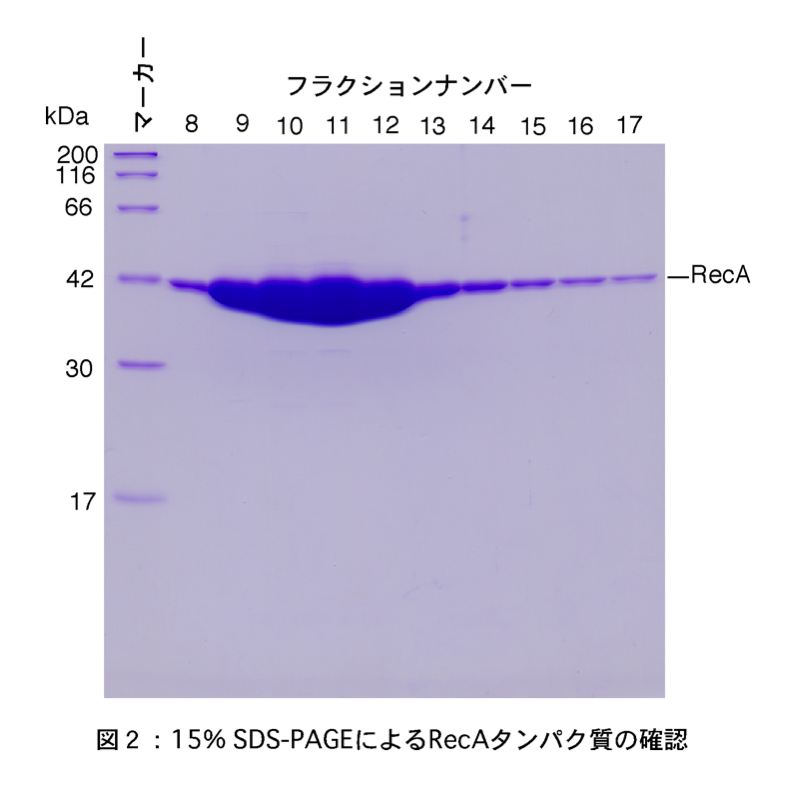
- タンパク質の溶出画分をSDS-PAGEし、RecAタンパク質を確認する(図2)。
- タンパク質の溶出が確認できたらカラムを超純水に置換する。その後、2 M NaCl、2 M NaOH、75% 酢酸の順番でカラムを洗浄する。タンパク質のカラムへの吸着が多い場合には、この洗浄を何度か繰り返す。
工夫とコツ
カラムの選択
現在、多くのイオン交換体が市販されており、荷電基や荷電基が結合している樹脂の素材が様々である。タンパク質がイオン交換体と結合する力は、静電力の強さ他や、僅かではあるがファンデルワールス力や非極性相互作用がある。そのため、様々なイオン交換体を試してみることが、純度の高いタンパク質を得る近道である。本プロトコールで紹介したRecAの精製に用いた陰イオン交換カラムは、プレパックカラムであるMonoQカラムであるが、DE52 (Whatman)使用し精製することも可能である。筆者がMonoQカラムを使用している理由は、最終精製段階での濃縮率が高いためである。筆者が所属する研究室では、タンパク質の最終精製段階でMonoQや陽イオン交換体であるMonoSをよく使用する。精製の検討段階で、これらのカラムを試してみると強イオン交換体のため、カラムに吸着して溶出されないことも時々起こる。検討段階においては、カラムに吸着したからといって、精製中のタンパク質全量を投入してしまうと、悲しい結果になることがあるので気をつけてもらいたい。
バッファーの検討
それぞれのタンパク質の表面電荷は、そのタンパク質が可溶化している溶液のpHにより変化する。よって、様々なイオン交換体を選ぶとともに、タンパク質の可溶化している溶液のpHを検討する必要もある。バッファーのpHを変化させることにより、分離したい各タンパク質の表面電荷の差が生じ、高い分離能を得ることができる。
溶出条件の検討
交換クロマトグラフィーにおけるタンパク質の溶出は、基本的にイオン強度を高める(塩濃度を上げる)ことにより行われる。その方法として、リニアグラジエントとステップワイズがある。主に前者は、分離したいタンパク質がある場合に使用し、後者は、一気に目的タンパク質を溶出し濃度を稼ぎたい場合に使用する。