概要
ラマン光学活性(Raman Optical Activity, ROA)分光法により、溶液中蛋白質の二次構造と、その変化を分析することが可能である。本稿では、ROA分光を、NMRの適用が難しい速い構造平衡にあるタンパク質や会合体、コロイド系に適用した例を述べる。また、ROA分光法の測定法の詳細についても解説を行う。
イントロダクション
ラマン光学活性(Raman optical activity, ROA)は、天然非定形蛋白質や部分的非定形構造を持つ蛋白質など、柔軟な溶液中二次構造の解析を可能とする新たな分析手法として注目されている。本稿では蛋白質のROAスペクトルの測定法の実際と、ROAスペクトルから分かる蛋白質二次構造について、実測のスペクトル(ヒト血清アルブミンおよびウシ脾臓由来インスリン)を用いて解説を行う。
溶液中蛋白質の構造決定にはNMR分光法がよく使用され、その研究の歴史は長く、応用も広くなされている。しかしNMR分光法の適用の難しい系については、他の測定法による構造解析が必要となってくる。例えば、アミロイド線維などの変性蛋白質、天然で非定形である蛋白質、非定形構造を含む変性過程の構造中間体、溶液中で会合平衡にある蛋白質などである。また、NMRのスペクトル時定数はミリ秒からマイクロ秒と遅いことから、速い構造平衡にある系ではスペクトルが平均化されて認識されてしまう。
一方ROAは溶液中蛋白質の二次構造に鋭敏な分光法であり(1,2)、ラマン散乱現象に基づくためスペクトル時定数はピコ秒程度と非常に速く、ナノ秒以下の速い構造平衡系でも平均化なく構造解析することが可能である(3)。一般的に蛋白質のラマンスペクトルには主鎖に由来する蛋白質骨格ピークだけでなく、例えばチロシン、フェニルアラニンなどの側鎖のラマンピークもかなり強く現れ主鎖のピークと重なりスペクトルが複雑になるが、一方ROAスペクトルは主に主鎖のピークに支配される為、蛋白質主鎖構造を分析する際にはより便利である。紫外円偏光二色性(UVCD)分光が蛋白質二次構造に鋭敏であることはよく知られているが、ROA分光は振動準位での分子キラリティを測定する為、UVCDと比べて、分子構造に関する情報がより豊富に得られる。
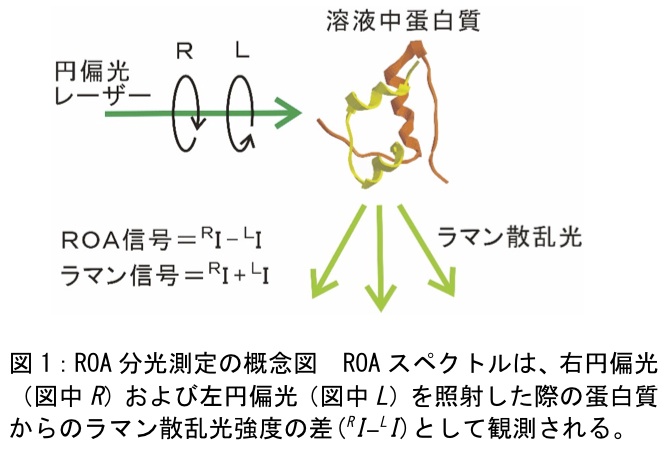
ROAは左右円偏光に対するラマン散乱光強度の差として測定される(図1)。励起レーザー光が右円偏光の時に測定されたラマン散乱強度 RI と左円偏光の時の強度 LI との差 (RI-LI)がROA信号強度である。測定対象分子がキラルである場合(蛋白質、アミノ酸、DNA、糖、脂質など)、このROA信号は正または負の値を持つ。この差はラマン光強度全体(RI+LI)と比べて10-3以下と非常に小さく、これは RI と LI のスペクトルを目視で比較しても認識できないほどの小さな差異である。この為、ROA測定装置には、光学部品の非理想性に由来する装置誤差を十分抑制することと、ラマン信号強度を多く得てS/Nを上げることの二つが同時に要求される。これは難しいものであり、1973年にBarronによって初めてROAスペクトルが測定されて以降(4)、装置の作製技術を持つ研究室でしか測定が行われてこなかった。しかし、1999年のHugによる装置の改良によって(5)、2000年付近に市販品が販売されるに至り、誰でも測定が可能となった。現代の洗練されたROA装置を用いればルーティンに測定が行える。
ROA測定は後方散乱、90度散乱、前方散乱のどのラマン測定配置でも可能である。しかし非共鳴振動ROAにおいては、ROA強度とラマン強度の比は後方散乱配置が最も強く、前方散乱配置が最も弱くなる。その為現在一般的な測定配置は後方散乱配置である。配置によって測定されるROAスペクトル形状が異なるので、配置の異なるROAスペクトル同士を比較する際には注意が必要である。ROA測定にはさらに、入射光の左右円偏光を変調させる入射円偏光(Incident Circularly Polarized; ICP)、ラマン散乱光の左右円偏光の強度差を測定する散乱円偏光(Scattered Circularly Polarized; SCP)、入射光およびラマン散乱光の左右円偏光をどちらも変調する双円偏光(Dual Circularly Polarized; DCP)の三つの測定方法が存在する。市販のROA測定装置は後方散乱配置SCP測定法を採用している。
結晶構造既知の蛋白質のROA測定から、蛋白質二次構造に特徴的なROAバンドの帰属がなされており、ROAスペクトルから二次構造を特定することが可能である。特に興味深いのは、“水和したαへリックス”やPP-IIへリックス構造に特徴的なROAピークが特定できる点である(1)。「ROAスペクトルの解析」の項で例示するように、これら経験的な帰属からも蛋白質の構造を解明できる。また、近年では量子力学計算による蛋白質のROAスペクトルの再現および帰属も報告され始めた。
装置・器具・試薬
- ラマン光学活性測定装置(自作(6)もしくは市販品 BioTools.Inc)
- 試料セル(市販もしくは自作品)
- ヒト血清アルブミン (凍結乾燥粉末をSigma社から購入)
- ウシ脾臓由来インスリン(粉末をSigma社から購入)
実験手順
1)試料調製
2)試料セルについて
3)ROA装置の設置場所について
4)ROAスペクトル測定
5)ROAスペクトルの解析
実験の詳細
1)試料調製
ノイズと装置誤差の十分小さなROAスペクトルを測定する為には、試料の調製に注意を払う必要がある。
まず試料を調製する為のガラス容器を用意する。ROA測定に必要なタンパク質試料濃度は10-5w%と非常に濃厚で粘度が高く、かつ溶液全体量は20-100μlと少量であることを考慮して、容積の小さなガラス容器を用いる。内径5mm程度のガラスチューブが適している。今回測定試料としたヒト血清アルブミン(以下アルブミン)またはウシ脾臓由来インスリン(以下インスリン)の粉末をガラス容器に秤りとる。そこへ緩衝液を20-100μl入れ、溶かす。その際気泡が発生しないように注意して溶かす。溶液の粘度が高い為、気泡は容易には消滅しない。蛋白質溶液のpHをpH試験紙またはpHメーターで確認する。微小電極を用いたpHメーターによる測定には20-50μlの試料溶液が必要である。
インスリンアミロイド線維は、インスリン溶液を82度の空気浴中で10-20分加熱することで作製する。加熱時間が長すぎると、アミロイド線維が大きな凝集体を生成し、それによる複屈折および多重散乱によりROAスペクトルの基線が大きく0からずれ、正確な測定が不可能となる。その為、ラマンスペクトルを測定しながら、アミドIのピークシフトが高波数シフトしきった時点で過熱を止めるのがよい。測定は室温で行う。
試料溶液中の埃や塵はレーザー光、ラマン散乱光の乱反射を引き起こし、それらの偏光特性を変えてしまう。乱反射した光の一部はセル壁の反射などにより検出器に到達し、偽のROA信号を生み出しうる。これを回避する為には、測定直前にメンブランフィルターで塵埃を取り除くと良い。また、試料調製に使うガラス器具や保存容器をよく洗浄し、使用する溶媒も濾過しておくことが効果的である。
ROA分光法はラマン散乱光強度の微小な差を検出する為、蛍光性の不純物や、白濁した試料ではROA信号が背景により覆い隠されたり、ベースラインが大きくゼロから外れたりして、測定が困難になる。
白濁試料については、試料濃度を抑える、溶媒を変える、界面活性剤などの可溶化剤を加えるなどして、透明な試料溶液にする必要がある。現代のROA装置では、試料濃度は10w%程度が測定時間の点から最適であるが、5w%まで下げても測定は可能である。
蛍光背景は常にラマン分光にとって困難な障壁である。一般的に蛍光強度はラマン散乱光より何桁も強い為、極微量の蛍光性不純物であっても測定の障害となる。試料の精製だけでは蛍光背景を抑えられない場合は、以下のような解決策が適用できる。
高強度可視光レーザーの照射による蛍光背景の削減。これは強い(100 mW 以上)のレーザーを試料に照射することで、蛍光性不純物を分解、もしくはレーザー焦点位置(ROA測定部位)から追い出すことによる。ROA測定で使用するレーザーを流用するのが簡便でよい。実際にラマンスペクトルを測定しつつ、蛍光背景が減少することを確認し、減少しきった時点でROA測定を開始する。レーザーの照射を止めると、蛍光物質の再生もしくは拡散が起こり、蛍光背景が回復することがある為、レーザー照射直後にROA測定を始めた方が良い。また、レーザー照射によって逆に蛍光性不純物が増加する場合もあり、これは実験で確かめる他ない。
微量の重金属イオン添加による蛍光背景の削減。これは微量の重金属元素を試料溶液に共存させることで蛍光を消光させる。一価カチオンのRb+やCs+を使用すると良い。
2)試料セルについて
ROA測定には1cm光路の石英セルも使用できるが、試料量の削減の為に容量100μl以下のセルを使用する方がよい。ROAは微小なラマン光強度の差を測定する為、セル壁面での光の反射も問題となる。ラマン散乱光がセル壁面で多重反射し、検出器に到達すれば、ROAスペクトルに偽信号として表れるであろう。側面に減反射コートを施したセルも販売されているが、アセトンなど有機溶媒による洗浄で容易にコートが剥離してしまう為、効果的ではない。セル側面に黒色の光を反射しないもの(黒紙など)を密着させると散乱光を削減できる。
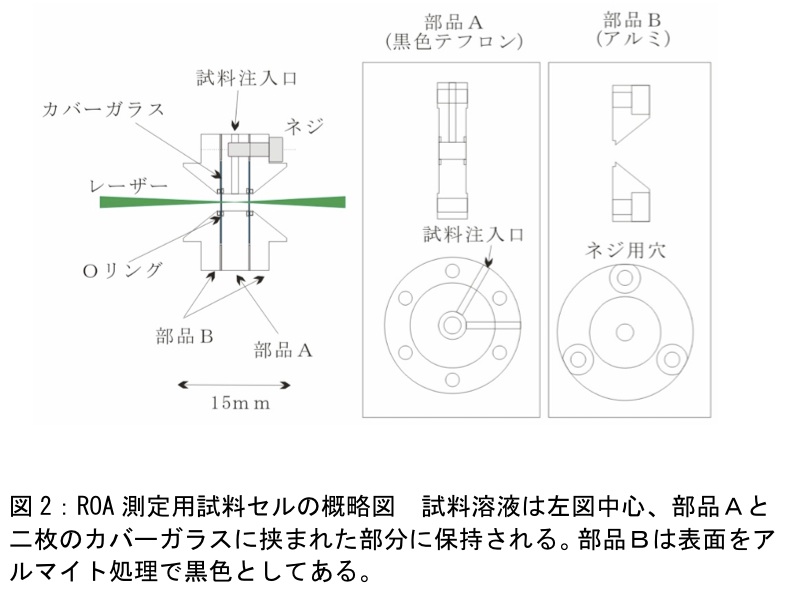
筆者らは手製のセル(図2)において黒色のテフロンをセル側面に用い、反射光を削減している。この手製セルでは、測定に必要な試料体積を20μlまで削減できる。これは、通常使用される方形セルの必要試料量が100μlであるのに対してかなり少なく、高価、貴重なキラル試料の測定には有意義である。窓材には円形カバーガラスを使用しており、取り換えが可能である。蛋白質など生体試料の測定では、レーザー照射により窓材に試料が焼き付くことが稀にある。この焼き付きは、化学的な洗浄だけでは完全に取り除くことは難しいが、窓材が安価なカバーガラスであれば交換によってこれに対応できる。窓材がカバーガラスのように薄いことは、ガラスの残留複屈折を抑える点からも望ましい。
カバーガラスを交換する際は、ガラスに負荷が掛らないよう均等にネジを締め付ける。ガラスへの部分的な負荷はガラスの複屈折を引き起こし、ROAスペクトルに偽信号を与える。
セルへの試料の封入時には、セル内に気泡が残らないよう慎重に行う。気泡表面による散乱光の反射によって、ラマン散乱光の偏光特性は大きく変化し、ROAスペクトルに誤差を生じる。特に生体試料は界面活性なものが多い為、気泡が残りやすいので注意する。もし気泡ができてしまった場合は、セルを手で振って遠心力を掛け気泡を追い出すとか、もしくは低速の遠心分離機を使用する。
セルの設置する際、光路に対して垂直に設置すべきであるが、しかし完全に垂直であると、セルによるレーザー反射光がレーザー本体に戻ってしまい、レーザー強度が不安定になる可能性がある。一方、設置角度が垂直から大きくずれると、セル壁面の直線偏光依存性が出てしまうため、傾けすぎてもいけない。戻り光もなく、かつROA背景を与えないような角度を探し、毎回その角度となるようセルホルダーの角度を設定する。
3)ROA装置の設置場所について
蛋白質など生体試料のROA測定には100mWから1W程度の比較的強いレーザー光が使用される。その為、空気中に埃塵が多いと、それらがレーザーによって焼かれ、ROA装置内部のミラーなど光学部品表面に焼き付き、測定強度の減少を引き起こす。この焼き付きは、光学部品の洗浄を行うとかなり取り除けるが、しかし市販装置の部品には取り外しの容易でない部分もあり、また洗浄作業を行うには装置組み立ての経験を必要とする。筆者の経験では、この焼き付きによってラマン散乱光強度が一か月で半分以下に下がった例がある。高価なROA装置が埃の為に使用困難になることは勿体無いことなので、ROA装置の設置場所はクリーンブース内が良いだろう。装置本体の価格に比べればクリーンブースは安い。
空気中の埃を除去することは、焼き付きの問題だけでなく、測定誤差の削減の点からも重要である。例えば、目視できるほどの大きさの埃が一つ光路上にあるだけで、レーザー光の偏光状態の純粋さは大きく下がる。
市販の装置の遮光カバーは完璧ではないので、測定時には設置部屋全体を暗くする必要がある。また、パソコンモニターの光が装置に届かないよう注意すべきである。
4)ROAスペクトル測定
まずラマンスペクトルを測定し、設定の露光時間でラマン光強度がCCDの飽和直前(16ビットCCDであれば216=65536カウントで飽和)まで検出されるようにレーザー強度および露光時間を調節する。レーザー強度を上げすぎると試料もしくは光学部品が焼けてしまう為注意する。装置を長期使用する為に、筆者は800mWを最大値と決めている。露光時間は0.5秒より短すぎるとCCDの読み出し時間が支配的となり、あまり意味がない。逆に10秒以上と長すぎると、その間にレーザー強度などが変動し、波長板を用いた補正機構が上手く働かない可能性もある。1-10秒の間で設定するのが無難である。その後、積算回数を設定し、本測定を行う。
ROAスペクトルの測定の際には、再現性を確認すべきである。特に小さなピークや肩ピークを議論する場合は必要である。同じ試料でもよいので、サンプルセルの位置を50-100μm変化させ、レーザー照射位置をずらして測定を行い、再現性を見る。これは、ガラス表面の埃や傷が擬信号を生み出す可能性がある為と、測定中に宇宙線などによりROAスペクトルにスパイクが発生する可能性があるからである。蛋白質の測定には数時間はかかるであろうから、数時間を一度の測定で終わらせるよりは、1/3の時間の測定を3回行った方がよい。
5)ROAスペクトルの解析
蛋白質のROAスペクトルの解析としては、文献との比較が最も簡便である。文献1は2000年までに明らかとなった、蛋白質二次構造に特徴的なROAスペクトルを系統的に記載しており、便利である。ターン構造およびβシート構造については文献7、水和αへリックス構造については文献8、PP-IIへリックス構造については文献9、ランダム構造については文献10が詳しい。これらを参考にされるとよかろう。
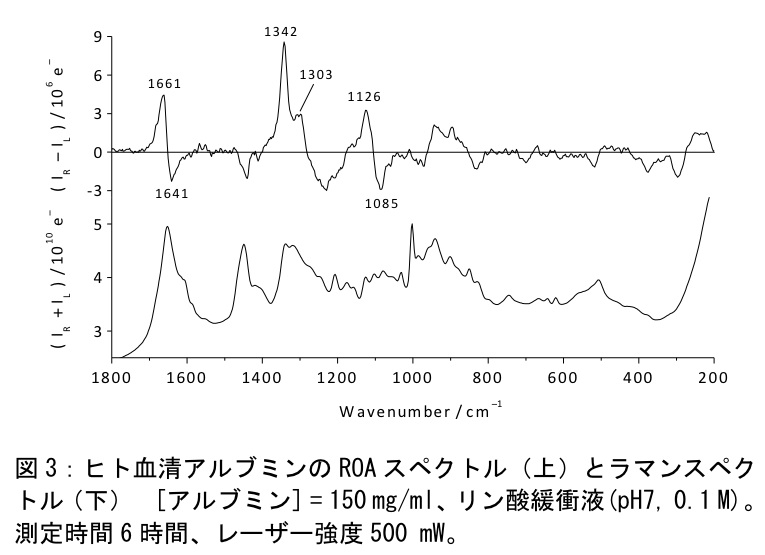
図3にアルブミンのROAおよびラマンスペクトルの測定結果を示す。ラマン強度は1010e-単位であるのに対し、ROA強度は106e-単位であることに注意されたい。このROAスペクトルの基線は強度0の線からほとんどずれていない。そのずれはノイズと同程度であり、このROAスペクトルの測定誤差は少ないと考えられる。アルブミンのROAスペクトルには水和αへリックス構造に帰属されている拡張アミドIIIバンドが1342cm-1に強く現れている。一方、1303cm-1の拡張アミドIIIバンドは疎水的環境にあるαへリックス構造に帰属されており、相対的に弱い。この結果は、アルブミンのαへリックスが疎水的環境よりも水和的環境により多く存在することを示しており、アルブミンの水への高い溶解性と矛盾しない。アミドI振動領域には強い正のROAピークが1661cm-1に、比較的弱い負のROAピークが1641cm-1に現れている。この強い正ピーク/弱い負ピークの形状のアミドIカップレットはαへリックス構造に帰属されている。このことはアルブミンの結晶構造においてαへリックス構造が68-69%を占める事実と良く一致する。
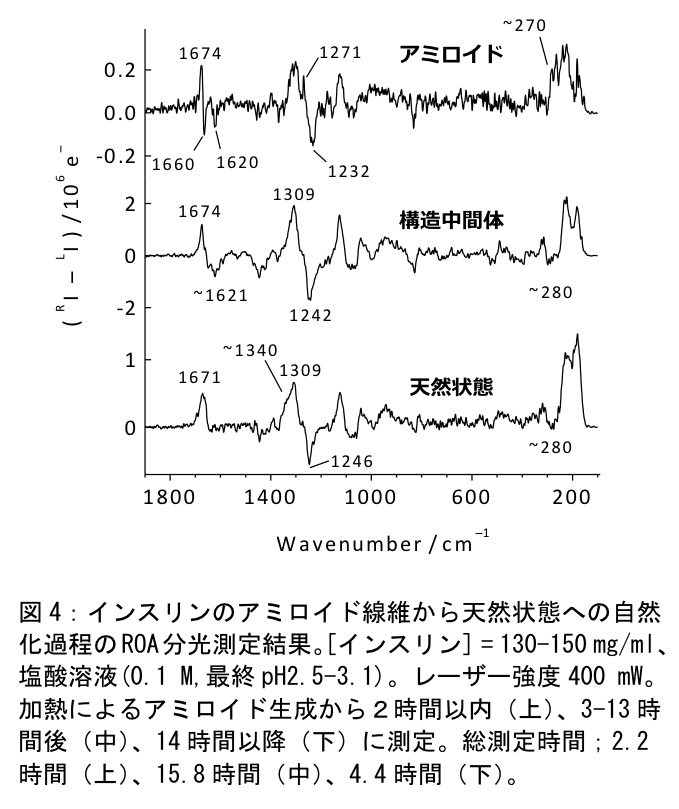
インスリンのアミロイド線維は室温強酸性下で、数時間内に自然状態へ構造変化するが、その過程の二次構造変化をROAによって測定可能である(11)。図4にROA測定結果を示す。アミロイド線維のスペクトルには1674/1660cm-1にシャープなアミドIバンドが現れている。この線幅の小さな強い正ピーク/負ピークのアミドIカップレットはβシート構造に帰属されている。一方でアミロイド線維形成から14時間以降に測定されたスペクトルにはαへリックス構造に特徴的な強い正ピーク/弱い負ピークのカップレットが見られ、二次構造が天然状態へ戻っていることがわかる。構造中間体はβシート構造のものともαへリックス構造のものとも異なる、強い正ピーク/ブロードな負ピークという特異なアミドIバンドを示しており、文献との比較からPP-IIへリックス構造に似た構造をとっていることが示唆される。さらに、アミロイド線維のスペクトルには1271cm-1にターン構造に帰属されるピークが鋭く現れており、これはアミロイド線維において規則的なターン構造が多く存在することを示唆する。また、天然状態においては、1340cm-1付近に水和へリックスピークが弱く現れており、これはインスリンの両親媒的な性質を反映していると考えられる。興味深いことに、この水和へリックスピークはアミロイド線維および構造中間体においては消滅しており、これら変性体においては、天然状態における水和へリックス構造部位が構造変化していることが分かる。
天然状態とインスリンアミロイド線維はターン構造を含むβシート構造から、PP-IIへリックス構造に似た構造中間体を経て、水和したαへリックス構造の回復した自然状態へ戻る、という事実がROA測定から明らかとなった。アミロイド線維の構造中間体構造を捉えられた事は、アミロイド線維の再自然化過程の解明の点から、非常に意義がある。ROAと同時に測定されているラマンスペクトルからは、チロシンなど側鎖の水和環境の変化が観測されており、二次構造に鋭敏なROAと、側鎖の情報が得られるラマンスペクトルの経時変化を比較することで、構造変化過程の理解が深まると考えられる。
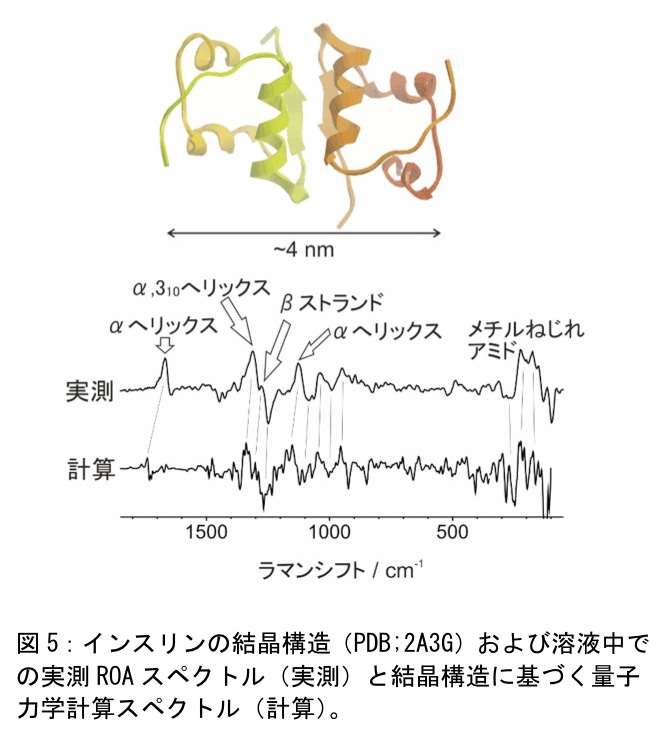
ROAスペクトルの経験的帰属からは、蛋白質のどの部位の二次構造が変化したのか特定が難しい。ROAスペクトルから詳細な分子構造情報を引き出すには、量子力学計算によるスペクトル計算が最も効果的である。近年の数値計算法の発展により、現在では蛋白質(インスリン)分子全体のROAスペクトルの計算も可能となっており、実験スペクトルとの良い一致がみられている(図5,文献12)。インスリン二量体(102アミノ酸)のROAスペクトルの計算も可能である。さらに水中でのインスリンの構造揺らぎを分子動力学とROAスペクトル計算を組み合わせて解釈することもできる。
文献
- Barron, L. D. et al., Prog. Biophys. Mol. Biol., 73, 1-49 (2000)
- Barron, L. D. et al., Chem. Phys. Lett., 492, 199-213 (2010)
- Yamamoto, S., Anal. Bioanal. Chem., 403, 2203-12 (2012)
- Barron, L. D. et al., J. Am. Chem. Soc., 95, 603-5 (1973)
- Hug, W. et al., J. Raman. Spectrosc., 30, 841-52 (1999)
- Yamamoto, S. et al., J. Raman Spectrosc., 41, 1664-9 (2010)
- McColl, I. H. et al., J. Am. Chem. Soc., 125, 10019-26 (2003)
- McColl, I. H. et al., J. Am. Chem. Soc., 126, 8181-8 (2004)
- Blanch, E. W. et al., J. Mol. Biol., 301, 553-63 (2000)
- Zhu, F. et al., Proteins, 70, 823-33 (2008)
- Yamamoto, S. et al., Chirality, 24, 97-103 (2012)
- Yamamoto, S. et al., Anal. Chem., 84, 2440-51 (2012)
概要
ラマン光学活性(Raman Optical Activity, ROA)分光法により、溶液中蛋白質の二次構造と、その変化を分析することが可能である。本稿では、ROA分光を、NMRの適用が難しい速い構造平衡にあるタンパク質や会合体、コロイド系に適用した例を述べる。また、ROA分光法の測定法の詳細についても解説を行う。
イントロダクション
ラマン光学活性(Raman optical activity, ROA)は、天然非定形蛋白質や部分的非定形構造を持つ蛋白質など、柔軟な溶液中二次構造の解析を可能とする新たな分析手法として注目されている。本稿では蛋白質のROAスペクトルの測定法の実際と、ROAスペクトルから分かる蛋白質二次構造について、実測のスペクトル(ヒト血清アルブミンおよびウシ脾臓由来インスリン)を用いて解説を行う。
溶液中蛋白質の構造決定にはNMR分光法がよく使用され、その研究の歴史は長く、応用も広くなされている。しかしNMR分光法の適用の難しい系については、他の測定法による構造解析が必要となってくる。例えば、アミロイド線維などの変性蛋白質、天然で非定形である蛋白質、非定形構造を含む変性過程の構造中間体、溶液中で会合平衡にある蛋白質などである。また、NMRのスペクトル時定数はミリ秒からマイクロ秒と遅いことから、速い構造平衡にある系ではスペクトルが平均化されて認識されてしまう。
一方ROAは溶液中蛋白質の二次構造に鋭敏な分光法であり(1,2)、ラマン散乱現象に基づくためスペクトル時定数はピコ秒程度と非常に速く、ナノ秒以下の速い構造平衡系でも平均化なく構造解析することが可能である(3)。一般的に蛋白質のラマンスペクトルには主鎖に由来する蛋白質骨格ピークだけでなく、例えばチロシン、フェニルアラニンなどの側鎖のラマンピークもかなり強く現れ主鎖のピークと重なりスペクトルが複雑になるが、一方ROAスペクトルは主に主鎖のピークに支配される為、蛋白質主鎖構造を分析する際にはより便利である。紫外円偏光二色性(UVCD)分光が蛋白質二次構造に鋭敏であることはよく知られているが、ROA分光は振動準位での分子キラリティを測定する為、UVCDと比べて、分子構造に関する情報がより豊富に得られる。
ROAは左右円偏光に対するラマン散乱光強度の差として測定される(図1)。励起レーザー光が右円偏光の時に測定されたラマン散乱強度 RI と左円偏光の時の強度 LI との差 (RI-LI)がROA信号強度である。測定対象分子がキラルである場合(蛋白質、アミノ酸、DNA、糖、脂質など)、このROA信号は正または負の値を持つ。この差はラマン光強度全体(RI+LI)と比べて10-3以下と非常に小さく、これは RI と LI のスペクトルを目視で比較しても認識できないほどの小さな差異である。この為、ROA測定装置には、光学部品の非理想性に由来する装置誤差を十分抑制することと、ラマン信号強度を多く得てS/Nを上げることの二つが同時に要求される。これは難しいものであり、1973年にBarronによって初めてROAスペクトルが測定されて以降(4)、装置の作製技術を持つ研究室でしか測定が行われてこなかった。しかし、1999年のHugによる装置の改良によって(5)、2000年付近に市販品が販売されるに至り、誰でも測定が可能となった。現代の洗練されたROA装置を用いればルーティンに測定が行える。
ROA測定は後方散乱、90度散乱、前方散乱のどのラマン測定配置でも可能である。しかし非共鳴振動ROAにおいては、ROA強度とラマン強度の比は後方散乱配置が最も強く、前方散乱配置が最も弱くなる。その為現在一般的な測定配置は後方散乱配置である。配置によって測定されるROAスペクトル形状が異なるので、配置の異なるROAスペクトル同士を比較する際には注意が必要である。ROA測定にはさらに、入射光の左右円偏光を変調させる入射円偏光(Incident Circularly Polarized; ICP)、ラマン散乱光の左右円偏光の強度差を測定する散乱円偏光(Scattered Circularly Polarized; SCP)、入射光およびラマン散乱光の左右円偏光をどちらも変調する双円偏光(Dual Circularly Polarized; DCP)の三つの測定方法が存在する。市販のROA測定装置は後方散乱配置SCP測定法を採用している。
結晶構造既知の蛋白質のROA測定から、蛋白質二次構造に特徴的なROAバンドの帰属がなされており、ROAスペクトルから二次構造を特定することが可能である。特に興味深いのは、“水和したαへリックス”やPP-IIへリックス構造に特徴的なROAピークが特定できる点である(1)。「ROAスペクトルの解析」の項で例示するように、これら経験的な帰属からも蛋白質の構造を解明できる。また、近年では量子力学計算による蛋白質のROAスペクトルの再現および帰属も報告され始めた。
装置・器具・試薬
- ラマン光学活性測定装置(自作(6)もしくは市販品 BioTools.Inc)
- 試料セル(市販もしくは自作品)
- ヒト血清アルブミン (凍結乾燥粉末をSigma社から購入)
- ウシ脾臓由来インスリン(粉末をSigma社から購入)
実験手順
1)試料調製
2)試料セルについて
3)ROA装置の設置場所について
4)ROAスペクトル測定
5)ROAスペクトルの解析
実験の詳細
1)試料調製
ノイズと装置誤差の十分小さなROAスペクトルを測定する為には、試料の調製に注意を払う必要がある。
まず試料を調製する為のガラス容器を用意する。ROA測定に必要なタンパク質試料濃度は10-5w%と非常に濃厚で粘度が高く、かつ溶液全体量は20-100μlと少量であることを考慮して、容積の小さなガラス容器を用いる。内径5mm程度のガラスチューブが適している。今回測定試料としたヒト血清アルブミン(以下アルブミン)またはウシ脾臓由来インスリン(以下インスリン)の粉末をガラス容器に秤りとる。そこへ緩衝液を20-100μl入れ、溶かす。その際気泡が発生しないように注意して溶かす。溶液の粘度が高い為、気泡は容易には消滅しない。蛋白質溶液のpHをpH試験紙またはpHメーターで確認する。微小電極を用いたpHメーターによる測定には20-50μlの試料溶液が必要である。
インスリンアミロイド線維は、インスリン溶液を82度の空気浴中で10-20分加熱することで作製する。加熱時間が長すぎると、アミロイド線維が大きな凝集体を生成し、それによる複屈折および多重散乱によりROAスペクトルの基線が大きく0からずれ、正確な測定が不可能となる。その為、ラマンスペクトルを測定しながら、アミドIのピークシフトが高波数シフトしきった時点で過熱を止めるのがよい。測定は室温で行う。
試料溶液中の埃や塵はレーザー光、ラマン散乱光の乱反射を引き起こし、それらの偏光特性を変えてしまう。乱反射した光の一部はセル壁の反射などにより検出器に到達し、偽のROA信号を生み出しうる。これを回避する為には、測定直前にメンブランフィルターで塵埃を取り除くと良い。また、試料調製に使うガラス器具や保存容器をよく洗浄し、使用する溶媒も濾過しておくことが効果的である。
ROA分光法はラマン散乱光強度の微小な差を検出する為、蛍光性の不純物や、白濁した試料ではROA信号が背景により覆い隠されたり、ベースラインが大きくゼロから外れたりして、測定が困難になる。
白濁試料については、試料濃度を抑える、溶媒を変える、界面活性剤などの可溶化剤を加えるなどして、透明な試料溶液にする必要がある。現代のROA装置では、試料濃度は10w%程度が測定時間の点から最適であるが、5w%まで下げても測定は可能である。
蛍光背景は常にラマン分光にとって困難な障壁である。一般的に蛍光強度はラマン散乱光より何桁も強い為、極微量の蛍光性不純物であっても測定の障害となる。試料の精製だけでは蛍光背景を抑えられない場合は、以下のような解決策が適用できる。
高強度可視光レーザーの照射による蛍光背景の削減。これは強い(100 mW 以上)のレーザーを試料に照射することで、蛍光性不純物を分解、もしくはレーザー焦点位置(ROA測定部位)から追い出すことによる。ROA測定で使用するレーザーを流用するのが簡便でよい。実際にラマンスペクトルを測定しつつ、蛍光背景が減少することを確認し、減少しきった時点でROA測定を開始する。レーザーの照射を止めると、蛍光物質の再生もしくは拡散が起こり、蛍光背景が回復することがある為、レーザー照射直後にROA測定を始めた方が良い。また、レーザー照射によって逆に蛍光性不純物が増加する場合もあり、これは実験で確かめる他ない。
微量の重金属イオン添加による蛍光背景の削減。これは微量の重金属元素を試料溶液に共存させることで蛍光を消光させる。一価カチオンのRb+やCs+を使用すると良い。
2)試料セルについて
ROA測定には1cm光路の石英セルも使用できるが、試料量の削減の為に容量100μl以下のセルを使用する方がよい。ROAは微小なラマン光強度の差を測定する為、セル壁面での光の反射も問題となる。ラマン散乱光がセル壁面で多重反射し、検出器に到達すれば、ROAスペクトルに偽信号として表れるであろう。側面に減反射コートを施したセルも販売されているが、アセトンなど有機溶媒による洗浄で容易にコートが剥離してしまう為、効果的ではない。セル側面に黒色の光を反射しないもの(黒紙など)を密着させると散乱光を削減できる。
筆者らは手製のセル(図2)において黒色のテフロンをセル側面に用い、反射光を削減している。この手製セルでは、測定に必要な試料体積を20μlまで削減できる。これは、通常使用される方形セルの必要試料量が100μlであるのに対してかなり少なく、高価、貴重なキラル試料の測定には有意義である。窓材には円形カバーガラスを使用しており、取り換えが可能である。蛋白質など生体試料の測定では、レーザー照射により窓材に試料が焼き付くことが稀にある。この焼き付きは、化学的な洗浄だけでは完全に取り除くことは難しいが、窓材が安価なカバーガラスであれば交換によってこれに対応できる。窓材がカバーガラスのように薄いことは、ガラスの残留複屈折を抑える点からも望ましい。
カバーガラスを交換する際は、ガラスに負荷が掛らないよう均等にネジを締め付ける。ガラスへの部分的な負荷はガラスの複屈折を引き起こし、ROAスペクトルに偽信号を与える。
セルへの試料の封入時には、セル内に気泡が残らないよう慎重に行う。気泡表面による散乱光の反射によって、ラマン散乱光の偏光特性は大きく変化し、ROAスペクトルに誤差を生じる。特に生体試料は界面活性なものが多い為、気泡が残りやすいので注意する。もし気泡ができてしまった場合は、セルを手で振って遠心力を掛け気泡を追い出すとか、もしくは低速の遠心分離機を使用する。
セルの設置する際、光路に対して垂直に設置すべきであるが、しかし完全に垂直であると、セルによるレーザー反射光がレーザー本体に戻ってしまい、レーザー強度が不安定になる可能性がある。一方、設置角度が垂直から大きくずれると、セル壁面の直線偏光依存性が出てしまうため、傾けすぎてもいけない。戻り光もなく、かつROA背景を与えないような角度を探し、毎回その角度となるようセルホルダーの角度を設定する。
3)ROA装置の設置場所について
蛋白質など生体試料のROA測定には100mWから1W程度の比較的強いレーザー光が使用される。その為、空気中に埃塵が多いと、それらがレーザーによって焼かれ、ROA装置内部のミラーなど光学部品表面に焼き付き、測定強度の減少を引き起こす。この焼き付きは、光学部品の洗浄を行うとかなり取り除けるが、しかし市販装置の部品には取り外しの容易でない部分もあり、また洗浄作業を行うには装置組み立ての経験を必要とする。筆者の経験では、この焼き付きによってラマン散乱光強度が一か月で半分以下に下がった例がある。高価なROA装置が埃の為に使用困難になることは勿体無いことなので、ROA装置の設置場所はクリーンブース内が良いだろう。装置本体の価格に比べればクリーンブースは安い。
空気中の埃を除去することは、焼き付きの問題だけでなく、測定誤差の削減の点からも重要である。例えば、目視できるほどの大きさの埃が一つ光路上にあるだけで、レーザー光の偏光状態の純粋さは大きく下がる。
市販の装置の遮光カバーは完璧ではないので、測定時には設置部屋全体を暗くする必要がある。また、パソコンモニターの光が装置に届かないよう注意すべきである。
4)ROAスペクトル測定
まずラマンスペクトルを測定し、設定の露光時間でラマン光強度がCCDの飽和直前(16ビットCCDであれば216=65536カウントで飽和)まで検出されるようにレーザー強度および露光時間を調節する。レーザー強度を上げすぎると試料もしくは光学部品が焼けてしまう為注意する。装置を長期使用する為に、筆者は800mWを最大値と決めている。露光時間は0.5秒より短すぎるとCCDの読み出し時間が支配的となり、あまり意味がない。逆に10秒以上と長すぎると、その間にレーザー強度などが変動し、波長板を用いた補正機構が上手く働かない可能性もある。1-10秒の間で設定するのが無難である。その後、積算回数を設定し、本測定を行う。
ROAスペクトルの測定の際には、再現性を確認すべきである。特に小さなピークや肩ピークを議論する場合は必要である。同じ試料でもよいので、サンプルセルの位置を50-100μm変化させ、レーザー照射位置をずらして測定を行い、再現性を見る。これは、ガラス表面の埃や傷が擬信号を生み出す可能性がある為と、測定中に宇宙線などによりROAスペクトルにスパイクが発生する可能性があるからである。蛋白質の測定には数時間はかかるであろうから、数時間を一度の測定で終わらせるよりは、1/3の時間の測定を3回行った方がよい。
5)ROAスペクトルの解析
蛋白質のROAスペクトルの解析としては、文献との比較が最も簡便である。文献1は2000年までに明らかとなった、蛋白質二次構造に特徴的なROAスペクトルを系統的に記載しており、便利である。ターン構造およびβシート構造については文献7、水和αへリックス構造については文献8、PP-IIへリックス構造については文献9、ランダム構造については文献10が詳しい。これらを参考にされるとよかろう。
図3にアルブミンのROAおよびラマンスペクトルの測定結果を示す。ラマン強度は1010e-単位であるのに対し、ROA強度は106e-単位であることに注意されたい。このROAスペクトルの基線は強度0の線からほとんどずれていない。そのずれはノイズと同程度であり、このROAスペクトルの測定誤差は少ないと考えられる。アルブミンのROAスペクトルには水和αへリックス構造に帰属されている拡張アミドIIIバンドが1342cm-1に強く現れている。一方、1303cm-1の拡張アミドIIIバンドは疎水的環境にあるαへリックス構造に帰属されており、相対的に弱い。この結果は、アルブミンのαへリックスが疎水的環境よりも水和的環境により多く存在することを示しており、アルブミンの水への高い溶解性と矛盾しない。アミドI振動領域には強い正のROAピークが1661cm-1に、比較的弱い負のROAピークが1641cm-1に現れている。この強い正ピーク/弱い負ピークの形状のアミドIカップレットはαへリックス構造に帰属されている。このことはアルブミンの結晶構造においてαへリックス構造が68-69%を占める事実と良く一致する。
インスリンのアミロイド線維は室温強酸性下で、数時間内に自然状態へ構造変化するが、その過程の二次構造変化をROAによって測定可能である(11)。図4にROA測定結果を示す。アミロイド線維のスペクトルには1674/1660cm-1にシャープなアミドIバンドが現れている。この線幅の小さな強い正ピーク/負ピークのアミドIカップレットはβシート構造に帰属されている。一方でアミロイド線維形成から14時間以降に測定されたスペクトルにはαへリックス構造に特徴的な強い正ピーク/弱い負ピークのカップレットが見られ、二次構造が天然状態へ戻っていることがわかる。構造中間体はβシート構造のものともαへリックス構造のものとも異なる、強い正ピーク/ブロードな負ピークという特異なアミドIバンドを示しており、文献との比較からPP-IIへリックス構造に似た構造をとっていることが示唆される。さらに、アミロイド線維のスペクトルには1271cm-1にターン構造に帰属されるピークが鋭く現れており、これはアミロイド線維において規則的なターン構造が多く存在することを示唆する。また、天然状態においては、1340cm-1付近に水和へリックスピークが弱く現れており、これはインスリンの両親媒的な性質を反映していると考えられる。興味深いことに、この水和へリックスピークはアミロイド線維および構造中間体においては消滅しており、これら変性体においては、天然状態における水和へリックス構造部位が構造変化していることが分かる。
天然状態とインスリンアミロイド線維はターン構造を含むβシート構造から、PP-IIへリックス構造に似た構造中間体を経て、水和したαへリックス構造の回復した自然状態へ戻る、という事実がROA測定から明らかとなった。アミロイド線維の構造中間体構造を捉えられた事は、アミロイド線維の再自然化過程の解明の点から、非常に意義がある。ROAと同時に測定されているラマンスペクトルからは、チロシンなど側鎖の水和環境の変化が観測されており、二次構造に鋭敏なROAと、側鎖の情報が得られるラマンスペクトルの経時変化を比較することで、構造変化過程の理解が深まると考えられる。
ROAスペクトルの経験的帰属からは、蛋白質のどの部位の二次構造が変化したのか特定が難しい。ROAスペクトルから詳細な分子構造情報を引き出すには、量子力学計算によるスペクトル計算が最も効果的である。近年の数値計算法の発展により、現在では蛋白質(インスリン)分子全体のROAスペクトルの計算も可能となっており、実験スペクトルとの良い一致がみられている(図5,文献12)。インスリン二量体(102アミノ酸)のROAスペクトルの計算も可能である。さらに水中でのインスリンの構造揺らぎを分子動力学とROAスペクトル計算を組み合わせて解釈することもできる。
文献
- Barron, L. D. et al., Prog. Biophys. Mol. Biol., 73, 1-49 (2000)
- Barron, L. D. et al., Chem. Phys. Lett., 492, 199-213 (2010)
- Yamamoto, S., Anal. Bioanal. Chem., 403, 2203-12 (2012)
- Barron, L. D. et al., J. Am. Chem. Soc., 95, 603-5 (1973)
- Hug, W. et al., J. Raman. Spectrosc., 30, 841-52 (1999)
- Yamamoto, S. et al., J. Raman Spectrosc., 41, 1664-9 (2010)
- McColl, I. H. et al., J. Am. Chem. Soc., 125, 10019-26 (2003)
- McColl, I. H. et al., J. Am. Chem. Soc., 126, 8181-8 (2004)
- Blanch, E. W. et al., J. Mol. Biol., 301, 553-63 (2000)
- Zhu, F. et al., Proteins, 70, 823-33 (2008)
- Yamamoto, S. et al., Chirality, 24, 97-103 (2012)
- Yamamoto, S. et al., Anal. Chem., 84, 2440-51 (2012)