概要
単一チャネル電流測定法(single channel current recording)では、平面脂質二重膜中に挿入した膜貫通チャネル形成タンパク質・ペプチドの一分子チャネル電流をリアルタイムで測定することができる。チャネル形成過程やタンパク質の化学修飾もリアルタイムで観測でき、タンパク質の挿入方向や会合状態についても情報を得ることが可能である。本稿では測定装置の組み上げから基本的な測定方法とデータの取り扱いについて解説する。測定の成否はチャネルタンパク質の安定性に大きく依存する為、試料の選定、条件検討についても述べる。1回の測定は数時間から1日で完了するが、データは統計的に処理することから一つの実験結果を得るためには1週間程度から長いときには数か月に及びデータ集積を行うこともある。
イントロダクション
中心に水やイオン、小分子等を通す孔を持つ膜タンパク質は細胞内外の情報伝達を担う重要な生体分子である。本稿ではこれらの膜タンパク質のうち、孔が小さく(直径およそ0.5~1 nm)選択性の高いものをタンパク質チャネル、孔が大きく(直径1 nm 以上)分子選択性の低いものをタンパク質ポア、と呼ぶこととする。前者はイオンチャネル、後者はβバレルタンパク質等に代表される。これらのタンパク質の機能を理解する上で、チャネル・ポアを通るイオン電流をリアルタイムで測定する電気生理学実験は多くの重要な情報を与えてくれる有用なツールである。特にイオンチャネルについてはパッチクランプ法が長らく用いられてきており、イオンチャネルの細胞膜上、リポソーム上での動的な機能解析に大きく貢献した。一方でタンパク質ポアは一般的に構造が非常に安定であることから、平面脂質二重膜(planar lipid bilayer)を用いた単一チャネル電流測定法が適用できる。
単一チャネル電流測定法の概略を図1aに示す。本測定では平面脂質二重膜で隔てられた2つのコンパートメントに高塩濃度(0.5~1 M)のバッファーを満たす。その片側に可溶化したタンパク質もしくはペプチドを添加して自発的にタンパク質ポアが脂質二重膜上に挿入されるのを待ち、形成されたポアをイオンが透過する過程を電圧一定の条件下(voltage clamp)で電流として測定する。ここからわかるように、単一チャネル電流測定法はパッチクランプ法よりも簡便に一分子電流測定を行うことができる一方で、実験条件は非常に人工的である。したがって、本測定法はアミノ酸改変、化学修飾や人工設計などにより作製されたタンパク質・ポアの構造・機能解析、およびそれらの生体分子材料としての利用を検討する際に最も力を発揮すると考えられる。βバレルタンパク質を用いた本測定法の応用例については文献1、2が詳しいので参考にしていただければと思う。また平面膜法およびパッチクランプ法の参考書としては、文献3、4が詳しい。
装置・器具・試薬
- 装置一式
- アンプリファイアー(Axopatch 200B-2、Molecular Devices Ltd.)
- デジタイザー(Digidata 1550A1、Molecular Devices Ltd.)
- ファラデーケージ、耐振動エアテーブル(FC-1 Cage and passive table、Warner Instruments Ltd.)
- 測定チャンバー、デルリン製(Bch-M13 Chamber、Warner Instruments)
- チャンバーカップ、デルリン製、50 μm 孔付き(CD13A-50 bilayer cup、Warner Instruments Ltd.)
- Ag/AgCl 電極(1-5% NaClO 溶液に1.5 mm silver wire(>99.99%、Sigma-Aldrich)を一晩浸す)
- 塩橋(3 M KCl 溶液に溶かした1-3% ager(Agarose、low melting、Fischer Science)をガラスキャピラリに通して固める、3 M KCl 溶液中で保存)
- 測定・解析用ソフト
- pCLAMP10(Molecular Devices Ltd.)
- 脂質二重膜調製用試料
- n-hexadecane/n-pentane、1/9(v/v)
- 1,2-diphytanoyl-sn-glycero-3-phosphocholine(DPhPC)/n-pentane(10 mg/mL)
耐有機溶媒の蓋つきガラスバイアルに分注して冷凍庫で保存。
※購入した脂質が chloroform 溶液の場合は、別のガラスバイアルに必要量取り、N2 ガスを吹き付けて chloroform を完全に揮発させた後に(さらに完全に chloroform を除くために、真空デシケーターに10分間以上入れておくこともある)、n-pentane を加えて n-pentane 溶液とする。
- 測定バッファー
- Tris/HCl, HEPES, MES など pH に合わせて選択+1 M KCl
実験手順
- 実験装置のセットアップ
- 試料調製
- 平面脂質二重膜の準備
- 電流測定
- 実験条件の検討
- データ解析
実験の詳細
1)実験装置のセットアップ
実験装置は、信号を増幅するアンプリファイアー、信号をデジタル化するデジタイザー、デジタイザーに接続し実験を制御、モニターする PC、平面二重膜用の測定チャンバー、測定チャンバーをノイズから守るファラデーケージと耐振動エアテーブルから成る。(図1b)本稿で紹介するセットアップでは Molecular Devices 社のアンプリファイアーとデジタイザーに Warner Instruments 社の製品を組み合わせて用いている。この場合、ケージの組み立て、配線等、立ち上げは自分で行う必要がある。研究室によってはチャンバーやケージを自作するところもある。ゼロから始める場合は、Warner Instruments 社が単一チャネル電流測定法に必要な装置全てが含まれるセットを販売しているので、そちらを購入すれば装置の立ち上げまで販売会社の技術者に依頼することもできる。
2)試料調製
測定に用いるバッファーはシリンジフィルター等でろ過してから用いる。測定するタンパク質・ペプチドは界面活性剤等を用いて可溶化し、測定直前に30分以上は卓上遠心機で遠心しておく。筆者がペプチド試料を調製する際は、濃度~50 μM で、0.05% n-Dodecyl β-D-maltoside(DDM)を含む水溶液中に溶解する。一回の測定に必要な量は1 μL 以下(終濃度<~50 nM)であるが、遠心後の試料の上澄みを取る際の扱いやすさの観点から数十 μL 程度を調製することが多い。試料は毎回新しく調製することが望ましいが、安定なペプチド試料等の場合は冷蔵庫で保存して2~3日続けて使用することもできる。
3)平面脂質二重膜の準備
平面脂質二重膜を構成する方法はいくつかあるが、ここではチャンバーカップの両側からピペッティングにより脂質を張り付ける Montal-Mueller 法を紹介する(図2)。この方法の成否は実験操作への習熟に加えてチャンバーカップの孔の品質が大きく関わるので、本稿で紹介する既製品や、文献1で紹介されている PTFE フィルム等を利用することをおすすめする。準備できるサンプル量に限りがある場合、全くゼロから電流測定を始める場合には Droplet 法の検討も勧める(工夫とコツを参照)。
測定チャンバーとチャンバーカップを図2aに示す。まずチャンバーカップの横にある孔に少量のオイルをつける。n-hexadecane/n-pentane 溶液をピペットゴム付きガラスキャピラリで取り、一滴(1 μL 程度)孔の近くに乗せる。さらにガラスキャピラリの端をバーナーで熱して滑らかな球状にしたもので孔の周囲に軽く触れてオイルを伸ばす(孔をこすったり力をかけたりしないように注意する)。カップの内側と外側両方から同様の操作をした後、n-pentane が十分揮発するまで5分程度待つ。次にカップに1 mL のバッファーを入れ、カップの上部を指で覆うようにしながら横の孔に液滴が出てくるまで押す(これを行わないと孔の中に気泡が残ってしまう)。カップをチャンバーに差し込み、横のねじで締める(強く締めすぎるとカップが歪んで隙間ができてしまうのできちんと止まっている程度で良い)。カップの反対側にもバッファーを1 mL 入れる。マイクロシリンジで脂質(DPhPC)の n-pentane 溶液を3 μL ずつ、シリンジの先がバッファーに触れないよう(シリンジから脂質溶液にバッファーが混入するのを防ぐため)注意しながらバッファー液面に落とす。n-pentane が揮発するまで10分程待つ(脂質の単層膜がバッファー表面に広がり、図2b の状態になる)。チャンバーに電極、塩橋を図1c のように配置する。pCLAMP の測定ソフト Clampex を立ち上げて、キャパシタンス測定プログラムを開き(Clampex でのプログラムの作成については文献1, 3参照)、画面を見ながらチャンバーの片側のバッファーをピペットで全てゆっくり吸い(図2c)、ゆっくり戻す(図2d,e)。同様の操作をチャンバーの反対側でも行う(図2f,g)。一度で二重膜が張れないことも多いので、両側でピペッティングを繰り返し、図3aのようにスクエアカーブがしっかり立ち上がれば平面脂質二重膜の調製は完了である。この方法で作製した膜のキャパシタンスは0.6~0.8 μF/cm2 程度となるので、スクエアカーブの上下幅から得られるキャパシタンスとチャンバーカップ孔の面積から得られる理論値に大きく開きがないことも確認しておく。
4)電流測定
脂質二重膜が調製できたら、プログラムを Voltage clamp 測定モードにし、+50~+100 mV の電圧をかけて30分ほど待って、バックグラウンド測定と脂質二重膜の安定化を行う。さらに測定で用いる電圧の最高電圧(通常±250 mV 程度まで)をかけて10分程度待ち、膜が壊れないかを確認する。壊れてしまった場合は3)のピペッティング操作を再度行って二重膜を再生する。
脂質二重膜の安定性が確認できたら、電圧を0 mV に戻し、チャンバーの cis 側(カップの外側)に試料溶液を0.2 μL-数 μL(試料の種類とその濃度による)加える。200 μL のピペットに持ち替え、水面が膜のある孔を通過しない液量でゆっくりとカップ内の溶液を攪拌する。ここでしっかりと攪拌しておくとタンパク質・ペプチドが膜に到達しやすくなる。
次に Clampex の記録ボタンを押したのちに電圧をかけて測定を開始し、ポア形成を待つ。この時必要に応じて低ノイズのマグネティックスターラーで攪拌を行うのも効果的である。一般に正電荷を帯びたタンパク質には負電圧、負電荷をおびたタンパク質には正電圧をかけると膜の方向に誘引できると考えられるが、必ずしもその電圧がポア形成に最適とは限らない。双極子モーメントによって膜に貫通し、会合体を形成してポアを形成するようなチャネルペプチド(alamethicin など)も存在する。したがってポア形成を待つ際の電圧は各々の試料によって試行錯誤を繰り返す必要がある。筆者のペプチド試料は正電荷を帯びているが、+100~200 mV 電圧下で安定なポアを形成する。ポアを形成すると図3b のように電流値の上昇が観測できる。ポアが十分安定であれば、cis 側のバッファーをピペットもしくはシリンジを用いた灌流ラインにより全て置換して溶液中の残りのタンパク質を除去すると2つ以上のポア形成を防ぐことができる。
5)実験条件の検討
ひとたび安定なポアを得られたら、まずは少なくとも数分~10分は電圧を変えずに測定を続け、安定性を確認すると同時にその後の実験のコントロールデータを取る。次に Clampex で電圧を10 mV 間隔で-100 mV~+100 mV を掃引するようなプログラムを作成し、各電圧での電流をプロットして I-V グラフを得る。孔サイズが大きいタンパク質ポアの場合は直線になることが多く(図3c)、孔の形状が非対称である場合や選択性があるチャネルの場合はカーブを描くので(図3d)膜タンパク質の構造・性質の情報を得ることができる。
さらなるポアのキャラクタリゼーションには、A)ポアをブロックするような化合物の探索、B)タンパク質・ペプチドのシステイン誘導体を用いた実験、が挙げられる。
A)では、タンパク質ポア内部の電荷を考慮して、反対の電荷を帯びたシクロデキストリンやポアサイズに合う小分子が試されることが多い。また既に知られているポアを塞ぐタイプの阻害剤を使って膜タンパク質がきちんとフォールディングしていることを確認することもできる。化合物が結合、通過した際の電流の下がり方や結合時間により、ポアのサイズの見積もりと結合定数が算出できる。
B)では、システインと活性化チオールを持つ化合物(PEG 誘導体など)の化学反応をリアルタイム観測することで、タンパク質・ペプチドの挿入方向の確認や会合数の見積もりを行うことができる(文献5,6)。システインを導入する箇所は工夫が必要であるが、ここで適切な実験をデザインすることでポアについて非常に有用な情報を得ることができる。
6)データ解析
データ解析には pCLAMP の解析ソフト Clampfit と、グラフ作成ソフト(Origin など)を用いる。Clampfit は機能が多く慣れるのにやや時間がかかるが、生データを用いて測定データの基本的な解析(ヒストグラムとガウシアンフィット、I-V プロットの作成など)ができる。単一チャネル測定法では、同じ測定を繰り返し行って得たデータを統計的に取り扱うことが基本となるので、論文用の図を作る際にはグラフ作成ソフトの併用が便利である。例えば一つのポアのコンダクタンスを測定する際には、ポアの電流測定→Clampfit で測定データから電流値ヒストグラムを作成しガウシアンフィット→得られた電流値と実験に用いた電圧値からコンダクタンス(C=1/R=I/V)を算出→脂質二重膜をアンプリファイアーにある zap ボタンを用いて壊し、再度膜を作製して新たなポアを形成し電流測定、というサイクルを10~100回程度繰り返す。次にグラフ作成ソフトを用いて得られたコンダクタンス値のヒストグラムを作成し、ガウシアンフィットから最終的なポアのユニタリコンダクタンスを算出する。コンダクタンスは電圧依存性があることが多いので、各実験電圧について算出するのが望ましい。
工夫とコツ
脂質二重膜作製条件と試料の選定について
本稿で紹介する実験法に適している試料は、膜タンパク質・ペプチドポアの中でも特に構造的に安定なものに限られる。測定温度は汎用の脂質 DPhPC が安定に膜を形成できる室温が選択されることが多く、また可溶化後、チャンバーに試料を添加した際には界面活性剤は臨界ミセル濃度以下になるため、タンパク質は大部分水に晒されることになる。このような条件にも耐えるタンパク質を選定することが必要であるため、実験報告例の多くは非常に安定なβバレルタンパク質やペプチドポアとなっている。
また特に合成や大量発現等で十分な量を確保できない膜タンパク質については、脂質二重膜作製法として、必要サンプル量が非常に少ない droplet 法(文献7、8、9)の利用を検討すると良い。近年では droplet 法を使って3つ以上のコンパートメントを連結する方法(文献10)やイメージングを組み合わせた方法(文献11)も開発されており、各試料と得たい情報によって実験法を選択することをお勧めする。
測定時のノイズについて
測定装置回りには電源、配線、携帯電話の電波、周囲の音やテーブルへの振動などさまざまなノイズ発生源がある。このノイズは装置が置かれる環境によって異なるので、アースを適切に取る、遮蔽をきちんとする、エアテーブルを調整する、携帯電話をフライトモードにする、などの対応が適宜必要になる。特にアースの取り方は重要であるが、本稿で紹介したファラデーケージにはアースを一つにまとめられる部品やドア部のアース部品が付属しているので活用すると良い。また恒常的に発生しているノイズに関しては、本稿でも紹介している、Molecular Devices の Hum silencer 付きのデジタイザーを用いると劇的に改善する。
またアンプリファイアーについているつまみから Low pass filter を調整してノイズのコントロールができる。筆者は通常2 kHz を用いることが多いが、早いイベントを観測するために高いシグナルの時間分解能が必要な際には Low pass filter frequency を上げて測定する。さらに測定ソフトの Clampex 上からサンプリングレートも指定できる。通常は10 kHz を用いることが多いが、Low pass filter frequency を上げた場合はこちらのレートも高くする。時間分解能を上げると必然的にデータ量が増えることになり、解析時に PC が低速になったりデータ保存に大容量のストレージが必要になったりするので、バランスを考えて分解能を都度選択すると良い。
チャンバー、カップの洗浄について
膜タンパク質・ペプチド試料は確実に洗浄しないと次回以降の測定時に膜が不安定になったりポアがうまく形成されなかったりする恐れがある。ただし膜を形成させるカップの孔はデリケートなので、力をかけてしまわないよう注意が必要である。筆者は Warner Instruments の洗浄プロトコール(https://www.warneronline.com/page.cfm?page=111からダウンロードできる。同ページのその他のプロトコールも役に立つものが多い。)に加えて、デルリン素材のカップにはエタノール、イソプロパノールでの洗浄を適宜行っている。有機溶媒はカップの素材によっては孔をいためることがあるので事前に確認すること。
電流測定のリアルタイムデータについて
Clampfit から Edit→Transfer data→Results window を選択すると ASCII 形式で表示されるので、そこからグラフ作成ソフトにコピーペーストして論文用の図を作ると良い。また簡易的には Clampfit で View→Layout Window を選択し、Edit→Copy to Layout Window で開いている測定データを Layout Window に移したら、画像を選択してコピー、Illustrator や Inkscape などのベクター系描画ソフトへペースト、で編集も可能である。
実験の安全
使用する有機溶媒は揮発性であるので火気には注意する。
文献
- Maglia, G. et al., Methods in Enzymology (1 ed.) 475, 591–623. Elsevier Inc., Amsterdam (2010)
- Bayley, H. & Jayasinghe, L., Mol. Membr. Biol. 21, 209–20(2004)
- The Axon™ Guide. Molecular Devices
- 岡田泰信,最新パッチクランプ実験技術法,吉岡書店 (2011)
- Mahendran, K. R. et al., Nat. Chem., 9, 411–9 (2017)
- Miles, G. et al., Protein Sci., 894–902 (2009)
- Tsofina, L. M. et al., Nature, 212, 681–3 (1966)
- Funakoshi, K. et al., Anal. Chem., 78, 8169–74 (2006)
- 川野竜司,生物物理,55,077–080 (2015)
- Villar G. & Wallace M. I., Nat. Nanotechnol., 12, 803–8 (2007)
- Weatherill E. E. et al., J. Mol. Biol., 427, 146–57 (2015)
謝辞
装置写真の利用を許可していただいた Dek Woolson 教授(ブリストル大)、技術指導をしていただいた Hagan Bayley 教授、Radhakrishnan Mahendran 博士(オックスフォード大)、本稿執筆にあたり助言をいただいた能代大輔博士(金沢大)に御礼申し上げます。
-
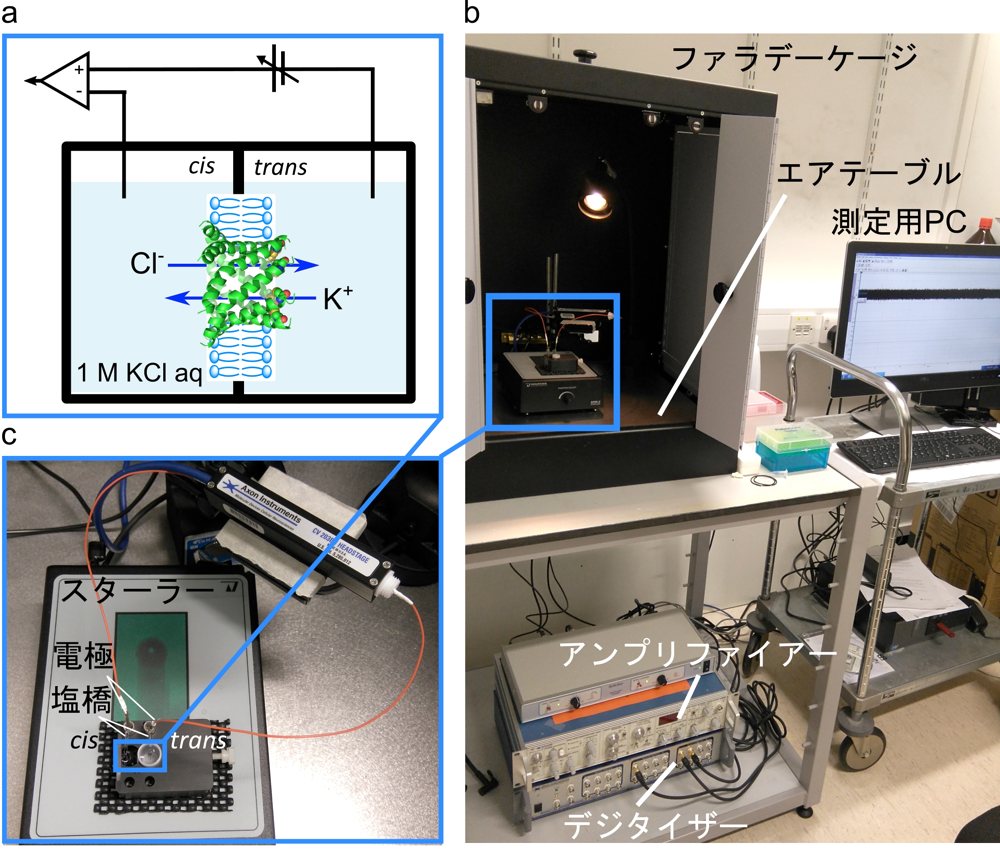
図1:測定装置の概要。a)平面脂質二重膜を用いた単一チャネル電流測定法チャンバーの概略図。cis 側がグラウンドになり、こちらに試薬溶液を加える。b)測定装置の全容。c)測定チャンバー拡大写真。白色カップの外側を cis 側にすると洗浄が楽になる。 -
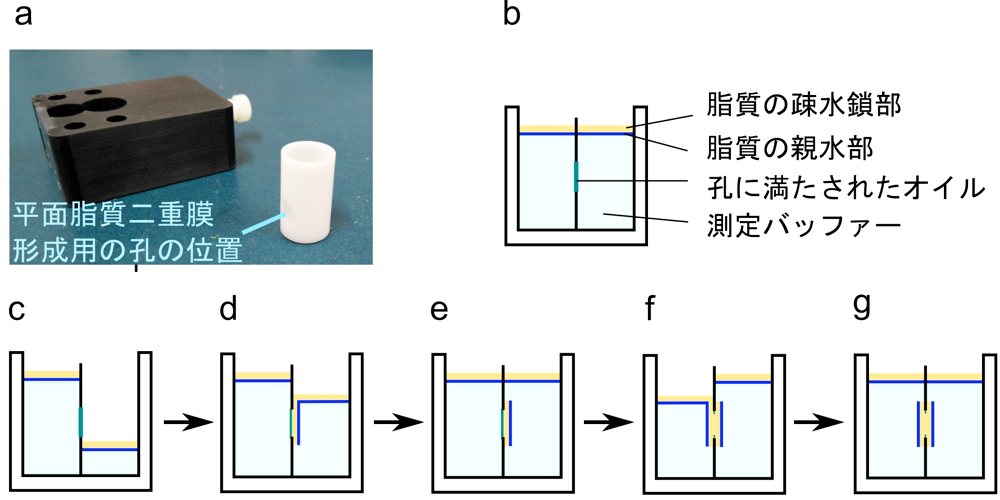
図2:平面脂質二重膜の調製(Montal-Mueller 法)a)チャンバーとカップ。線で示した位置に50 μm の孔が開いている。カップをチャンバーにはめ込んで使用する。b)カップを入れたチャンバーの模式図。脂質をバッファー表面に載せた状態。c-g)バッファーのピペッティングにより脂質二重膜を形成する際の概略図。 -
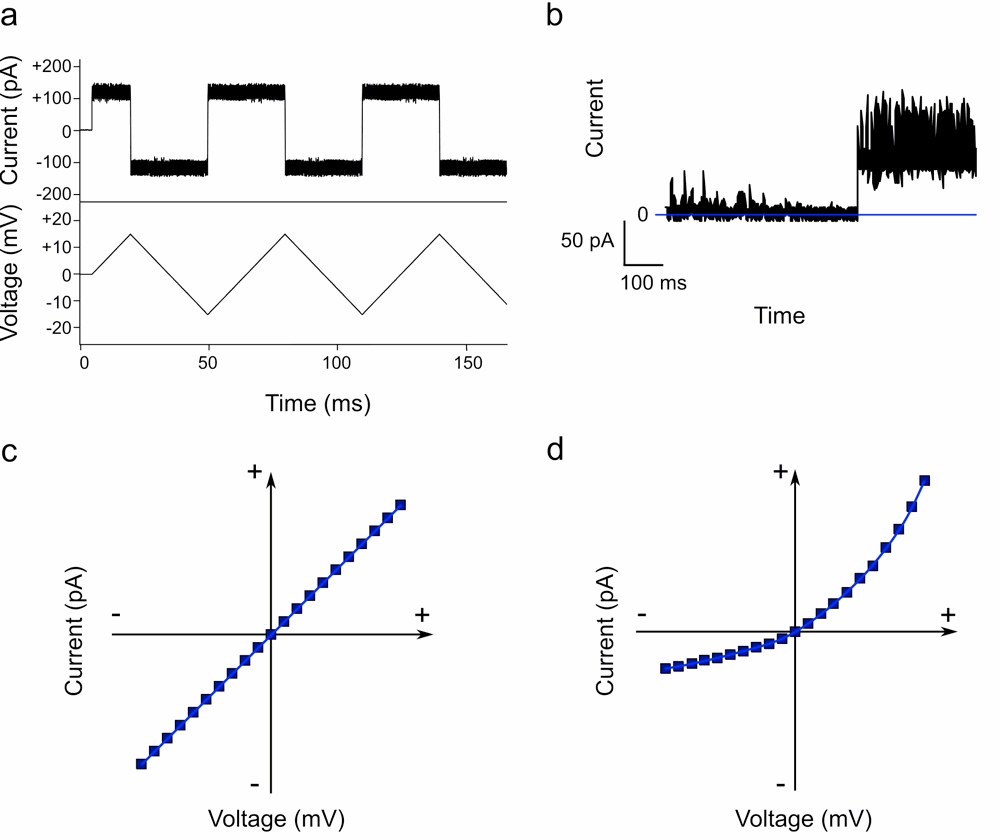
図3:測定データの例。a)脂質二重膜のキャパシタンス測定の例。ピークからピークの絶対値が膜のキャパシタンス。ここでは2 pA が1 pF にあたる。b)ポア形成時の測定データの例。c)選択性を持たず対称性の高いポアの場合に得られる I-V(電流-電圧)プロット。d)選択性があったり孔が非対称なポア・チャネルの場合に得られる I-V プロットの一例。カーブの形状は実験に用いるイオン種やポアの形状によって変わる。
概要
単一チャネル電流測定法(single channel current recording)では、平面脂質二重膜中に挿入した膜貫通チャネル形成タンパク質・ペプチドの一分子チャネル電流をリアルタイムで測定することができる。チャネル形成過程やタンパク質の化学修飾もリアルタイムで観測でき、タンパク質の挿入方向や会合状態についても情報を得ることが可能である。本稿では測定装置の組み上げから基本的な測定方法とデータの取り扱いについて解説する。測定の成否はチャネルタンパク質の安定性に大きく依存する為、試料の選定、条件検討についても述べる。1回の測定は数時間から1日で完了するが、データは統計的に処理することから一つの実験結果を得るためには1週間程度から長いときには数か月に及びデータ集積を行うこともある。
イントロダクション
中心に水やイオン、小分子等を通す孔を持つ膜タンパク質は細胞内外の情報伝達を担う重要な生体分子である。本稿ではこれらの膜タンパク質のうち、孔が小さく(直径およそ0.5~1 nm)選択性の高いものをタンパク質チャネル、孔が大きく(直径1 nm 以上)分子選択性の低いものをタンパク質ポア、と呼ぶこととする。前者はイオンチャネル、後者はβバレルタンパク質等に代表される。これらのタンパク質の機能を理解する上で、チャネル・ポアを通るイオン電流をリアルタイムで測定する電気生理学実験は多くの重要な情報を与えてくれる有用なツールである。特にイオンチャネルについてはパッチクランプ法が長らく用いられてきており、イオンチャネルの細胞膜上、リポソーム上での動的な機能解析に大きく貢献した。一方でタンパク質ポアは一般的に構造が非常に安定であることから、平面脂質二重膜(planar lipid bilayer)を用いた単一チャネル電流測定法が適用できる。
単一チャネル電流測定法の概略を図1aに示す。本測定では平面脂質二重膜で隔てられた2つのコンパートメントに高塩濃度(0.5~1 M)のバッファーを満たす。その片側に可溶化したタンパク質もしくはペプチドを添加して自発的にタンパク質ポアが脂質二重膜上に挿入されるのを待ち、形成されたポアをイオンが透過する過程を電圧一定の条件下(voltage clamp)で電流として測定する。ここからわかるように、単一チャネル電流測定法はパッチクランプ法よりも簡便に一分子電流測定を行うことができる一方で、実験条件は非常に人工的である。したがって、本測定法はアミノ酸改変、化学修飾や人工設計などにより作製されたタンパク質・ポアの構造・機能解析、およびそれらの生体分子材料としての利用を検討する際に最も力を発揮すると考えられる。βバレルタンパク質を用いた本測定法の応用例については文献1、2が詳しいので参考にしていただければと思う。また平面膜法およびパッチクランプ法の参考書としては、文献3、4が詳しい。
装置・器具・試薬
- 装置一式
- アンプリファイアー(Axopatch 200B-2、Molecular Devices Ltd.)
- デジタイザー(Digidata 1550A1、Molecular Devices Ltd.)
- ファラデーケージ、耐振動エアテーブル(FC-1 Cage and passive table、Warner Instruments Ltd.)
- 測定チャンバー、デルリン製(Bch-M13 Chamber、Warner Instruments)
- チャンバーカップ、デルリン製、50 μm 孔付き(CD13A-50 bilayer cup、Warner Instruments Ltd.)
- Ag/AgCl 電極(1-5% NaClO 溶液に1.5 mm silver wire(>99.99%、Sigma-Aldrich)を一晩浸す)
- 塩橋(3 M KCl 溶液に溶かした1-3% ager(Agarose、low melting、Fischer Science)をガラスキャピラリに通して固める、3 M KCl 溶液中で保存)
- 測定・解析用ソフト
- pCLAMP10(Molecular Devices Ltd.)
- 脂質二重膜調製用試料
- n-hexadecane/n-pentane、1/9(v/v)
- 1,2-diphytanoyl-sn-glycero-3-phosphocholine(DPhPC)/n-pentane(10 mg/mL)
耐有機溶媒の蓋つきガラスバイアルに分注して冷凍庫で保存。
※購入した脂質が chloroform 溶液の場合は、別のガラスバイアルに必要量取り、N2 ガスを吹き付けて chloroform を完全に揮発させた後に(さらに完全に chloroform を除くために、真空デシケーターに10分間以上入れておくこともある)、n-pentane を加えて n-pentane 溶液とする。
- 測定バッファー
- Tris/HCl, HEPES, MES など pH に合わせて選択+1 M KCl
実験手順
- 実験装置のセットアップ
- 試料調製
- 平面脂質二重膜の準備
- 電流測定
- 実験条件の検討
- データ解析
実験の詳細
1)実験装置のセットアップ
実験装置は、信号を増幅するアンプリファイアー、信号をデジタル化するデジタイザー、デジタイザーに接続し実験を制御、モニターする PC、平面二重膜用の測定チャンバー、測定チャンバーをノイズから守るファラデーケージと耐振動エアテーブルから成る。(図1b)本稿で紹介するセットアップでは Molecular Devices 社のアンプリファイアーとデジタイザーに Warner Instruments 社の製品を組み合わせて用いている。この場合、ケージの組み立て、配線等、立ち上げは自分で行う必要がある。研究室によってはチャンバーやケージを自作するところもある。ゼロから始める場合は、Warner Instruments 社が単一チャネル電流測定法に必要な装置全てが含まれるセットを販売しているので、そちらを購入すれば装置の立ち上げまで販売会社の技術者に依頼することもできる。
2)試料調製
測定に用いるバッファーはシリンジフィルター等でろ過してから用いる。測定するタンパク質・ペプチドは界面活性剤等を用いて可溶化し、測定直前に30分以上は卓上遠心機で遠心しておく。筆者がペプチド試料を調製する際は、濃度~50 μM で、0.05% n-Dodecyl β-D-maltoside(DDM)を含む水溶液中に溶解する。一回の測定に必要な量は1 μL 以下(終濃度<~50 nM)であるが、遠心後の試料の上澄みを取る際の扱いやすさの観点から数十 μL 程度を調製することが多い。試料は毎回新しく調製することが望ましいが、安定なペプチド試料等の場合は冷蔵庫で保存して2~3日続けて使用することもできる。
3)平面脂質二重膜の準備
平面脂質二重膜を構成する方法はいくつかあるが、ここではチャンバーカップの両側からピペッティングにより脂質を張り付ける Montal-Mueller 法を紹介する(図2)。この方法の成否は実験操作への習熟に加えてチャンバーカップの孔の品質が大きく関わるので、本稿で紹介する既製品や、文献1で紹介されている PTFE フィルム等を利用することをおすすめする。準備できるサンプル量に限りがある場合、全くゼロから電流測定を始める場合には Droplet 法の検討も勧める(工夫とコツを参照)。
測定チャンバーとチャンバーカップを図2aに示す。まずチャンバーカップの横にある孔に少量のオイルをつける。n-hexadecane/n-pentane 溶液をピペットゴム付きガラスキャピラリで取り、一滴(1 μL 程度)孔の近くに乗せる。さらにガラスキャピラリの端をバーナーで熱して滑らかな球状にしたもので孔の周囲に軽く触れてオイルを伸ばす(孔をこすったり力をかけたりしないように注意する)。カップの内側と外側両方から同様の操作をした後、n-pentane が十分揮発するまで5分程度待つ。次にカップに1 mL のバッファーを入れ、カップの上部を指で覆うようにしながら横の孔に液滴が出てくるまで押す(これを行わないと孔の中に気泡が残ってしまう)。カップをチャンバーに差し込み、横のねじで締める(強く締めすぎるとカップが歪んで隙間ができてしまうのできちんと止まっている程度で良い)。カップの反対側にもバッファーを1 mL 入れる。マイクロシリンジで脂質(DPhPC)の n-pentane 溶液を3 μL ずつ、シリンジの先がバッファーに触れないよう(シリンジから脂質溶液にバッファーが混入するのを防ぐため)注意しながらバッファー液面に落とす。n-pentane が揮発するまで10分程待つ(脂質の単層膜がバッファー表面に広がり、図2b の状態になる)。チャンバーに電極、塩橋を図1c のように配置する。pCLAMP の測定ソフト Clampex を立ち上げて、キャパシタンス測定プログラムを開き(Clampex でのプログラムの作成については文献1, 3参照)、画面を見ながらチャンバーの片側のバッファーをピペットで全てゆっくり吸い(図2c)、ゆっくり戻す(図2d,e)。同様の操作をチャンバーの反対側でも行う(図2f,g)。一度で二重膜が張れないことも多いので、両側でピペッティングを繰り返し、図3aのようにスクエアカーブがしっかり立ち上がれば平面脂質二重膜の調製は完了である。この方法で作製した膜のキャパシタンスは0.6~0.8 μF/cm2 程度となるので、スクエアカーブの上下幅から得られるキャパシタンスとチャンバーカップ孔の面積から得られる理論値に大きく開きがないことも確認しておく。
4)電流測定
脂質二重膜が調製できたら、プログラムを Voltage clamp 測定モードにし、+50~+100 mV の電圧をかけて30分ほど待って、バックグラウンド測定と脂質二重膜の安定化を行う。さらに測定で用いる電圧の最高電圧(通常±250 mV 程度まで)をかけて10分程度待ち、膜が壊れないかを確認する。壊れてしまった場合は3)のピペッティング操作を再度行って二重膜を再生する。
脂質二重膜の安定性が確認できたら、電圧を0 mV に戻し、チャンバーの cis 側(カップの外側)に試料溶液を0.2 μL-数 μL(試料の種類とその濃度による)加える。200 μL のピペットに持ち替え、水面が膜のある孔を通過しない液量でゆっくりとカップ内の溶液を攪拌する。ここでしっかりと攪拌しておくとタンパク質・ペプチドが膜に到達しやすくなる。
次に Clampex の記録ボタンを押したのちに電圧をかけて測定を開始し、ポア形成を待つ。この時必要に応じて低ノイズのマグネティックスターラーで攪拌を行うのも効果的である。一般に正電荷を帯びたタンパク質には負電圧、負電荷をおびたタンパク質には正電圧をかけると膜の方向に誘引できると考えられるが、必ずしもその電圧がポア形成に最適とは限らない。双極子モーメントによって膜に貫通し、会合体を形成してポアを形成するようなチャネルペプチド(alamethicin など)も存在する。したがってポア形成を待つ際の電圧は各々の試料によって試行錯誤を繰り返す必要がある。筆者のペプチド試料は正電荷を帯びているが、+100~200 mV 電圧下で安定なポアを形成する。ポアを形成すると図3b のように電流値の上昇が観測できる。ポアが十分安定であれば、cis 側のバッファーをピペットもしくはシリンジを用いた灌流ラインにより全て置換して溶液中の残りのタンパク質を除去すると2つ以上のポア形成を防ぐことができる。
5)実験条件の検討
ひとたび安定なポアを得られたら、まずは少なくとも数分~10分は電圧を変えずに測定を続け、安定性を確認すると同時にその後の実験のコントロールデータを取る。次に Clampex で電圧を10 mV 間隔で-100 mV~+100 mV を掃引するようなプログラムを作成し、各電圧での電流をプロットして I-V グラフを得る。孔サイズが大きいタンパク質ポアの場合は直線になることが多く(図3c)、孔の形状が非対称である場合や選択性があるチャネルの場合はカーブを描くので(図3d)膜タンパク質の構造・性質の情報を得ることができる。
さらなるポアのキャラクタリゼーションには、A)ポアをブロックするような化合物の探索、B)タンパク質・ペプチドのシステイン誘導体を用いた実験、が挙げられる。
A)では、タンパク質ポア内部の電荷を考慮して、反対の電荷を帯びたシクロデキストリンやポアサイズに合う小分子が試されることが多い。また既に知られているポアを塞ぐタイプの阻害剤を使って膜タンパク質がきちんとフォールディングしていることを確認することもできる。化合物が結合、通過した際の電流の下がり方や結合時間により、ポアのサイズの見積もりと結合定数が算出できる。
B)では、システインと活性化チオールを持つ化合物(PEG 誘導体など)の化学反応をリアルタイム観測することで、タンパク質・ペプチドの挿入方向の確認や会合数の見積もりを行うことができる(文献5,6)。システインを導入する箇所は工夫が必要であるが、ここで適切な実験をデザインすることでポアについて非常に有用な情報を得ることができる。
6)データ解析
データ解析には pCLAMP の解析ソフト Clampfit と、グラフ作成ソフト(Origin など)を用いる。Clampfit は機能が多く慣れるのにやや時間がかかるが、生データを用いて測定データの基本的な解析(ヒストグラムとガウシアンフィット、I-V プロットの作成など)ができる。単一チャネル測定法では、同じ測定を繰り返し行って得たデータを統計的に取り扱うことが基本となるので、論文用の図を作る際にはグラフ作成ソフトの併用が便利である。例えば一つのポアのコンダクタンスを測定する際には、ポアの電流測定→Clampfit で測定データから電流値ヒストグラムを作成しガウシアンフィット→得られた電流値と実験に用いた電圧値からコンダクタンス(C=1/R=I/V)を算出→脂質二重膜をアンプリファイアーにある zap ボタンを用いて壊し、再度膜を作製して新たなポアを形成し電流測定、というサイクルを10~100回程度繰り返す。次にグラフ作成ソフトを用いて得られたコンダクタンス値のヒストグラムを作成し、ガウシアンフィットから最終的なポアのユニタリコンダクタンスを算出する。コンダクタンスは電圧依存性があることが多いので、各実験電圧について算出するのが望ましい。
工夫とコツ
脂質二重膜作製条件と試料の選定について
本稿で紹介する実験法に適している試料は、膜タンパク質・ペプチドポアの中でも特に構造的に安定なものに限られる。測定温度は汎用の脂質 DPhPC が安定に膜を形成できる室温が選択されることが多く、また可溶化後、チャンバーに試料を添加した際には界面活性剤は臨界ミセル濃度以下になるため、タンパク質は大部分水に晒されることになる。このような条件にも耐えるタンパク質を選定することが必要であるため、実験報告例の多くは非常に安定なβバレルタンパク質やペプチドポアとなっている。
また特に合成や大量発現等で十分な量を確保できない膜タンパク質については、脂質二重膜作製法として、必要サンプル量が非常に少ない droplet 法(文献7、8、9)の利用を検討すると良い。近年では droplet 法を使って3つ以上のコンパートメントを連結する方法(文献10)やイメージングを組み合わせた方法(文献11)も開発されており、各試料と得たい情報によって実験法を選択することをお勧めする。
測定時のノイズについて
測定装置回りには電源、配線、携帯電話の電波、周囲の音やテーブルへの振動などさまざまなノイズ発生源がある。このノイズは装置が置かれる環境によって異なるので、アースを適切に取る、遮蔽をきちんとする、エアテーブルを調整する、携帯電話をフライトモードにする、などの対応が適宜必要になる。特にアースの取り方は重要であるが、本稿で紹介したファラデーケージにはアースを一つにまとめられる部品やドア部のアース部品が付属しているので活用すると良い。また恒常的に発生しているノイズに関しては、本稿でも紹介している、Molecular Devices の Hum silencer 付きのデジタイザーを用いると劇的に改善する。
またアンプリファイアーについているつまみから Low pass filter を調整してノイズのコントロールができる。筆者は通常2 kHz を用いることが多いが、早いイベントを観測するために高いシグナルの時間分解能が必要な際には Low pass filter frequency を上げて測定する。さらに測定ソフトの Clampex 上からサンプリングレートも指定できる。通常は10 kHz を用いることが多いが、Low pass filter frequency を上げた場合はこちらのレートも高くする。時間分解能を上げると必然的にデータ量が増えることになり、解析時に PC が低速になったりデータ保存に大容量のストレージが必要になったりするので、バランスを考えて分解能を都度選択すると良い。
チャンバー、カップの洗浄について
膜タンパク質・ペプチド試料は確実に洗浄しないと次回以降の測定時に膜が不安定になったりポアがうまく形成されなかったりする恐れがある。ただし膜を形成させるカップの孔はデリケートなので、力をかけてしまわないよう注意が必要である。筆者は Warner Instruments の洗浄プロトコール(https://www.warneronline.com/page.cfm?page=111からダウンロードできる。同ページのその他のプロトコールも役に立つものが多い。)に加えて、デルリン素材のカップにはエタノール、イソプロパノールでの洗浄を適宜行っている。有機溶媒はカップの素材によっては孔をいためることがあるので事前に確認すること。
電流測定のリアルタイムデータについて
Clampfit から Edit→Transfer data→Results window を選択すると ASCII 形式で表示されるので、そこからグラフ作成ソフトにコピーペーストして論文用の図を作ると良い。また簡易的には Clampfit で View→Layout Window を選択し、Edit→Copy to Layout Window で開いている測定データを Layout Window に移したら、画像を選択してコピー、Illustrator や Inkscape などのベクター系描画ソフトへペースト、で編集も可能である。
実験の安全
使用する有機溶媒は揮発性であるので火気には注意する。
文献
- Maglia, G. et al., Methods in Enzymology (1 ed.) 475, 591–623. Elsevier Inc., Amsterdam (2010)
- Bayley, H. & Jayasinghe, L., Mol. Membr. Biol. 21, 209–20(2004)
- The Axon™ Guide. Molecular Devices
- 岡田泰信,最新パッチクランプ実験技術法,吉岡書店 (2011)
- Mahendran, K. R. et al., Nat. Chem., 9, 411–9 (2017)
- Miles, G. et al., Protein Sci., 894–902 (2009)
- Tsofina, L. M. et al., Nature, 212, 681–3 (1966)
- Funakoshi, K. et al., Anal. Chem., 78, 8169–74 (2006)
- 川野竜司,生物物理,55,077–080 (2015)
- Villar G. & Wallace M. I., Nat. Nanotechnol., 12, 803–8 (2007)
- Weatherill E. E. et al., J. Mol. Biol., 427, 146–57 (2015)
謝辞
装置写真の利用を許可していただいた Dek Woolson 教授(ブリストル大)、技術指導をしていただいた Hagan Bayley 教授、Radhakrishnan Mahendran 博士(オックスフォード大)、本稿執筆にあたり助言をいただいた能代大輔博士(金沢大)に御礼申し上げます。


