概要
細胞内では、分子が集団として不均一な時空間パターンを形成することで様々な生命現象が制御されている。しかし、様々な因子が存在する生細胞の観察からその複雑な振る舞いを理解するのは容易ではない。そこで本稿では、最少因子を用いて人工細胞内において反応拡散波と呼ばれる分子集団の波状運動を形成する手法を紹介する。波の発生および観察に必要な3種類のタンパク質、エネルギー分子ATPおよび分子混雑剤BSAを人工細胞内に内包するだけでタンパク質濃度勾配の波を形成することができ、タンパク質の集団としての機能の解析が可能となる。本稿では必要なタンパク質の調製法(100回程度の人工細胞実験分に相当)と人工細胞の作製法、反応拡散波の発生法を述べる。タンパク質の発現精製には3~4日かかるが、人工細胞の作製および反応拡散波の観察は1日で完了する。
イントロダクション
タンパク質は複合体形成や酵素反応、構造変化などを連鎖的に行うことで生命現象を制御する核となっている。しかし、これらの古典的な機能だけではなく、分子が集団としてどのように振る舞うのかを知ることは、単純な相互作用を超えた高次の生命現象を理解するために重要である。実際に、細胞分裂や極性など様々な生命現象を制御する分子の時空間パターンは、分子1つの振る舞いや分子間相互作用では説明できず、分子を集団として捉えることで初めて理解可能であることが分かってきている。このような分子集団によって生まれる高次構造やパターンは空間の境界条件に大きく影響を受けるため、その理解には細胞構造の模倣物である人工細胞内においてタンパク質が形成する時空間パターンを解析可能な実験系が必要である。
本稿ではこのような試みの1つとして、大腸菌の細胞分裂面決定系であるMin波の人工細胞内再構成の手法を紹介する(1)。Min波は細胞極間を往復するタンパク質の反応拡散波であり、細胞分裂環を構成する細胞骨格(FtsZ)の重合を制御する(2)。反応拡散波は動物の体表模様の形成原理として有名であり、局所的な分子の生化学反応と空間全体へと広がる拡散が組み合わさることで出現するが、Min波以外にも様々な細胞内反応拡散波が報告されている。その中でもMin波は生物由来の反応拡散波の中で唯一再構成系が確立されており、活性化因子であるMinD、阻害因子であるMinE、エネルギー分子ATPと脂質膜だけで再現することができる。本稿では、より細胞内のMin波に近い条件として、MinDと共局在するMinCも加えたMinCDEの3種類のタンパク質を用いた実験法を記述する(図1)。
脂質膜をもつ人工細胞系として最も簡便なのが、液滴が脂質一重膜で覆われた油中水滴である。脂質が溶けた油中に目的タンパク質(本稿においてはMinタンパク質)を含むごく少量の溶液を分散させるだけで、油中水滴を作製することができる。Min波の発生実験においては、人工細胞に内包するためのMinタンパク質を大腸菌を用いて発現したものを精製し、エネルギー分子ATPを含む低分子と細胞内の分子混雑環境を模倣するためのBSAの混合液を調製する。この溶液を用いて油中水滴を作製することで、膜上を伝播する波や極間振動波として振る舞うMin波を発生させることが可能である。Min波の動きはMinタンパク質に融合したGFP蛍光の蛍光顕微鏡観察により可視化できる。このような基本的なMin波の発生法と合わせて、応用としてATP合成系(CP-CK系)を利用したMin波の発生タイミングの制御法(3)およびMin波の速度の制御法(4)も紹介する。
装置・器具・試薬・解析ソフトウェア
装置・器具・試薬
- 細胞用の超音波破砕機(各社)
- 超音波洗浄器Bransonic(Branson)
- 遠心機(各社)
- 落射型蛍光顕微鏡または共焦点レーザー顕微鏡(各社)
- アミコンウルトラ(3K,10K,30K,50K)(Millipore)
- ガラスミクロチューブNo.2(マルエム)
- Neoカバーグラス25 mm × 36 mm(松浪硝子)
- Neoカバーグラス18 mm × 18 mm(松浪硝子)
- 両面テープ(ニチバン)
- デュラシール(Diversified Biotech)
- マイレクス HVフィルター、ポアサイズ0.45 μm(Millipore)
- アルゴンガスあるいは窒素ガス(各社)
- チューブフロート(各社)
- ボルテックスミキサー(各社)
試薬
- タンパク質発現用大腸菌コンピテントセル
- Minタンパク質発現プラスミド
- LB培地
- 発現プラスミドに対応した抗生物質
- Ni-NTAアガロース(各社)
- グルタミン酸カリウム
- グルタミン酸マグネシウム
- イソプロピル-β-チオガラクトピラノシド(IPTG)
- トリスヒドロキシメチルアミノメタン
- HEPES
- 塩化ナトリウム
- イミダゾール
- ジチオトレイトール(DTT)
- フッ化フェニルメチルスルホニル(PMSF)
- エチレンジアミン四酢酸(EDTA)
- 大腸菌極性脂質(Avanti,catalog number: 100600C)
- ウシ血清アルブミン(BSA)(Sigma-Aldrich,catalog number: A6003)
- アデノシン-5’-二リン酸(ADP)
- アデノシン-5‘-三リン酸(ATP)
- デオキシアデノシン三リン酸(dATP)
- ミネラルオイル(ナカライテスク,catalog number: 23306-84)
- クレアチンリン酸(ナカライテスク)
- クレアチンキナーゼ(Roche)
実験手順
- タンパク質の調製
- 1-1. Minタンパク質の発現および精製
- 1-2. BSAの調製
- 人工細胞作製用の脂質の調製
- 人工細胞の作製
- 人工細胞の観察
実験の詳細
1. タンパク質の調製
1-1. Minタンパク質の発現および精製
Min波の発生に必要な3種類のタンパク質MinCDEを発現および精製する。本稿ではMinCによりMin波を観察するためのHis-msfGFP-MinC(53 kDa),His-MinD(31 kDa),MinE-His(11 kDa)の調製方法について記述する。各タンパク質発現用のプラスミドを作製し、大腸菌を形質転換する。筆者はプラスミドはpETベクター、大腸菌はBL21-CodonPlus(DE3)-RIPLを用いているが、Minタンパク質は大腸菌由来のため他の株でも特には問題ない。MinDはC末端、MinEはN末端に膜結合領域があるため、タグはそれぞれN末端とC末端につけるのが好ましい。形質転換した大腸菌はLB液体培地で前培養した後に本培養を行う。筆者は通常200 mL培地に1%植菌し、37℃,200 rpmで震盪している。大腸菌内発現においてはOD600 = 0.4–0.6においてIPTG添加により発現誘導することが多いが、Minタンパク質の過剰発現は細胞分裂を阻害するため、OD600 = 0.8において終濃度1 mM IPTGを添加することで発現誘導を行う。その後37℃,200 rpmで1.5–3時間震盪した後、遠心により菌体を集菌する。菌体は−80°Cにおいて冷凍保存可能である。
タンパク質の精製はNiアフィニティークロマトグラフィーによって行う。菌体1 g程度に5 mLのLysis buffer [50 mM Tris-HCl(pH 7.6),300 mM NaCl,1 mM PMSF,20 mM imidazole,1 mM DTT] を加え、超音波破砕する。このとき、膜結合タンパク質であるMinDを膜から解離させ可溶性画分として取得するため、MinDの場合のみ0.1 mM ADPを予め加えておく。これはATP依存的にMinDが膜結合する性質を利用している。超音波破砕後、遠心(20,000 ×g,4℃,30 min)し、上清を可溶性画分として取得する。可溶性画分をポアサイズ0.45 μmのフィルターに通した後、予め平衡化したNi-NTAアガロース(以下Ni樹脂)と混合する。4℃,30 min震盪した後、オープンカラムにNi樹脂を添加し、素通り画分を取得する。その後カラムボリューム(CV)の20倍のWash buffer [50 mM Tris-HCl(pH 7.6),300 mM NaCl,1 mM PMSF,0.1 mM EDTA,25 mM imidazole,10% glycerol] で洗浄し、2 CVのElution buffer [50 mM Tris-HCl(pH 7.6),300 mM NaCl,1 mM PMSF,0.1 mM EDTA,500 mM imidazole,10% glycerol] により溶出する。Wash bufferおよびElution bufferはMinDの精製においてもADPは不要である。また、以上の操作は全て4℃で行う。ここではNi樹脂にタンパク質を結合させてからカラムにロードする手法を記述したが、事前に詰めたオープンカラムに可溶性画分をロードする方法でも同様に精製できる。最後に、アミコンウルトラを用いて溶出画分をStorage buffer [50 mM HEPES-KOH(pH 7.6),150 mM GluK,0.1 mM EDTA,10% glycerol] に交換する。MinDのみ0.1 mM ADPを加えたStorage bufferを用いる。また、KClやNaClなどの一般的な塩でも可能であるが、近年ボトムアップ合成生物学の分野で広く用いられている無細胞転写翻訳系と組み合わせるなど実験系を拡張する際に塩化物イオンやナトリウムイオンが阻害的に働くことがあるため、GluKを使用している。アミコンウルトラ(msfGFP-MinCは10Kあるいは30K,MinDは10K,MinEは3K)に溶出画分を添加して遠心により濃縮した後にStorage bufferを加える操作を、元のバッファーが1/1000以下になるまで繰り返す。また、筆者の経験上ではMinDのみ濃縮が次第に遅くなるという現象が頻繁に起こる。この原因としてMinDがオリゴマー形成しやすく、フィルターに詰まってしまうことが考えられる。濃縮が遅くなった場合は、アミコンのフィルターを新しいものに変えることで改善する場合がある。また、MinCおよびMinEは陰イオン交換により精製純度を高めることが可能であるが、MinDはイオン交換やゲル濾過クロマトグラフィーでは溶出されないことを確認しているため、現時点ではタグによるアフィニティー精製が唯一の策となっている。
精製後、精製過程における全ての画分をSDS-PAGEすることで純度を確認する。また、バッファー交換および濃縮した精製タンパク質と市販のBSAの希釈系列を泳動し、CBB染色後のバンドの太さから最終産物の濃度を定量する。筆者は人工細胞を用いた実験で扱いやすくするため、Storage bufferを用いて100 μMに希釈し、1回の実験で使う量(3–5 μL)毎に分注し、−80°Cにおいて冷凍保存しておく。
1-2. BSAの調製
油中水滴内においてMin波を発生させるには、分子混雑剤として高濃度のBSAを入れる必要がある。これは、細胞サイズの空間では膜吸着が促進されるため、分子混雑剤による競合効果で膜吸着を試験管と同程度まで抑える必要があることに由来する(5)。注意事項として、PEGやFicollのような脂質膜との相互作用が弱い混雑剤では効果がない、ということである。BSAは約100 mg/mLになるように水に溶かし、その後アミコンウルトラ-0.5 50Kを用いて水が1/1000以下になるまでReaction buffer [25 mM Tris-HCl(pH 7.6),150 mM GluK,5 mM GluMg] で洗い、さらに濃縮する。Reaction bufferのGluKおよびGluMgはそれぞれKClおよびMgCl2に変更しても問題ない。BSAの濃度を280 nmにおける吸光のBSA単位あるいはBCA assayにより定量する。このとき、Min波の反応溶液の調製の都合上、BSAは300 mg/mL以上の濃度まで濃縮しておく。BSAは低吸着チューブに移し、室温において最長1ヶ月保存できる。
2. 人工細胞作製用の脂質の調製
大腸菌の極性脂質をミネラルオイルに分散させた溶液を調製する。PCおよびPGの混合脂質を用いてもMin波の発生は可能であり、この場合はアニオン性脂質が30 mol%になるようにする。クロロホルムに溶けている極性脂質25 mg/mLを20 μLとり、ガラスミクロチューブに移す(図2a)。そしてガラスミクロチューブにアルゴンガス(窒素ガスでも可能)を穏やかに吹き付け、クロロホルムを揮発させ、脂質のフィルムを作製する(図2b)。このとき、ガラスミクロチューブを斜めに傾けながら一定速度で回転させることで均一なフィルムとなるようにする。クロロホルムが完全に揮発したらミネラルオイルを500 μL添加し、デュラシール、パラフィルムの順にガラスミクロチューブを密閉する(図2a)。チューブフロートを用いてこのガラスミクロチューブを超音波洗浄器に浮かせ、60℃で90分間超音波処理を行い、脂質をオイル中に分散させる。その後、1分間ボルテックスをし、完全に脂質を分散させる。
3. 人工細胞の作製
Minタンパク質の反応溶液を脂質が分散した油に分散させることで人工細胞を作製する(1)。まず0.1 μM His-msfGFP-MinC,1 μM His-MinD,1 μM MinE-His,2.5 mM ATP,100 mg/mL BSAの溶液をReaction buffer中に調製する。人工細胞作製には1–2 μLの反応溶液しか用いないため、10 μL調製すれば十分である。次に脂質溶液50または100 μLを0.6 mLチューブに入れ、そこに反応溶液1または2 μLを添加する(図2c)。このとき、脂質溶液と反応溶液が50 : 1の体積比だと油中水滴が作りやすい。反応溶液を入れた後、チューブを10–20回タッピングし反応溶液の液滴を細かく分散させることで人工細胞が作製される。適切に人工細胞が作製されている場合、液滴一粒一粒を判別できないくらい細かくなり白濁しているはずである(図2c)。
Min波がATP依存的に発生することを利用し、人工細胞作製後に人工細胞中でATPが合成されるようにすることで、Min波を発生させるタイミングを制御することができる(3)。この場合は、ATPの代わりに2.5 mM ADPおよび10 mM creatine phosphate,4 ng/μL creatine kinase(CK)を用いて反応溶液を作製する。ATPが十分濃度に達する10–20分後にMin波が発生する様子が観察できる。このMin波の発生するタイミングはCKの濃度により調節できる。
また、ATPの代わりにエネルギー分子としてdATPを用いるとMin波の速度を2倍程度に速くすることができる(4)。これはdATP結合型のMinDは膜結合力が弱くなり、阻害因子MinEの相対的な濃度が増加するからであると考えられる。さらに、ATPとdATPを混合すると、dATPが多いほど波が速くなるというように、その混合比により様々な速度のMin波を発生可能である。
4. 人工細胞の観察
人工細胞は2枚のカバーガラス間のスリットに人工細胞溶液を注入することで観察する。2枚のカバーガラス(筆者は25 mm × 36 mmと18 mm × 18 mmを使用している)および両面テープを用意する。両面テープを小さいカバーガラスと同程度の長さで幅が約1 mmのサイズに切り分け、2本の両面テープをスペーサーとして大きいカバーガラスの上に小さいカバーガラスを貼りつける(図2c、下図)。この観察用カバーガラスは人工細胞の作製前に用意しておくと良い。
3. で作製した人工細胞溶液を20 μLとり、カバーガラス間のスリットにゆっくりと流し込む(図2c)。スリットが人工細胞溶液で満たされていない場合は、溶液を追加で注入する。大きいカバーガラスから溢れていなければ、スリットから人工細胞溶液が漏れていても問題ない。
作製したサンプルのGFP蛍光を落射型蛍光顕微鏡または共焦点顕微鏡で観察する。サンプル作製直後は波が安定していないこと、そして人工細胞溶液注入の影響で人工細胞が動いてしまうことから、5–10分後に観察を開始すると良い。観察には10–40倍のレンズを用い、直径5–50 μm程度の人工細胞を観察する(図3a)。これ以下のサイズの人工細胞ではMin波は発生しないが、これ以上の大きさの人工細胞内のMin波を観察することは可能である。直径25 μm以下の人工細胞では波の数が1つのMin波が、それ以上の大きさの人工細胞では波が複数となり、人工細胞サイズが大きくなるほど波の数は増加する。波数が1つのMin波を観察する際は20–40倍のレンズ、波が複数のMin波を観察する際は10–20倍が観察しやすい。応用例として、Min波の再構成系は他の蛍光分子や無細胞転写翻訳系と共に用いられる場合がある。拡張した実験系においてMinタンパク質以外の分子の観察や蛍光強度の定量などを行う場合は共焦点顕微鏡による観察が適しているが、落射型蛍光顕微鏡であれば焦点面の上下の様子も見られるため、波の動き方をより正確に捉えることができ、膜上を伝播する波やある軸を挟んだ極間を振動する波が見られる(図3b)。条件によるが、Min波の周期はおよそ60–120秒であるため、10秒間隔でタイムラプス撮影することでその動きを記録することができる。
工夫とコツ
Min波が発生しない場合
正しく溶液を調製してもMin波が発生しない場合、Minタンパク質やBSAの濃度、BSAの劣化、温度などが原因として考えられる。特にMin波の発生はMinタンパク質濃度に敏感であるため、観察結果に応じてMinDE濃度を変えて波が発生するかを検討していただきたい。例えば、GFP蛍光が細胞質に見られる場合はMinEによりMinDが全て膜から解離させられている状態である。したがって、MinEを減らす、もしくはMinDを増やすことで解決できる可能性がある。GFP蛍光が膜上に見られる場合はこの反対である。
また、BSAの濃度が正しくないことやBSAの劣化の可能性もある。300 mg/mL以上のBSA溶液は粘性が極めて高いため、溶液の吸引の際はゆっくり吸って正しい量を取れているか目視で確認すること、溶液を吐出する際は吐出後にピペッティングしチップ内に吸着した溶液を出し切ると正確性が高まる。また、BSA溶液の調製から1ヶ月経っていない場合でも溶液が劣化し、Min波が正常に発生しないことがある。この場合は新たにBSA溶液を調製する。
さらに、Min波の発生に影響する因子として温度が挙げられる。Min波は温度が変化しても発生可能であるが(少なくとも25℃程度の室温から37℃までは発生することを確認している)、温度によって反応パラメータが変化することから、温度が変わるとMin波が発生するタンパク質濃度領域も変化してしまう。実験日によって室温が変化することや、顕微鏡の長時間稼働により顕微鏡周囲の温度が高くなることがあるため、一度確認していただきたい。
人工細胞によるMin波の挙動の差が大きい場合
Min波の発生率が低い場合や、Min波の動き方や速度のばらつきが大きい場合、主に2つの原因が考えられる。1点目は上記の「Min波が発生しない場合」と同様に分子濃度や温度のずれによって波の出現条件から外れてしまっている可能性である。上記の内容を検討しても改善しなかった場合、人工細胞作製の際に、脂質溶液に内液を添加後できるだけすぐにタッピングを開始すると、Min波のばらつきが改善する可能性がある。これは、タッピング開始に時間がかかると内液と脂質溶液の界面に形成された脂質膜にMinタンパク質が結合してしまうからである。この状態でタッピングをすると人工細胞間でタンパク質濃度がばらついてしまう。したがって、人工細胞作製の操作は素早く行うと良い。
人工細胞が上手く形成されない場合
人工細胞が綺麗な球状でない、GFP蛍光が人工細胞の底面に吸着して見える、などの現象が見られる場合、脂質や観察に使用しているガラスに問題がある可能性がある。まず、脂質については脂質フィルムの作製の際にクロロホルムが完全に揮発しているか確認していただきたい。上手く乾燥できない場合は、デシケーターを用いた減圧乾燥を追加すると良い。脂質が問題なく調製できていても、観察用のガラスに人工細胞やタンパク質が吸着して上手く観察できない場合がある。一般に、ガラスと脂質膜は吸着する性質があるため、予めコーティングが施されているNEOカバーグラス(松浪硝子)を使用すると良い。また、観察用スライドガラスの作製前に70%エタノールでガラス表面を拭くことで改善される場合もある。
実験の安全
クロロホルムは揮発性が強く有毒であるため、クロロホルムが伴う脂質調製の操作は手袋を着用しドラフト中で行う。
文献
- Kohyama, S. et al., eLife, 8, e44591 (2019).
- Rowlett, V.& Margolin, W., Curr. Biol., 23, R553–6 (2013).
- Takada, S. et al., Sci. Adv., 8, eabm8460 (2022).
- Takada, S. et al., ACS Nano, 16, 16853–61 (2022).
- Nishikawa, S et al., Adv. Sci., in press, DOI: 10.1002/advs.202308030.
謝辞
本稿執筆にあたりご助言をいただいた藤原慶准教授(慶應大)および本系の基盤を確立され伝授くださいました光山隼史博士(Max Planck研究所)に感謝申し上げます。
-
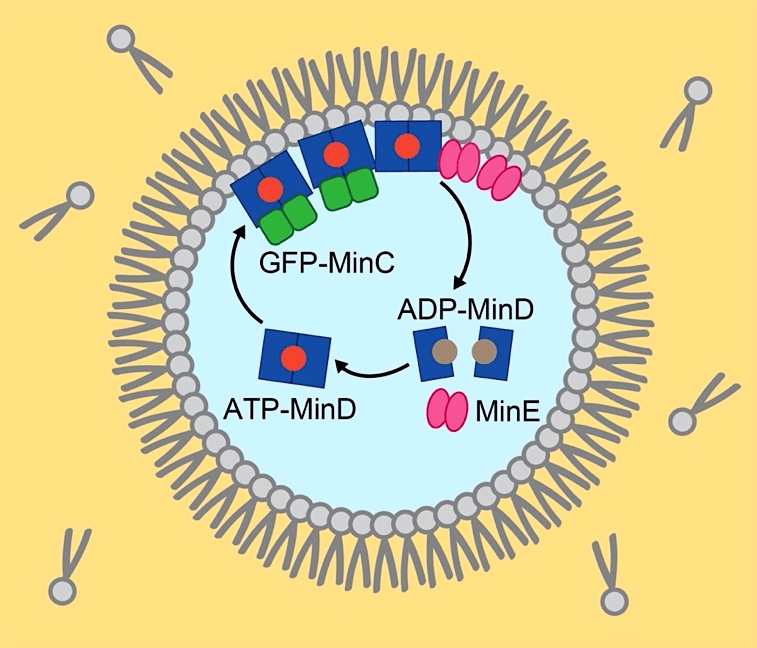
図1:エマルション内におけるMin波の再構成の実験系の概略
脂質が溶けた油相とMinタンパク質を含む水相の界面にリン脂質が並ぶことで脂質膜が形成される。脂質膜上および細胞質中におけるタンパク質の拡散とATPase反応が繰り返されることでMin波が形成される。 -
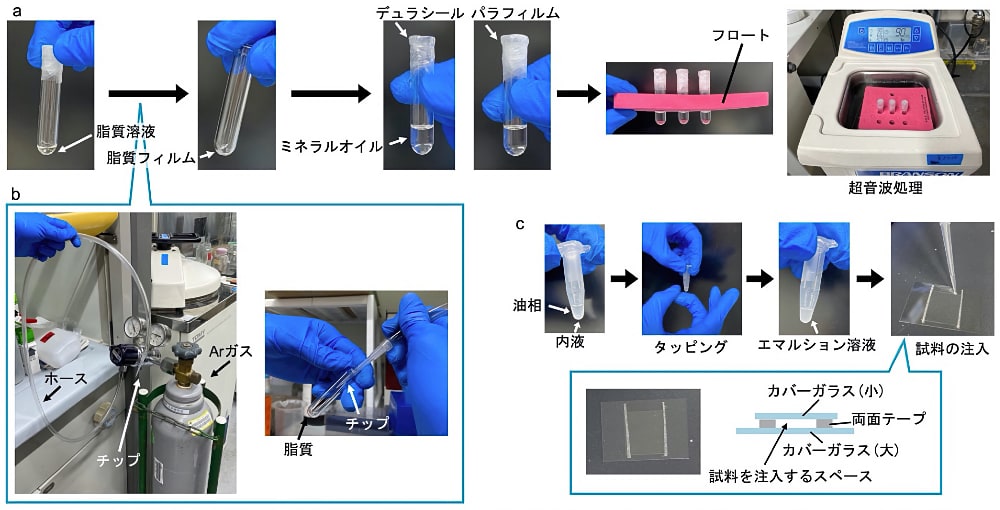
図2:脂質調製および人工細胞作製の概略
a)脂質溶液調製の様子。脂質が溶解したクロロホルムを揮発させ、ガラスチューブ底面に脂質フィルムを作製する。ミネラルオイルを添加した後、ガラスチューブの口を密閉し、超音波処理を行う。b)Ar ガス周辺の器具とAr ガスを吹き付けることでクロロホルムを揮発させている様子。c)エマルション作製の様子および顕微鏡観察用スライドガラスの実物・模式図。 -
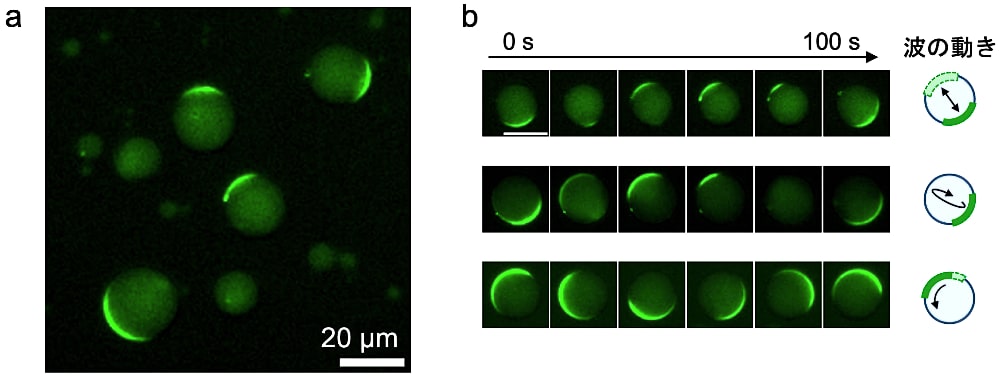
図3:人工細胞内において再構成したMin波の蛍光顕微鏡画像
a)全体像の一例。b)各人工細胞のタイムラプス画像および波の動き方の模式図。Scale bar:20 μm


