概要
狂牛病の原因として知られているプリオンは、核酸を必要としない特異な感染体である。プリオンの感染性はプリオン蛋白質の立体構造が変化(異常化)することが原因と考えられている。正常型のプリオン蛋白質も異常型のプリオン蛋白質も一次構造が同じためにSDS-PAGEとウエスタンブロット法を用いた通常の蛋白質の検出では、両者を区別することはできない。そこで、異常型プリオン蛋白質のみを検出するために、異常型プリオン蛋白質がProteinase Kの分解に対して部分的に抵抗性を持つことと、その抵抗性蛋白質が易沈殿性であることを利用する。本稿では、プリオンが持続的に感染している神経芽細胞腫細胞由来のProteinase K耐性プリオン蛋白質(PrPres)を検出する一連の手法を紹介する。この手法では培養細胞から蛋白質の抽出後、1日でPrPresを検出することができる。
イントロダクション
プリオンは牛海綿状脳症(Bovine Spongiform Encephalopathy, BSE)に代表されるプリオン病、伝達性(伝染性)海綿状脳症(Transmissible Spongiform Encephalopathy, TSE)を引き起こす(1)。プリオン病はウシの他、ヒト、ヒツジ、マウス、ハムスター、ネコ、シカ、ミンクなどの哺乳類で発症することが知られており、致死性の脳神経疾患である。(1)。代表的なヒトプリオン病のクロイツフェルト・ヤコブ病(Creutzfeldt-Jakob disease: CJD)には3つの病因があり、原因不明の孤発性CJD、プリオン蛋白質をコードする遺伝子に変異があることで発症しやすくなる家族性CJD、プリオンの感染により発症する獲得性CJDに分類される(1)。動物種や病因のタイプに限らず、いずれのプリオン病も原因はプリオン蛋白質のコンフォメーションの変化によるものと考えられている。プリオン蛋白質は神経細胞で常に産生されているが、正常型ではプリオン病を引き起こさず、異常型になることでプリオン病を引き起こす。一次構造が同じプリオン蛋白質の正常型と異常型を見分ける方法として、Proteinase Kの分解に対する抵抗性の違いを利用する方法がある(1)。異常型プリオン蛋白質(つまり、プリオン)はProteinase Kに対して部分的に抵抗性を持つ。そして脳組織からProteinase K耐性のPrPを検出することが、プリオン病の診断基準の1つになっている。一方、マウス神経芽細胞腫Neuro2A (N2a)細胞にプリオンを感染させ、細胞を継代しても持続的にプリオンを維持しているプリオン持続感染細胞が細胞研究で広く使われている(2,3)。例えば、プリオンに対する薬剤のスクリーニングや、プリオン増幅に関与する内在性因子の解析で利用されている(4-8)。動物実験を行うよりも安価で短時間で解析できる点、そして動物愛護の観点において、使用する実験動物数の数を減らせる点で、プリオン持続感染細胞を使用するメリットは大きい。本稿では、このプリオン持続感染細胞のPrPresを検出する一連の手法を紹介する(7,8)。
用語の説明
プリオンがつく単語には「プリオン」、「プリオン蛋白質」、「正常型プリオン蛋白質」、「異常型プリオン蛋白質」、「Proteinase K耐性プリオン蛋白質」と様々あり、混乱を生じやすいので、この欄で紹介する。「プリオン蛋白質」は遺伝子PRNPがコードする蛋白質の名前であり、一般的にPrPと表記される。プリオン蛋白質は、特に脳で強く発現しているが様々な組織の細胞でも発現している。名前にプリオンがつくために誤解されやすいのだが、「プリオン蛋白質」自身は、病原性や感染性を意味するものではない。病原性や感染性をもつ意味で使用される「プリオン」はプリオン蛋白質の立体構造が異常型になって、正常型のプリオン蛋白質を異常型に変換する能力を持つ。ヒツジのプリオン病名、スクレイピー(scrapie)から、動物種に関係なく、プリオンはPrPscと表記され、正常型プリオン蛋白質はPrPc (cellular prion protein)と表記される。一方、プリオン持続感染細胞の異常型プリオン蛋白質はProteinase Kに対して抵抗性を持つことからPrPres (protease-resistant prion protein)と表記される。PrPscもPrPresも「異常型プリオン蛋白質」ではあるが、PrPscは感染性を持つ意味で使われ、PrPresはProteinase K耐性を持つ意味で使われており、PrPresは必ずしも感染性を意味するわけではない。Proteinase Kに感受性がありながら感染性を示すプリオンが存在するという報告や、in vitroで増幅した異常型蛋白質はProteinase K耐性だが、必ずしも感染性を持たないという報告がある(9,10)。
実験の原理
プリオン持続感染細胞の細胞内にあるPrPは全てがPrPresということではなく、PrPcも含まれる。この両者は一次構造が同じために、SDS-PAGEで区別することはできない。そこで、PrPresのみを検出するためには、SDS-PAGEを行う前に全PrPに含まれるPrPcを取り除かなければならない。そのために、本実験では検体のProteinase K (PK) 処理と遠心分離を行う。PrPresはPK処理によってN末端が切断されるが、おおよそ90アミノ酸残基以降のC末端は部分的にPK抵抗性を持つために、N末端を欠いたPrPが残る。このN末端欠損型PrPは特定の界面活性剤存在中の試験管内で(アミロイドを形成しているかは不明であるが、)容易に沈殿する性質を持つようになる。従って、超遠心機を用いなくてもN末端欠損型PrPは遠心分離で沈殿し、(PK処理はPrPcが完全に消化される条件ではあるが、)PrPcがPK処理で完全に切断しきれなかったとしてもPrPcは上清画分に分離されて取り除かれる。そして、沈殿画分をSDS-PAGEとウエスタンブロットを行うことで、PrPresを検出することができる。以上のことから、本実験のPK処理はアミロイドにみられるPK耐性の蛋白質を検出するという単純なものではない。本実験のPK処理はPrPcを分解させるだけではなく、PrPresの沈殿性を高めるための処理でもあるという点で、他のアミロイド蛋白質の検出とは異なる。
装置・器具・試薬
- CO2インキュベーター
- 安全キャビネット
- アスピレーター
- 細胞培養用(6 well) plate
- 冷却遠心機(最大遠心力20,000 x g)
- SDS-PAGEを行うにあたり必要な機器(電気泳動槽、泳動プレート、パワーサプライ)
- セミドライトランスファー装置
- イメージング装置、あるいはX線フィルムと現像機
- PVDF膜
- 3MM紙
- セーフロックチューブ
- PBS(-)
- 細胞溶解液(PBS(-), 0.5% NP40, 0.5% デオキシコール酸ナトリウム)
- 1 mg/mL Proteinase K
- 0.1 M フッ化フェニルメチルスルホニル(PMSF)
- SDS-PAGE用サンプルバッファー(25 mM Tris-HCl pH6.8, 1% SDS, 0.05% ブロモフェノールブルー, 4% グリセロール, 140 mM 2-メルカプトエタノール)
- SDS-PAGE用泳動バッファー(25 mM Tris, 192 mM glycine, 0.1% SDS)
- トランスファーバッファー(陽極液1 300 mM Tris, 20% メタノール; 陽極液2 25 mM Tris, 20% メタノール; 陰極液 25 mM Tris, 40 mM 6-アミノカプロン酸, 20% メタノール)
- TTBS(25 mM Tris-HCl pH7.6, 0.5 M NaCl, 0.05% Tween-20)
- ブロッキングバッファー(5% スキムミルク in TTBS)
- 抗体(一次抗体anti-PrP antibody、二次抗体)
- ウエスタンブロット用検出試薬
実験の手順
- 細胞から細胞溶解液作製
- Proteinase K処理と遠心分離
- SDS-PAGEとウエスタンブロット
実験の詳細
1. 細胞から細胞溶解液作製
6 wellプレートでプリオン持続感染細胞をコンフルエントの状態まで培養する。安全キャビネット内で培養液をアスピレーターで取り除く。冷PBSをプレートの縁から1 mL加え、軽く撹拌、アスピレーターでPBSを取り除く。 冷抽出バッファーを500 μL加え、細胞全体に行き渡るように軽く撹拌して細胞を溶解させる。1分後、1.5 mLチューブに細胞溶解液を回収する。3,000 x g、10分、4℃で遠心する。沈渣を取らないように上清を1.5 mLチューブに回収する。
2. Proteinase K (PK)処理
回収した細胞溶解液200 μlをセーフロックチューブに用意して1 mg/mLのProteinase Kを100倍希釈して終濃度10 μg/mLになるように加え、37℃、30分で蛋白質分解反応を行う。チューブを氷上で冷却し、その後0.1 M PMSFを2 μL加えて蛋白質分解反応を止める。その後、チューブを混和装置にセットして室温で5分間、溶液を混和する。そして20,000 x g、20分、4℃で遠心後、上清を取り除く。SDS-PAGE用サンプルバッファーを20 μL添加して激しく撹拌する。5分間煮沸して蛋白質を変性させる。
3. SDS-PAGEとウエスタンブロット
15% ポリアクリルアミドゲルを作製(または、プレキャストゲルを使用)し、10 μLのサンプルを注入して通常のSDS-PAGEを行う。
電気泳動後、セミドライトランスファー装置を用いてPVDF膜に転写する。予め、PVDF膜をメタノールに染み込ませ、その後、10分以上精製水で浸透して、水に馴染ませる。また、3MM紙2枚を陽極液1に、1枚を陽極液2に、3枚を陰極液に浸す。(下面が陽極のセミドライトランスファー装置では)陽極液1を浸した3MM紙2枚をトランスファー装置の上に置く。その上に陽極液2を浸した3MM紙1枚を置く。さらに、精製水で平衡状態にさせたPVDF膜を置く。そして、SDS-PAGEを行ったゲルを置く。最後に、陰極液を浸した3MM紙3枚を重ねる。3MM紙やPVDF膜、ゲルを重ねる際には、気泡が入らないように注意する。装置の準備が完了後、2mA/cm2の定電流で40分から60分、転写を行う。
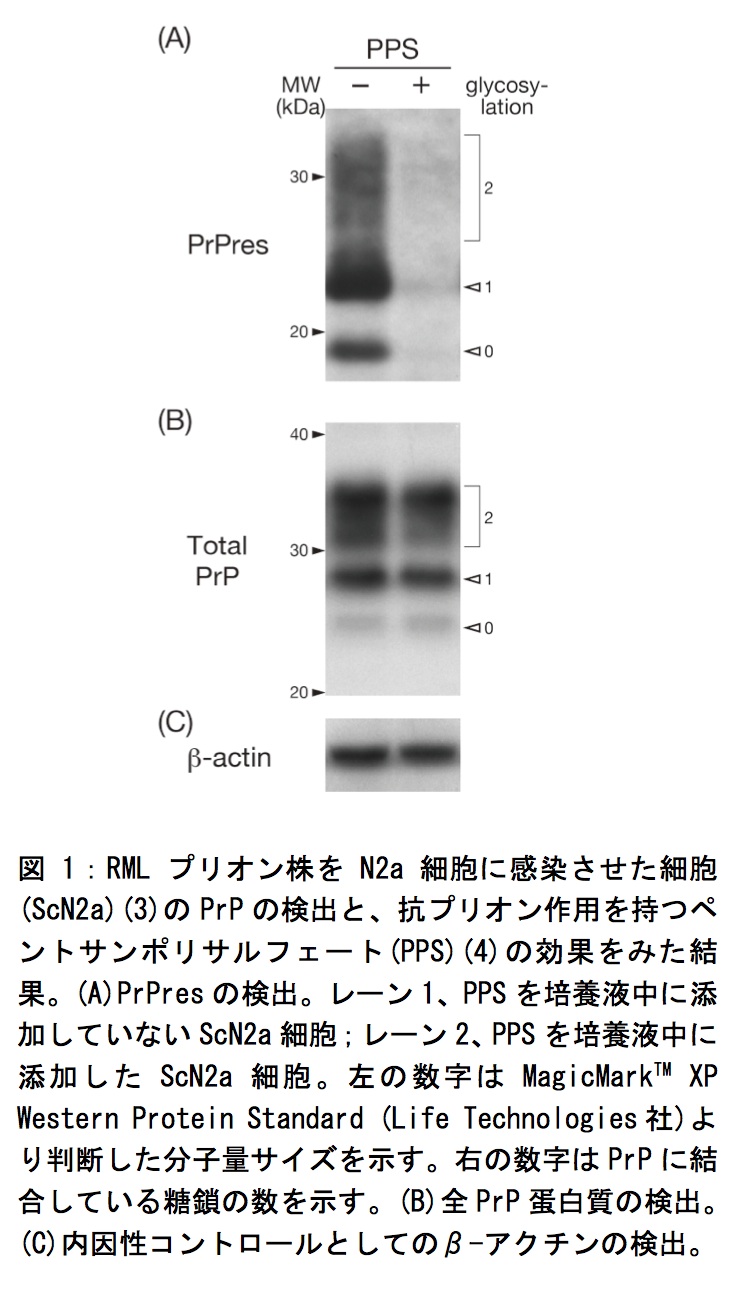
蛋白質を転写したPVDF膜は、ブロッキングバッファー中で1時間のブロッキングを行う。TTBSで3回洗浄したあと、1次抗体anti-PrP antibodyを1時間反応させる。そして、TTBSで3回洗浄し、2次抗体を1時間反応させる。その後、TTBSで3回洗浄し、検出試薬を用いてPrPresのシグナルを検出する(図1A)。PrPは糖鎖結合部位が2箇所あるため、無糖鎖型PrP、一糖鎖型PrP、ブロードな二糖鎖型PrPの3本のバンドが検出される。無糖鎖型PrPは20 kDaより少し小さく、一糖鎖型は22 kDa、二糖鎖型は28 kDa付近にバンドが検出される。PK処理をするとPrPのN末端側は分解を受けてPK耐性のC末端が残るために、PK未処理のPrP全長に比べ小さい分子量になる(図1A,B)。
工夫とコツ
細胞培養
当研究室ではOPTI-MEMに10% FBSを加えた溶液(6 well plateの場合3mL)を培養液として使用している。プリオン持続感染細胞の倍加時間は、細胞株の種類によって異なるが、おおよそ24時間である。細胞を3日間培養して蛋白質を回収する場合は、コンフルエントの細胞を8-10倍に希釈して約2 x 105 cells/wellを播いて培養する。3日後にはコンフルエントの状態に達し、約2 x 106 個の細胞が得られる。
細胞溶解液
PK処理を行うため、PKを阻害するようなセリンプロテアーゼインヒビターを加えてはならない。
蛋白質の定量
蛋白質の定量を行う場合は、細胞溶解液に界面活性剤が入っているためにBradford法は使用できない。当研究室ではLowry法を採用している。本条件では、1ウェル当たりコンフルエント状態の細胞からおよそ1 mgの総蛋白質量が得られる。後のSDS-PAGEでは、1レーンあたり200 μgの総蛋白質を使用してPK処理した量相当を添加すれば、PrPresの検出が可能である。
PrPresの遠心分離
組織からPrPresを検出する目的で組織溶解液に陰イオン性界面活性剤のサルコシルを使用するプロトコールがあるが、細胞溶解液にサルコシルを使用すると高分子の核酸がゲル状となり、PK処理を行った後のPrPresの分離が困難となる。本実験では、陰イオン性界面活性剤にデオキシコール酸ナトリウムを使用している。この界面活性剤を使用することで、高分子の核酸は糸くず状のまま除くことができる。また、PK処理後のPrPが容易に沈殿しやすくなり、一般的な遠心機で可能な20,000 x gの遠心力でPrPresを沈殿させることができる。
実験の詳細2では、遠心後の沈殿物が見えないので、上清を取り除く際に誤って沈殿物も取り除いてしまう可能性がある。そこで、遠心前の溶液に100倍希釈したglass milkを5 μL加えてから遠心することで、沈殿物を見やすくすることができる。
SDS-PAGE用サンプルバッファー
プリオン株によっては還元剤の2-メルカプトエタノールを加えないほうが検出しやすいことがあるので、PrPresの検出が弱い場合には、2-メルカプトエタノールのないサンプルバッファーを試してみるのも良い。
PVDF膜への転写
ポリアクリルアミドゲルの厚さによって転写時間を調節する。当研究室では、厚さが1.0 mmの場合は40分、1.5 mmの場合は60分で行っている。
ウエスタンブロット
当研究室では一次抗体にanti-PrP monoclonal antibody SAF83 (SPI-Bio社)を5,000倍希釈で使用している。また、二次抗体はAnti-Mouse IgG (H+L), AP Conjugate(Promega社)を20,000倍希釈で使用している。検出はCDP-Star detection reagent (GE Healthcare社)を使用し、イメージアナライザー又はX線フィルムで検出を行っている。
全PrPと内因性コントロールの定量
PrPresの定量を行う際には全PrPとインターナルコントロールを検出して、全PrPの増減変化の確認とサンプル間の標準化を行うと良い。プリオン持続感染細胞の全PrPに含まれるPrPresの割合は100%ではなく、感染細胞の種類によるが、5-50%程度であるので、全PrPを検出するためには、PrPresの検出で使用した細胞溶解液より少なくて良い。実験の詳細1で得られた細胞抽出液40 μLに、5xサンプルバッファーを10 μL加え、5分間煮沸して蛋白質を変性させる。その後は、実験の詳細3と同様に全PrPを検出する(図1B)。検出したメンブレンをストリッピングバッファー(2 M glycine, pH2.8[HClで調整])に浸して、室温、30分の処理で抗体をはがす。新たにインターナルコントロール用の抗体を反応させて、検出を行う。当研究室では一次抗体にAnti-β-Actin monoclonal antibody (SIGMA社)を10,000倍希釈で使用している。
PrPの糖鎖除去
プリオン蛋白質をアスパラギン型糖鎖を切断する酵素、ペプチド:N-グリカナーゼ(PNGase)で消化することがある。無糖鎖型、1糖鎖型、2糖鎖型のブロードな3本のプリオン蛋白質のバンドが、PNGaseで糖鎖を切断することで無糖鎖型の1本のバンドになるため、より正確にプリオン蛋白質の量をサンプル間で比較検討できる。
プリオン持続感染細胞の入手と継代培養
日本や海外でプリオン持続感染細胞を使用している研究室から入手可能である。ただし、後述する安全対策を施す必要がある。また、入手直後に大量に細胞を増殖させて多数のチューブに細胞を凍結保存することを推奨する。プリオン持続感染細胞がプリオン(PrPres)を維持できる世代は無限ではなく、継代数が増えると細胞がPrPresを失う傾向にある。PrPresが何世代で消失するかは培養条件や細胞の種類によるが、細胞を解凍してから約20回以内の継代に留めるのが良い。プリオンが持続感染状態にあるかどうかは、本稿で紹介した方法でPrPresの存在を確認すると良い。また、細胞の形態を観察して異常が起きていないことを確認することも重要である。
脳組織のPrPresの検出
基本的には今回紹介した方法と同じような過程で脳内のPrPresを検出することができる。しかし、組織溶解液の組成は異なり、一般的にPK濃度は高い。培養細胞に比べ、脳組織のPrPresの濃度は高いので、遠心してPrPresを濃縮しなくてもウエスタンブロットで検出が可能である。
実験の安全
動物に由来するプリオンの実験は、農林水産省公表の実験指針に従って、安全対策をとる。スクレイピープリオンはバイオセーフティレベル2に相当するので、本実験を行うには、そのレベルに対応できる実験室を使用し、安全キャビネットの中で実験を行う。プリオンに接触したチップ、チューブ等のプラスチック類は、135℃、30分のオートクレーブ処理を行う。廃液については、SDSの濃度が3%以上になるようにしてから、150℃、30分のオートクレーブ処理を行う。詳細は「動物の伝達性海綿状脳症の実験指針(改正後)」に記載されている。
またSDS-PAGEのためのサンプルの加熱中に、誤ってチューブが開くのを阻止するために、チューブはセーフロックチューブを使用するのが望ましい。
参考文献
- Prusiner, S.B., Proc. Natl. Acad. Sci. USA., 95, 13363-83 (1998)
- Butler, D.A. et al., J. Virol., 62, 1558-64 (1988)
- Race, R.E. et al., J. Virol., 62 2845-9 (1988)
- Caughey, B. & Raymond, G.J., J. Virol., 67 643-50 (1993)
- Kawasaki, Y. et al., J. Virol., 81 12889-98 (2007)
- Hamanaka, T. et al., Biochem. Biophys. Res. Commun., 405, 285-90 (2011)
- Nishizawa, K. et al., J. Virol., 88, 4083-99 (2014)
- Kimura, T. et al., FEBS Lett., 584, 1193-8 (2010)
- Safar, J. et al., Nat. Med., 4, 1157-65 (1998)
- Timmes, A.G. et al., PLoS One, 8, e71081 (2013)
概要
狂牛病の原因として知られているプリオンは、核酸を必要としない特異な感染体である。プリオンの感染性はプリオン蛋白質の立体構造が変化(異常化)することが原因と考えられている。正常型のプリオン蛋白質も異常型のプリオン蛋白質も一次構造が同じためにSDS-PAGEとウエスタンブロット法を用いた通常の蛋白質の検出では、両者を区別することはできない。そこで、異常型プリオン蛋白質のみを検出するために、異常型プリオン蛋白質がProteinase Kの分解に対して部分的に抵抗性を持つことと、その抵抗性蛋白質が易沈殿性であることを利用する。本稿では、プリオンが持続的に感染している神経芽細胞腫細胞由来のProteinase K耐性プリオン蛋白質(PrPres)を検出する一連の手法を紹介する。この手法では培養細胞から蛋白質の抽出後、1日でPrPresを検出することができる。
イントロダクション
プリオンは牛海綿状脳症(Bovine Spongiform Encephalopathy, BSE)に代表されるプリオン病、伝達性(伝染性)海綿状脳症(Transmissible Spongiform Encephalopathy, TSE)を引き起こす(1)。プリオン病はウシの他、ヒト、ヒツジ、マウス、ハムスター、ネコ、シカ、ミンクなどの哺乳類で発症することが知られており、致死性の脳神経疾患である。(1)。代表的なヒトプリオン病のクロイツフェルト・ヤコブ病(Creutzfeldt-Jakob disease: CJD)には3つの病因があり、原因不明の孤発性CJD、プリオン蛋白質をコードする遺伝子に変異があることで発症しやすくなる家族性CJD、プリオンの感染により発症する獲得性CJDに分類される(1)。動物種や病因のタイプに限らず、いずれのプリオン病も原因はプリオン蛋白質のコンフォメーションの変化によるものと考えられている。プリオン蛋白質は神経細胞で常に産生されているが、正常型ではプリオン病を引き起こさず、異常型になることでプリオン病を引き起こす。一次構造が同じプリオン蛋白質の正常型と異常型を見分ける方法として、Proteinase Kの分解に対する抵抗性の違いを利用する方法がある(1)。異常型プリオン蛋白質(つまり、プリオン)はProteinase Kに対して部分的に抵抗性を持つ。そして脳組織からProteinase K耐性のPrPを検出することが、プリオン病の診断基準の1つになっている。一方、マウス神経芽細胞腫Neuro2A (N2a)細胞にプリオンを感染させ、細胞を継代しても持続的にプリオンを維持しているプリオン持続感染細胞が細胞研究で広く使われている(2,3)。例えば、プリオンに対する薬剤のスクリーニングや、プリオン増幅に関与する内在性因子の解析で利用されている(4-8)。動物実験を行うよりも安価で短時間で解析できる点、そして動物愛護の観点において、使用する実験動物数の数を減らせる点で、プリオン持続感染細胞を使用するメリットは大きい。本稿では、このプリオン持続感染細胞のPrPresを検出する一連の手法を紹介する(7,8)。
用語の説明
プリオンがつく単語には「プリオン」、「プリオン蛋白質」、「正常型プリオン蛋白質」、「異常型プリオン蛋白質」、「Proteinase K耐性プリオン蛋白質」と様々あり、混乱を生じやすいので、この欄で紹介する。「プリオン蛋白質」は遺伝子PRNPがコードする蛋白質の名前であり、一般的にPrPと表記される。プリオン蛋白質は、特に脳で強く発現しているが様々な組織の細胞でも発現している。名前にプリオンがつくために誤解されやすいのだが、「プリオン蛋白質」自身は、病原性や感染性を意味するものではない。病原性や感染性をもつ意味で使用される「プリオン」はプリオン蛋白質の立体構造が異常型になって、正常型のプリオン蛋白質を異常型に変換する能力を持つ。ヒツジのプリオン病名、スクレイピー(scrapie)から、動物種に関係なく、プリオンはPrPscと表記され、正常型プリオン蛋白質はPrPc (cellular prion protein)と表記される。一方、プリオン持続感染細胞の異常型プリオン蛋白質はProteinase Kに対して抵抗性を持つことからPrPres (protease-resistant prion protein)と表記される。PrPscもPrPresも「異常型プリオン蛋白質」ではあるが、PrPscは感染性を持つ意味で使われ、PrPresはProteinase K耐性を持つ意味で使われており、PrPresは必ずしも感染性を意味するわけではない。Proteinase Kに感受性がありながら感染性を示すプリオンが存在するという報告や、in vitroで増幅した異常型蛋白質はProteinase K耐性だが、必ずしも感染性を持たないという報告がある(9,10)。
実験の原理
プリオン持続感染細胞の細胞内にあるPrPは全てがPrPresということではなく、PrPcも含まれる。この両者は一次構造が同じために、SDS-PAGEで区別することはできない。そこで、PrPresのみを検出するためには、SDS-PAGEを行う前に全PrPに含まれるPrPcを取り除かなければならない。そのために、本実験では検体のProteinase K (PK) 処理と遠心分離を行う。PrPresはPK処理によってN末端が切断されるが、おおよそ90アミノ酸残基以降のC末端は部分的にPK抵抗性を持つために、N末端を欠いたPrPが残る。このN末端欠損型PrPは特定の界面活性剤存在中の試験管内で(アミロイドを形成しているかは不明であるが、)容易に沈殿する性質を持つようになる。従って、超遠心機を用いなくてもN末端欠損型PrPは遠心分離で沈殿し、(PK処理はPrPcが完全に消化される条件ではあるが、)PrPcがPK処理で完全に切断しきれなかったとしてもPrPcは上清画分に分離されて取り除かれる。そして、沈殿画分をSDS-PAGEとウエスタンブロットを行うことで、PrPresを検出することができる。以上のことから、本実験のPK処理はアミロイドにみられるPK耐性の蛋白質を検出するという単純なものではない。本実験のPK処理はPrPcを分解させるだけではなく、PrPresの沈殿性を高めるための処理でもあるという点で、他のアミロイド蛋白質の検出とは異なる。
装置・器具・試薬
- CO2インキュベーター
- 安全キャビネット
- アスピレーター
- 細胞培養用(6 well) plate
- 冷却遠心機(最大遠心力20,000 x g)
- SDS-PAGEを行うにあたり必要な機器(電気泳動槽、泳動プレート、パワーサプライ)
- セミドライトランスファー装置
- イメージング装置、あるいはX線フィルムと現像機
- PVDF膜
- 3MM紙
- セーフロックチューブ
- PBS(-)
- 細胞溶解液(PBS(-), 0.5% NP40, 0.5% デオキシコール酸ナトリウム)
- 1 mg/mL Proteinase K
- 0.1 M フッ化フェニルメチルスルホニル(PMSF)
- SDS-PAGE用サンプルバッファー(25 mM Tris-HCl pH6.8, 1% SDS, 0.05% ブロモフェノールブルー, 4% グリセロール, 140 mM 2-メルカプトエタノール)
- SDS-PAGE用泳動バッファー(25 mM Tris, 192 mM glycine, 0.1% SDS)
- トランスファーバッファー(陽極液1 300 mM Tris, 20% メタノール; 陽極液2 25 mM Tris, 20% メタノール; 陰極液 25 mM Tris, 40 mM 6-アミノカプロン酸, 20% メタノール)
- TTBS(25 mM Tris-HCl pH7.6, 0.5 M NaCl, 0.05% Tween-20)
- ブロッキングバッファー(5% スキムミルク in TTBS)
- 抗体(一次抗体anti-PrP antibody、二次抗体)
- ウエスタンブロット用検出試薬
実験の手順
- 細胞から細胞溶解液作製
- Proteinase K処理と遠心分離
- SDS-PAGEとウエスタンブロット
実験の詳細
1. 細胞から細胞溶解液作製
6 wellプレートでプリオン持続感染細胞をコンフルエントの状態まで培養する。安全キャビネット内で培養液をアスピレーターで取り除く。冷PBSをプレートの縁から1 mL加え、軽く撹拌、アスピレーターでPBSを取り除く。 冷抽出バッファーを500 μL加え、細胞全体に行き渡るように軽く撹拌して細胞を溶解させる。1分後、1.5 mLチューブに細胞溶解液を回収する。3,000 x g、10分、4℃で遠心する。沈渣を取らないように上清を1.5 mLチューブに回収する。
2. Proteinase K (PK)処理
回収した細胞溶解液200 μlをセーフロックチューブに用意して1 mg/mLのProteinase Kを100倍希釈して終濃度10 μg/mLになるように加え、37℃、30分で蛋白質分解反応を行う。チューブを氷上で冷却し、その後0.1 M PMSFを2 μL加えて蛋白質分解反応を止める。その後、チューブを混和装置にセットして室温で5分間、溶液を混和する。そして20,000 x g、20分、4℃で遠心後、上清を取り除く。SDS-PAGE用サンプルバッファーを20 μL添加して激しく撹拌する。5分間煮沸して蛋白質を変性させる。
3. SDS-PAGEとウエスタンブロット
15% ポリアクリルアミドゲルを作製(または、プレキャストゲルを使用)し、10 μLのサンプルを注入して通常のSDS-PAGEを行う。
電気泳動後、セミドライトランスファー装置を用いてPVDF膜に転写する。予め、PVDF膜をメタノールに染み込ませ、その後、10分以上精製水で浸透して、水に馴染ませる。また、3MM紙2枚を陽極液1に、1枚を陽極液2に、3枚を陰極液に浸す。(下面が陽極のセミドライトランスファー装置では)陽極液1を浸した3MM紙2枚をトランスファー装置の上に置く。その上に陽極液2を浸した3MM紙1枚を置く。さらに、精製水で平衡状態にさせたPVDF膜を置く。そして、SDS-PAGEを行ったゲルを置く。最後に、陰極液を浸した3MM紙3枚を重ねる。3MM紙やPVDF膜、ゲルを重ねる際には、気泡が入らないように注意する。装置の準備が完了後、2mA/cm2の定電流で40分から60分、転写を行う。
蛋白質を転写したPVDF膜は、ブロッキングバッファー中で1時間のブロッキングを行う。TTBSで3回洗浄したあと、1次抗体anti-PrP antibodyを1時間反応させる。そして、TTBSで3回洗浄し、2次抗体を1時間反応させる。その後、TTBSで3回洗浄し、検出試薬を用いてPrPresのシグナルを検出する(図1A)。PrPは糖鎖結合部位が2箇所あるため、無糖鎖型PrP、一糖鎖型PrP、ブロードな二糖鎖型PrPの3本のバンドが検出される。無糖鎖型PrPは20 kDaより少し小さく、一糖鎖型は22 kDa、二糖鎖型は28 kDa付近にバンドが検出される。PK処理をするとPrPのN末端側は分解を受けてPK耐性のC末端が残るために、PK未処理のPrP全長に比べ小さい分子量になる(図1A,B)。
工夫とコツ
細胞培養
当研究室ではOPTI-MEMに10% FBSを加えた溶液(6 well plateの場合3mL)を培養液として使用している。プリオン持続感染細胞の倍加時間は、細胞株の種類によって異なるが、おおよそ24時間である。細胞を3日間培養して蛋白質を回収する場合は、コンフルエントの細胞を8-10倍に希釈して約2 x 105 cells/wellを播いて培養する。3日後にはコンフルエントの状態に達し、約2 x 106 個の細胞が得られる。
細胞溶解液
PK処理を行うため、PKを阻害するようなセリンプロテアーゼインヒビターを加えてはならない。
蛋白質の定量
蛋白質の定量を行う場合は、細胞溶解液に界面活性剤が入っているためにBradford法は使用できない。当研究室ではLowry法を採用している。本条件では、1ウェル当たりコンフルエント状態の細胞からおよそ1 mgの総蛋白質量が得られる。後のSDS-PAGEでは、1レーンあたり200 μgの総蛋白質を使用してPK処理した量相当を添加すれば、PrPresの検出が可能である。
PrPresの遠心分離
組織からPrPresを検出する目的で組織溶解液に陰イオン性界面活性剤のサルコシルを使用するプロトコールがあるが、細胞溶解液にサルコシルを使用すると高分子の核酸がゲル状となり、PK処理を行った後のPrPresの分離が困難となる。本実験では、陰イオン性界面活性剤にデオキシコール酸ナトリウムを使用している。この界面活性剤を使用することで、高分子の核酸は糸くず状のまま除くことができる。また、PK処理後のPrPが容易に沈殿しやすくなり、一般的な遠心機で可能な20,000 x gの遠心力でPrPresを沈殿させることができる。
実験の詳細2では、遠心後の沈殿物が見えないので、上清を取り除く際に誤って沈殿物も取り除いてしまう可能性がある。そこで、遠心前の溶液に100倍希釈したglass milkを5 μL加えてから遠心することで、沈殿物を見やすくすることができる。
SDS-PAGE用サンプルバッファー
プリオン株によっては還元剤の2-メルカプトエタノールを加えないほうが検出しやすいことがあるので、PrPresの検出が弱い場合には、2-メルカプトエタノールのないサンプルバッファーを試してみるのも良い。
PVDF膜への転写
ポリアクリルアミドゲルの厚さによって転写時間を調節する。当研究室では、厚さが1.0 mmの場合は40分、1.5 mmの場合は60分で行っている。
ウエスタンブロット
当研究室では一次抗体にanti-PrP monoclonal antibody SAF83 (SPI-Bio社)を5,000倍希釈で使用している。また、二次抗体はAnti-Mouse IgG (H+L), AP Conjugate(Promega社)を20,000倍希釈で使用している。検出はCDP-Star detection reagent (GE Healthcare社)を使用し、イメージアナライザー又はX線フィルムで検出を行っている。
全PrPと内因性コントロールの定量
PrPresの定量を行う際には全PrPとインターナルコントロールを検出して、全PrPの増減変化の確認とサンプル間の標準化を行うと良い。プリオン持続感染細胞の全PrPに含まれるPrPresの割合は100%ではなく、感染細胞の種類によるが、5-50%程度であるので、全PrPを検出するためには、PrPresの検出で使用した細胞溶解液より少なくて良い。実験の詳細1で得られた細胞抽出液40 μLに、5xサンプルバッファーを10 μL加え、5分間煮沸して蛋白質を変性させる。その後は、実験の詳細3と同様に全PrPを検出する(図1B)。検出したメンブレンをストリッピングバッファー(2 M glycine, pH2.8[HClで調整])に浸して、室温、30分の処理で抗体をはがす。新たにインターナルコントロール用の抗体を反応させて、検出を行う。当研究室では一次抗体にAnti-β-Actin monoclonal antibody (SIGMA社)を10,000倍希釈で使用している。
PrPの糖鎖除去
プリオン蛋白質をアスパラギン型糖鎖を切断する酵素、ペプチド:N-グリカナーゼ(PNGase)で消化することがある。無糖鎖型、1糖鎖型、2糖鎖型のブロードな3本のプリオン蛋白質のバンドが、PNGaseで糖鎖を切断することで無糖鎖型の1本のバンドになるため、より正確にプリオン蛋白質の量をサンプル間で比較検討できる。
プリオン持続感染細胞の入手と継代培養
日本や海外でプリオン持続感染細胞を使用している研究室から入手可能である。ただし、後述する安全対策を施す必要がある。また、入手直後に大量に細胞を増殖させて多数のチューブに細胞を凍結保存することを推奨する。プリオン持続感染細胞がプリオン(PrPres)を維持できる世代は無限ではなく、継代数が増えると細胞がPrPresを失う傾向にある。PrPresが何世代で消失するかは培養条件や細胞の種類によるが、細胞を解凍してから約20回以内の継代に留めるのが良い。プリオンが持続感染状態にあるかどうかは、本稿で紹介した方法でPrPresの存在を確認すると良い。また、細胞の形態を観察して異常が起きていないことを確認することも重要である。
脳組織のPrPresの検出
基本的には今回紹介した方法と同じような過程で脳内のPrPresを検出することができる。しかし、組織溶解液の組成は異なり、一般的にPK濃度は高い。培養細胞に比べ、脳組織のPrPresの濃度は高いので、遠心してPrPresを濃縮しなくてもウエスタンブロットで検出が可能である。
実験の安全
動物に由来するプリオンの実験は、農林水産省公表の実験指針に従って、安全対策をとる。スクレイピープリオンはバイオセーフティレベル2に相当するので、本実験を行うには、そのレベルに対応できる実験室を使用し、安全キャビネットの中で実験を行う。プリオンに接触したチップ、チューブ等のプラスチック類は、135℃、30分のオートクレーブ処理を行う。廃液については、SDSの濃度が3%以上になるようにしてから、150℃、30分のオートクレーブ処理を行う。詳細は「動物の伝達性海綿状脳症の実験指針(改正後)」に記載されている。
またSDS-PAGEのためのサンプルの加熱中に、誤ってチューブが開くのを阻止するために、チューブはセーフロックチューブを使用するのが望ましい。
参考文献
- Prusiner, S.B., Proc. Natl. Acad. Sci. USA., 95, 13363-83 (1998)
- Butler, D.A. et al., J. Virol., 62, 1558-64 (1988)
- Race, R.E. et al., J. Virol., 62 2845-9 (1988)
- Caughey, B. & Raymond, G.J., J. Virol., 67 643-50 (1993)
- Kawasaki, Y. et al., J. Virol., 81 12889-98 (2007)
- Hamanaka, T. et al., Biochem. Biophys. Res. Commun., 405, 285-90 (2011)
- Nishizawa, K. et al., J. Virol., 88, 4083-99 (2014)
- Kimura, T. et al., FEBS Lett., 584, 1193-8 (2010)
- Safar, J. et al., Nat. Med., 4, 1157-65 (1998)
- Timmes, A.G. et al., PLoS One, 8, e71081 (2013)