概要
タンパク質の生化学や生物物理学の研究は、水溶液中によく分散した透明なものを対象に調べることが多い。しかし最近では、液–液相分離や凝集によって白濁した状態のタンパク質に興味が持たれることが増えてきた。本稿では、ありふれたタンパク質を用いて、可逆性の高い液–液相分離した状態と不可逆に凝集した状態とを作り分ける簡単な方法を紹介する。オボアルブミンを部分的に変性させておき、リゾチームと混合するとすみやかに白濁する。この溶液は塩を加えると溶解するため、いわゆる液–液相分離して形成されたドロプレットの一種だと判断できる。しかし、時間を置くだけで塩では溶けなくなるので、時間とともに構造変化し、疎水性相互作用を主な駆動力とする凝集体に変化したと考えられる。この実験の手順と結果を知ることで、2種類以上のタンパク質が入った溶液の扱い方と性質の理解に役立つだろう。
イントロダクション
水溶性タンパク質を緩衝液に加えると、ふつう透明の溶液になる。これはタンパク質の分子間に静電的な反発力が働くため、溶液中に分散した状態を保てるからである。タンパク質の生化学や生物物理学の研究のためには、このような分散したタンパク質の状態を取り扱うことが多い。しかし最近では、タンパク質の集合状態と機能との関連を問う相分離生物学が登場し、複数のタンパク質や RNA が含まれた溶液を研究対象にする機会が増えている。複数種類のタンパク質が含まれた水溶液は白濁することが多い。溶液の pH によっては正電荷と負電荷を帯びるタンパク質があるため、それらが静電相互作用によって引き合うためである (1)。これを踏まえると、生体分子で夾雑した溶液中でタンパク質はむしろ分散した状態を保つ方が難しいだろうと想像できる。
本稿では、卵白にふくまれるタンパク質を対象に、2種類のタンパク質の溶液中での振る舞いを視覚的に観察する方法を紹介する。卵白リゾチームとオボアルブミンは中性の水溶液中でそれぞれ正電荷と負電荷を持っている。そのため、水にリゾチームとオボアルブミンを溶かすとそれだけで白濁する。白濁した直後に塩化ナトリウムを加えると透明になる。すなわち水溶液中にあるイオンによってタンパク質分子間に遮蔽効果が生じて分散するためである。ここで、次のような実験を試みてみる。オボアルブミンを熱でアンフォールドさせた「加熱オボアルブミン」を準備する。この加熱オボアルブミンに卵白リゾチームを混合し、しばらく時間を置いておくと、塩化ナトリウムを加えても透明にならないのである (2)。これは、卵白リゾチームと加熱オボアルブミンが静電相互作用によって引き合い、白濁して見えるサイズになったあと、しばらく時間を置くあいだに立体構造が変化し、疎水性相互作用が生じるためである。疎水性相互作用によって集まった状態、すなわち凝集体は、イオンによる静電遮蔽効果では相互作用を消失させることができない。本稿では、2種類のタンパク質によって白濁した集合物をコンデンセート(condensate)と呼ぶ。2種類のタンパク質がコンデンセートを形成する場合、安定化する因子によってイオンによる溶解性などの性質が異なるため (3)、本原稿では別の呼び名を用いる。疎水性相互作用を主な相互作用として形成されたコンデンセートを共凝集体(co-aggregate)と呼び、静電相互作用を主な相互作用として形成されたコンデンセートを相分離液滴(liquid droplet)と呼ぶ。
装置・器具・試薬
オボアルブミン(Grade VI)と卵白リゾチーム(結晶化物)はシグマ アルドリッチ社から購入した。塩化ナトリウムやアルギニンなどの試薬は和光純薬工業株式会社から購入した。
オボアルブミン溶液および卵白リゾチーム溶液のストック液は次のように作成した。それぞれタンパク質を水に溶解し、最終、タンパク質濃度が 100 μM、溶液の pH が7.0になるよう水酸化ナトリウムで pH 調整した。なお、ストック液は 10 mL 程度作成しておくといろいろな実験に供することができる。
実験の詳細
オボアルブミン溶液を加熱することで、オボアルブミンの立体構造の一部を不可逆にアンフォールドさせる処理を行う。この加熱オボアルブミン溶液は、次のように作成した。オボアルブミン溶液の一部を取り、80℃で30分間処理したあと4℃に冷却し、その後、25℃で保存した。なお、加熱したオボアルブミンは、加熱していないオボアルブミンと比較し、遠紫外の円偏光二色性の θ 値が2割ほど減少することから、二次構造が部分的に壊れていることがわかる (2)。なお、加熱オボアルブミン溶液はきわめて透明な状態である。オボアルブミンは中性の水溶液中では負電荷を持っているため、静電相互作用による反発によって分散できるのだと考えられる。
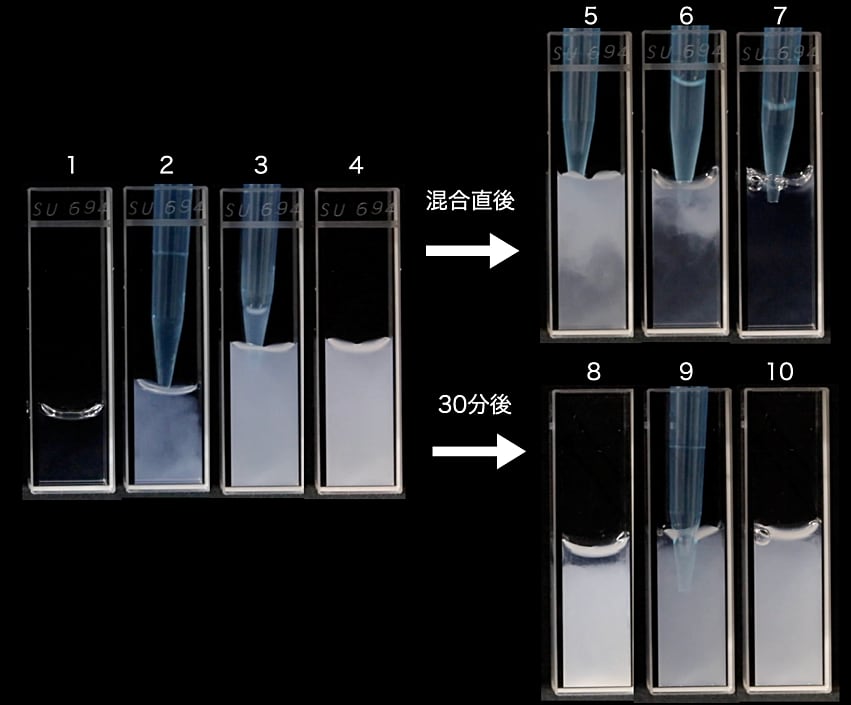
この加熱オボアルブミン溶液と、卵白リゾチーム溶液を用いて次の実験を行った。0.5 mL の加熱オボアルブミン溶液を 1 cm セルに入れた(図1の1)。ここに 0.5 mL の卵白リゾチーム溶液を加えると(図1の2・3)、白濁する様子が見られた(図1の4)。その直後に、最終 150 mM になるよう塩化ナトリウム溶液を加えると、溶液がすみやかに透明になった(図1の5・6・7)。150 mM の塩化ナトリウムが含まれた溶液中の溶質の間には静電遮蔽効果が働き、静電相互作用が弱められた結果、白濁の原因となったコンデンセートが溶解したのだろう。すなわち、このコンデンセートは静電相互作用を主な安定化の駆動力とする可逆性の高い相分離液滴だと考えられる。
ここで、加熱オボアルブミン溶液と卵白リゾチーム溶液を混合するところまでは同じ手順で進めたのち(図1の4)、25℃の室温に30分間置いた(図1の8)。下面には白濁したものが、上面には透明な層になっているのがわかる。この溶液に、さきほどと同様に最終 150 mM の濃度の塩化ナトリウムになるよう 500 mM の塩化ナトリウム溶液を加えてピペッティングしながら混合しても、溶液は透明にならなかった(図1の9・10)。すなわち、30分間の時間を置くだけで、コンデンセートの性質が変化したのだと考えられる。イオン強度を増加させても状態が変化しなかったので、はじめにオボアルブミンとリゾチームが静電相互作用で引き合っていたにもかかわらず、時間とともに分子間に疎水性相互作用ができていったのだと考えられる。共凝集体と相分離液滴は肉眼ではいずれも白濁して見えるが、顕微鏡で観察すると形状が異なる (3)。共凝集体は不定形をしているが、相分離液滴は球形をしており時間とともに融合する様子が観察できる。
なお、加熱処理をしないオボアルブミンを卵白リゾチームと混合しても、同様に白濁が見られる。しかし、この試料は時間を置いても状態は変化せず、塩を加えると透明の溶液になる。つまり、オボアルブミンを加熱によって部分的にアンフォールドさせることが、時間とともに塩への応答性の異なる状態変化を生じるために不可欠であると考えられる。加熱したときのオボアルブミンは、8-アニリノ-1-ナフタレンスルホン酸(ANS)を加えたときの蛍光強度が大幅に増加するため (2)、オボアルブミンを部分的にアンフォールドさせて疎水性領域を露出させることが、時間とともに状態変化するために重要であると考えられる。
このような簡単な実験からもわかるとおり、2種類のタンパク質は混ぜるだけで白濁する。そのため、あるタンパク質を組み合わせて相分離液滴ができたからといって、そこに細胞内での生理学的な意味づけをするのは安易であり、注意が必要となる。さらにこの実験からも想像できるとおり、タンパク質の相分離液滴は刻々と状態変化するものであり、デキストランとポリエチレングリコールによる水性二相溶液や、ポリアリルアミンとポリアクリル酸などの高分子電解質複合体などの、いわゆる古典的な液–液相分離とは性質が異なっている。タンパク質は立体構造が変化するため、相分離液滴を形成する条件が変化し、不溶性の状態に相分離液滴そのものも変化するからである。
本プロトコルではオボアルブミンと卵白リゾチームを参考に、2種類のタンパク質を混合したときの共凝集と相分離について紹介した (2)。同様に2種類のタンパク質を混合した例としては、繰り返し配列を持つ天然変性タンパク質や (6)、ポリアミノ酸とモノクローナル抗体 (7) など多様な例が報告されており、生命現象の理解やタンパク質の安定化技術などに利用されている。
工夫とコツ
2種類のタンパク質を混ぜて白濁させたあと、再溶解させるとき、添加剤の種類を変えてみると相互作用の理解が深まる。今回は塩を使うことによって識別したが、他にも多様な添加剤がある。次の総説が参考になる (3, 4)。
- 塩:白濁したタンパク質溶液に 150 mM 程度になるよう塩化ナトリウムを加えたとき、透明の溶液になれば静電相互作用を駆動力としてタンパク質が集まっていると考えてよい。
- 尿素や塩酸グアニジン:数百 mM の塩化ナトリウムを加えても白濁したままだが、1 M や 2 M の尿素で溶解した場合には、疎水性相互作用を駆動力としてタンパク質が集まっていると考えてよい。尿素は 1–2 M ではタンパク質の構造を壊さず、疎水性分子をよく溶かす機能があるからである。一方、タンパク質変性剤の塩酸グアニジンはイオンであるため、疎水性相互作用と静電相互作用の両方を弱める働きがある。
- アルギニン:500 mM 程度のアルギニンを加えたとき、白濁したタンパク質溶液が透明になれば、芳香族アミノ酸や核酸塩基などの芳香族化合物同士の相互作用や、リシンなどの正電荷と芳香族とのカチオン–π 相互作用が主な駆動力としてコンデンセートが安定化されていると考えてよい。カチオン–π 相互作用は主に相分離液滴を安定化する因子として知られている。
- ヘキサンジオール:ヘキサンジオールは弱い疎水性相互作用を弱めるはたらきがあるとされている。一般に、白濁したタンパク質溶液に5%程度になるよう1,6-ヘキサンジオールを加えて透明になった場合、液–液相分離して形成された相分離液滴だと考えてよい。ただし、染色体はヘキサンジオールによって凝縮するという報告があり (5)、核酸が多く含まれたコンデンセートの場合にはヘキサンジオールによって溶けるのではなく凝縮してしまう働きがある可能性がある。これは今後の研究の論点としても興味深い。
文献
- Oki, S. et al., Int. J. Biol. Macromol., 107, 1428–1437 (2018)
- Iwashita K. et al., Int. J. Biol. Macromol., 120, 10–18 (2018)
- Iwashita K. et al., Curr. Pharm. Biotechnol., 19, 946–955 (2018)
- Shiraki K. et al., Biophys. Rev., 12, 587–592 (2020)
- Itoh Y. et al., Life Sci. Alliance., 4, e202001005 (2021)
- Li P. et al., Nature, 483, 336‒340 (2012)
- Izaki S. et al., J. Pharm. Sci., 104, 1929–1937 (2015)
概要
タンパク質の生化学や生物物理学の研究は、水溶液中によく分散した透明なものを対象に調べることが多い。しかし最近では、液–液相分離や凝集によって白濁した状態のタンパク質に興味が持たれることが増えてきた。本稿では、ありふれたタンパク質を用いて、可逆性の高い液–液相分離した状態と不可逆に凝集した状態とを作り分ける簡単な方法を紹介する。オボアルブミンを部分的に変性させておき、リゾチームと混合するとすみやかに白濁する。この溶液は塩を加えると溶解するため、いわゆる液–液相分離して形成されたドロプレットの一種だと判断できる。しかし、時間を置くだけで塩では溶けなくなるので、時間とともに構造変化し、疎水性相互作用を主な駆動力とする凝集体に変化したと考えられる。この実験の手順と結果を知ることで、2種類以上のタンパク質が入った溶液の扱い方と性質の理解に役立つだろう。
イントロダクション
水溶性タンパク質を緩衝液に加えると、ふつう透明の溶液になる。これはタンパク質の分子間に静電的な反発力が働くため、溶液中に分散した状態を保てるからである。タンパク質の生化学や生物物理学の研究のためには、このような分散したタンパク質の状態を取り扱うことが多い。しかし最近では、タンパク質の集合状態と機能との関連を問う相分離生物学が登場し、複数のタンパク質や RNA が含まれた溶液を研究対象にする機会が増えている。複数種類のタンパク質が含まれた水溶液は白濁することが多い。溶液の pH によっては正電荷と負電荷を帯びるタンパク質があるため、それらが静電相互作用によって引き合うためである (1)。これを踏まえると、生体分子で夾雑した溶液中でタンパク質はむしろ分散した状態を保つ方が難しいだろうと想像できる。
本稿では、卵白にふくまれるタンパク質を対象に、2種類のタンパク質の溶液中での振る舞いを視覚的に観察する方法を紹介する。卵白リゾチームとオボアルブミンは中性の水溶液中でそれぞれ正電荷と負電荷を持っている。そのため、水にリゾチームとオボアルブミンを溶かすとそれだけで白濁する。白濁した直後に塩化ナトリウムを加えると透明になる。すなわち水溶液中にあるイオンによってタンパク質分子間に遮蔽効果が生じて分散するためである。ここで、次のような実験を試みてみる。オボアルブミンを熱でアンフォールドさせた「加熱オボアルブミン」を準備する。この加熱オボアルブミンに卵白リゾチームを混合し、しばらく時間を置いておくと、塩化ナトリウムを加えても透明にならないのである (2)。これは、卵白リゾチームと加熱オボアルブミンが静電相互作用によって引き合い、白濁して見えるサイズになったあと、しばらく時間を置くあいだに立体構造が変化し、疎水性相互作用が生じるためである。疎水性相互作用によって集まった状態、すなわち凝集体は、イオンによる静電遮蔽効果では相互作用を消失させることができない。本稿では、2種類のタンパク質によって白濁した集合物をコンデンセート(condensate)と呼ぶ。2種類のタンパク質がコンデンセートを形成する場合、安定化する因子によってイオンによる溶解性などの性質が異なるため (3)、本原稿では別の呼び名を用いる。疎水性相互作用を主な相互作用として形成されたコンデンセートを共凝集体(co-aggregate)と呼び、静電相互作用を主な相互作用として形成されたコンデンセートを相分離液滴(liquid droplet)と呼ぶ。
装置・器具・試薬
オボアルブミン(Grade VI)と卵白リゾチーム(結晶化物)はシグマ アルドリッチ社から購入した。塩化ナトリウムやアルギニンなどの試薬は和光純薬工業株式会社から購入した。
オボアルブミン溶液および卵白リゾチーム溶液のストック液は次のように作成した。それぞれタンパク質を水に溶解し、最終、タンパク質濃度が 100 μM、溶液の pH が7.0になるよう水酸化ナトリウムで pH 調整した。なお、ストック液は 10 mL 程度作成しておくといろいろな実験に供することができる。
実験の詳細
オボアルブミン溶液を加熱することで、オボアルブミンの立体構造の一部を不可逆にアンフォールドさせる処理を行う。この加熱オボアルブミン溶液は、次のように作成した。オボアルブミン溶液の一部を取り、80℃で30分間処理したあと4℃に冷却し、その後、25℃で保存した。なお、加熱したオボアルブミンは、加熱していないオボアルブミンと比較し、遠紫外の円偏光二色性の θ 値が2割ほど減少することから、二次構造が部分的に壊れていることがわかる (2)。なお、加熱オボアルブミン溶液はきわめて透明な状態である。オボアルブミンは中性の水溶液中では負電荷を持っているため、静電相互作用による反発によって分散できるのだと考えられる。
この加熱オボアルブミン溶液と、卵白リゾチーム溶液を用いて次の実験を行った。0.5 mL の加熱オボアルブミン溶液を 1 cm セルに入れた(図1の1)。ここに 0.5 mL の卵白リゾチーム溶液を加えると(図1の2・3)、白濁する様子が見られた(図1の4)。その直後に、最終 150 mM になるよう塩化ナトリウム溶液を加えると、溶液がすみやかに透明になった(図1の5・6・7)。150 mM の塩化ナトリウムが含まれた溶液中の溶質の間には静電遮蔽効果が働き、静電相互作用が弱められた結果、白濁の原因となったコンデンセートが溶解したのだろう。すなわち、このコンデンセートは静電相互作用を主な安定化の駆動力とする可逆性の高い相分離液滴だと考えられる。
ここで、加熱オボアルブミン溶液と卵白リゾチーム溶液を混合するところまでは同じ手順で進めたのち(図1の4)、25℃の室温に30分間置いた(図1の8)。下面には白濁したものが、上面には透明な層になっているのがわかる。この溶液に、さきほどと同様に最終 150 mM の濃度の塩化ナトリウムになるよう 500 mM の塩化ナトリウム溶液を加えてピペッティングしながら混合しても、溶液は透明にならなかった(図1の9・10)。すなわち、30分間の時間を置くだけで、コンデンセートの性質が変化したのだと考えられる。イオン強度を増加させても状態が変化しなかったので、はじめにオボアルブミンとリゾチームが静電相互作用で引き合っていたにもかかわらず、時間とともに分子間に疎水性相互作用ができていったのだと考えられる。共凝集体と相分離液滴は肉眼ではいずれも白濁して見えるが、顕微鏡で観察すると形状が異なる (3)。共凝集体は不定形をしているが、相分離液滴は球形をしており時間とともに融合する様子が観察できる。
なお、加熱処理をしないオボアルブミンを卵白リゾチームと混合しても、同様に白濁が見られる。しかし、この試料は時間を置いても状態は変化せず、塩を加えると透明の溶液になる。つまり、オボアルブミンを加熱によって部分的にアンフォールドさせることが、時間とともに塩への応答性の異なる状態変化を生じるために不可欠であると考えられる。加熱したときのオボアルブミンは、8-アニリノ-1-ナフタレンスルホン酸(ANS)を加えたときの蛍光強度が大幅に増加するため (2)、オボアルブミンを部分的にアンフォールドさせて疎水性領域を露出させることが、時間とともに状態変化するために重要であると考えられる。
このような簡単な実験からもわかるとおり、2種類のタンパク質は混ぜるだけで白濁する。そのため、あるタンパク質を組み合わせて相分離液滴ができたからといって、そこに細胞内での生理学的な意味づけをするのは安易であり、注意が必要となる。さらにこの実験からも想像できるとおり、タンパク質の相分離液滴は刻々と状態変化するものであり、デキストランとポリエチレングリコールによる水性二相溶液や、ポリアリルアミンとポリアクリル酸などの高分子電解質複合体などの、いわゆる古典的な液–液相分離とは性質が異なっている。タンパク質は立体構造が変化するため、相分離液滴を形成する条件が変化し、不溶性の状態に相分離液滴そのものも変化するからである。
本プロトコルではオボアルブミンと卵白リゾチームを参考に、2種類のタンパク質を混合したときの共凝集と相分離について紹介した (2)。同様に2種類のタンパク質を混合した例としては、繰り返し配列を持つ天然変性タンパク質や (6)、ポリアミノ酸とモノクローナル抗体 (7) など多様な例が報告されており、生命現象の理解やタンパク質の安定化技術などに利用されている。
工夫とコツ
2種類のタンパク質を混ぜて白濁させたあと、再溶解させるとき、添加剤の種類を変えてみると相互作用の理解が深まる。今回は塩を使うことによって識別したが、他にも多様な添加剤がある。次の総説が参考になる (3, 4)。
- 塩:白濁したタンパク質溶液に 150 mM 程度になるよう塩化ナトリウムを加えたとき、透明の溶液になれば静電相互作用を駆動力としてタンパク質が集まっていると考えてよい。
- 尿素や塩酸グアニジン:数百 mM の塩化ナトリウムを加えても白濁したままだが、1 M や 2 M の尿素で溶解した場合には、疎水性相互作用を駆動力としてタンパク質が集まっていると考えてよい。尿素は 1–2 M ではタンパク質の構造を壊さず、疎水性分子をよく溶かす機能があるからである。一方、タンパク質変性剤の塩酸グアニジンはイオンであるため、疎水性相互作用と静電相互作用の両方を弱める働きがある。
- アルギニン:500 mM 程度のアルギニンを加えたとき、白濁したタンパク質溶液が透明になれば、芳香族アミノ酸や核酸塩基などの芳香族化合物同士の相互作用や、リシンなどの正電荷と芳香族とのカチオン–π 相互作用が主な駆動力としてコンデンセートが安定化されていると考えてよい。カチオン–π 相互作用は主に相分離液滴を安定化する因子として知られている。
- ヘキサンジオール:ヘキサンジオールは弱い疎水性相互作用を弱めるはたらきがあるとされている。一般に、白濁したタンパク質溶液に5%程度になるよう1,6-ヘキサンジオールを加えて透明になった場合、液–液相分離して形成された相分離液滴だと考えてよい。ただし、染色体はヘキサンジオールによって凝縮するという報告があり (5)、核酸が多く含まれたコンデンセートの場合にはヘキサンジオールによって溶けるのではなく凝縮してしまう働きがある可能性がある。これは今後の研究の論点としても興味深い。
文献
- Oki, S. et al., Int. J. Biol. Macromol., 107, 1428–1437 (2018)
- Iwashita K. et al., Int. J. Biol. Macromol., 120, 10–18 (2018)
- Iwashita K. et al., Curr. Pharm. Biotechnol., 19, 946–955 (2018)
- Shiraki K. et al., Biophys. Rev., 12, 587–592 (2020)
- Itoh Y. et al., Life Sci. Alliance., 4, e202001005 (2021)
- Li P. et al., Nature, 483, 336‒340 (2012)
- Izaki S. et al., J. Pharm. Sci., 104, 1929–1937 (2015)