概要
アミロイド線維の検出にはアミロイド特異的蛍光色素であるチオフラビン T を用いるのが一般的である。本稿では、アミロイド線維形成反応の経時変化をチオフラビン T を用いて追跡する際の手順や注意点について述べる。
イントロダクション
蛋白質は天然構造を取ることで機能を発揮する。高温で熱したり、酸を加えたりすると、蛋白質は変性し、しばしば凝集体を形成する。蛋白質凝集と一口に言ってもその形態や構造は様々である。アミロイド線維は蛋白質が作る針状の凝集体で、β ストランドが線維軸に垂直に並んだクロス β 構造と呼ばれる構造からなる1次元結晶様の凝集体である(文献1–3)。アミロイド線維が関わる病気を総称してアミロイドーシスと呼び、アルツハイマー病やパーキンソン病など多くの疾患が報告されている。さらに、正常な細胞や組織で機能する機能性アミロイドの存在や、アミロイド線維の剛直性などを利用した産業応用などが試みられていることから、アミロイド線維構造や形成機構を理解することの重要性が増している。
アミロイド線維を形成する蛋白質やペプチドのアミノ酸配列には共通性はなく、様々な配列が皆同じようにクロスβ構造をもったアミロイド線維を形成する。このようなことからもアミロイド線維形成は単なる異常凝集ではなく、蛋白質の持つ一般的な性質だと言える。アミロイド線維形成反応は結晶化によく似ており、鋳型となる核形成とそれに続く伸長反応からなる。蛋白質は固有の溶解度が存在し、溶解度を超えた分だけ析出(凝集)することが著者らの近年の研究から示唆されている。アミロイド線維の核形成は非常に高いエネルギー障壁があるため、溶解度を超えていてもすぐには凝集せず、過飽和状態となる。蛋白質濃度や塩などの溶質濃度が高くなり過飽和度が大きくなるほど核形成頻度は高まり、アミロイド線維が形成しやすくなるが、あまりにも高濃度で核形成頻度の高い条件では、秩序構造ができず不定形凝集になる。詳細は文献4–6を参考にしていただきたいが、このようにアミロイド線維形成とオリゴマーを含む不定形凝集(さらには、近年話題となっている液–液相分離現象も)とは隣り合わせの現象であり、それらをきちんと区別して検出し、包括的な理解をすることが重要である。
アミロイド線維を実験的に検出する手法は数多くあり、コンゴーレッド染色による特徴的な複屈折光を示したり、円二色性スペクトルや赤外分光で特徴的なスペクトルを示したり、X 線線維回折でクロス β 構造に特徴的な回折パターンを示すことなどが挙げられる。その中でもアミロイド線維特異的に結合し蛍光を発するチオフラビン T(ThT)はアミロイド線維の研究においてはゴールドスタンダードとして用いられている(文献7, 8)。ThT はアミロイド線維存在下で 445 nm 付近の光を吸収し 485 nm 付近に非常に大きな蛍光を発する。分子機構は文献9, 10等を参考にしていただきここでは割愛する。得られる ThT 蛍光強度は蛋白質の種類や溶液条件に依存し、アミロイド線維の絶対量を示すものではないため、本プロトコルを参考に条件に適した測定をおこなう必要がある(「工夫とコツ」参照)。本稿では、透析アミロイドーシスの原因蛋白質である β2-ミクログロブリン(β2m)をモデル蛋白質としておこなった ThT によるアミロイド線維形成反応の検出について述べる。酸変性した β2m は、塩存在下(e.g. 10 mM HCl, 100 mM NaCl)でアミロイド線維を形成する(文献4, 5)。本稿では、線維反応溶液を少量取り出し ThT 蛍光測定をおこなう ex situ 測定(A)と線維反応溶液に ThT を加え直接蛍光測定をおこなう in situ 測定(B、C)について紹介する。また、アミロイド線維形成と密接に関わるが ThT には反応しないアモルファス凝集の測定についても紹介する(D)。
主な内容
- (A)アミロイド線維の自発形成反応とシーディング反応の ex situ 測定
- (B)アミロイド線維形成反応の in situ 測定(蛍光光度計)
- (C)アミロイド線維形成反応の in situ 測定(蛍光マイクロプレートリーダー)
- (D)アミロイド線維形成反応とアモルファス凝集形成反応の同時測定
実験器具・装置
(A)アミロイド線維の自発形成反応とシーディング反応の ex situ 測定
- 蛍光光度計(各社、本プロトコルでは日立 F4500 の使用を想定)
- 蛍光光度計用ガラスセル(各社)
- ボルテックスミキサー(各社)
(B)アミロイド線維形成反応の in situ 測定(蛍光光度計)
- 蛍光光度計(各社、本プロトコルでは日立 F4500 の使用を想定)
- スターラー機能付き恒温セルホルダー
- 循環恒温槽(各社)
- 蛍光光度計用ガラスセル(各社)
- (溶液を攪拌する場合)攪拌子
(C)アミロイド線維形成反応の in situ 測定(蛍光マイクロプレートリーダー)
- 蛍光プレートリーダー(各社、本プロトコルではコロナ電気 MTP-810 の使用を想定)
- 96ウェルプレート(各社、本プロトコルではグライナー675076(黒色、ハーフエリア)の使用を想定)
- プレート用シール(各社、本プロトコルではグライナー676070(圧着式透明シート)の使用を想定)
(D)アミロイド線維形成反応とアモルファス凝集形成反応の同時測定
- 蛍光光度計(各社、本プロトコルでは日立 F4500 の使用を想定)
- スターラー機能付き恒温セルホルダー
- 循環恒温槽(各社)
- 蛍光光度計用ガラスセル(各社)
- (溶液を攪拌する場合)攪拌子
試薬
- (A から D 共通)ThT(各社)
- (D)8-Anilinonaphthalene-1-sulfonic acid(ANS)(各社)
その他の必要な試薬等については、「実験の詳細」の各項目に記載
実験手順
- 溶液調製
- ThT 蛍光測定
実験の詳細
A)アミロイド線維の自発形成反応とシーディング反応の ex situ 測定
サンプルを少量取り出して ThT 溶液に混合し、蛍光を測定することでアミロイド線維形成をモニタリングする(ex situ 測定)。蛋白質の種類や実験条件等によっては、アミロイド線維核形成に非常に時間を要する場合がある。溶液の攪拌は、アミロイド線維形成反応を速やかに進める有効な手法である(「工夫とコツ」参照)。実験を効率的に素早くおこなうために様々な攪拌方法が用いられる。また、少量のアミロイド線維核(シード)が存在すると静置条件でも速やかにアミロイド線維形成が起こる。ここでは、酸変性 β2m をモデル蛋白質として、(a)振とうによるアミロイド線維の自発形成、(b)超音波によるアミロイド線維の自発形成、(c)静置条件でのシーディング反応の例を紹介する。
反応溶液組成
- ① サンプル溶液:25 μM β2m、100 mM NaCl、10 mM HCl
- ② ThT溶液:5 μM ThT、50 mM グリシンバッファー(pH 8.5)(1測定あたり1 mLを使用)
装置
恒温振とう培養器 M・BR-022UP(タイテック):温度37℃、撹拌強度 100 rpm
測定方法
蛍光光度計 F-4500(日立):定量演算モード、励起波長 445 nm、蛍光波長 485 nm、励起スリット 5 nm、蛍光スリット 10 nm、フォトマル電圧 700 V、積算時間5秒
10分に1回反応溶液を 5 μL 取り出し ThT 測定をおこなう。
A-1)溶液調製
① サンプル溶液
凍結乾燥 β2m 数 mg を 10 mM HCl に溶かし、マイレクス-GV 0.22 μm 長さ 4 mm(メルクミリポア)などのシリンジフィルターを通し、大きな凝集やごみを取り除く。UV 波長 280 nm(β2m の吸光係数 19,300 L/mol · cm)の吸収を測定し、蛋白質濃度を決定する(蛋白質ストック溶液)。ストック溶液の蛋白質濃度が 100 μM の場合、以下の比率で溶液を混合してサンプル溶液(1 mL)を作製する。
- 蛋白質ストック溶液(100 μM β2m、10 mM HCl):250 μL
- 希釈溶液(10 mM HCl):650 μL
- NaCl溶液(1 M NaCl、10 mM HCl):100 μL
② ThT 溶液
ThT を超純水で 100 μM となるように溶解する(ThT ストック溶液)。ThT ストック溶液は、光褪色を防ぐため遮光保存する。以下の比率で溶液を混合して ThT 溶液(50 mL)を作製する。ここでは、pH 8.5に調整した Glycine-NaOH 緩衝液を用いている(文献11)。
- ThT ストック溶液(100 μM ThT):2.5 mL
- 500 mM グリシンバッファー(NaOH を添加して pH 8.5 に調整):5 mL
- 超純水:42.5 mL
A-2)ThT 蛍光測定
蛍光光度計を定量演算もしくは時間変化モードで起動し、励起波長と蛍光波長をそれぞれ445と 485 nm に合わせる。積算時間は5~30秒。スリット幅とフォトマル電圧は、蛋白質濃度や蛋白質の種類、各光度計によって適切な値を設定する。蛍光強度は蛋白質の種類や濃度、アミロイド線維の構造、溶液条件、装置の状態で変化する。今回は定量演算モードで積算時間を5秒、スリット幅を励起側、蛍光側をそれぞれ 5 nm と 10 nm、フォトマル電圧を 700 V にした。
ThT 溶液 1 mL にサンプル溶液 5 μL を加え軽くボルテックスしてから、光路長 1 cm の4面透過型ガラスセルで蛍光強度を測定する(可視域なので石英セルでなくてよい)。ThT 溶液とサンプル溶液は Eppendorf や Watson の 2 mL チューブで混合するとマイクロピペットを用いなくても液切れよく蛍光ガラスセルに溶液全量を入れられる。測定後は溶液を廃棄し、ガラスセルをキムタオルなどに伏せて置き、溶液を吸わせるだけでよい。測定の都度ガラスセルを洗浄する必要はない。
(a)振とうによるアミロイド線維の自発形成
図1a に示すアミロイド線維形成実験では、恒温振とう培養器 M・BR-022UP(タイテック)を用いている(温度37℃、撹拌強度は 100 rpm に設定)。5~6時間程度のラグタイム(核形成反応)の後に爆発的なアミロイド線維伸長反応がみられる(反応モデルを用いたデータのフィッティングについては後述)。
(b)超音波によるアミロイド線維の自発形成
超音波の照射により、アミロイド線維形成反応は劇的に促進される(文献12, 13)。ELESTEIN(エレコン科学)と Quava mini(カイジョー)はいずれも恒温循環槽を取り付け可能な水槽型の超音波照射装置であり、周波数はそれぞれ約 19 kHz と 25 kHz である(Quava mini は可変)。発振強度はそれぞれ 700 W と 50 W である(Quava mini は可変)。測定の一例を図1b に示す(超音波照射装置はELESTEIN。超音波照射時間は1分照射と9分休みを繰り返すサイクルに設定。恒温槽は37℃に設定。水面は水槽に固定したサンプルチューブの蓋と同じ高さになるように調節)。
(c)静置条件でのシーディング反応
あらかじめ作製されたアミロイド線維を核としてモノマー溶液に少量加えると、ラグタイムのない伸長相のみからなる反応が起こる(シーディング反応)。図1c では、溶液調製は自発線維形成の時と全く同じであり、そこへ蛋白質重量濃度で5%(ここではモノマー換算で 1.25 μM)のアミロイド線維を加えている(1 mL のモノマー溶液を準備し、シードとして超音波照射下で作製したアミロイド線維溶液を 50 μL 加え、即座に ThT 測定を開始。サンプルは37℃、静置で反応)。
B)アミロイド線維形成反応の in situ 測定(蛍光光度計)
ThT 測定を ex situ でおこなうと1点1点手作業でおこなう必要があり、また、測定ごとにサンプルが少しずつ減っていく。サンプル溶液に ThT を混ぜておけばサンプル量を減らすことなく蛍光光度計の中で自動的に反応を追跡することが可能である。ただし、ThT 結合がアミロイド線維形成へ影響を与える場合がある(文献14)。また、誤ったデータ解釈を避けるために、以下の点に注意する必要がある(「工夫とコツ」参照)。
- ポリフェノール等着色のある添加物存在下や ThT の結合を阻害するような物質の存在下では ThT 蛍光測定の障害となり正しい測定ができなくなる場合がある(文献15)。
- 酸性条件下では、ThT蛍光強度が弱くなることが知られている(必要に応じて、測定装置の設定でスリット幅を広げるなどして高感度に検出する工夫をするとよい)。
- アルカリ条件下(pH 9以上)では、経時的に ThT 蛍光強度が減少する(文献16, 17)。
反応溶液組成
サンプル溶液:25 μM β2m、100 mM NaCl、10 mM HCl、5 μM ThT(液量1.5 mL)
装置
蛍光光度計 F-4500(日立):温度37℃(循環恒温槽)、スターラー撹拌速度 800 rpm(自発)、600 rpm(シーディング)
測定方法
蛍光光度計 F-4500(日立):時間変化モード、励起波長 445 nm、蛍光波長 485 nm、励起スリット 5 nm、蛍光スリット 10 nm、フォトマル電圧 700 V、積算時間10秒
測定は自動でおこなう。
B-1)溶液調製
サンプル溶液 1.5 mL を光路長 1 cm の蛍光ガラスセルに入れる。ガラスセル内で溶液を攪拌させる場合は、攪拌子を先に入れておくとよい(アズワン 62-7028-80 セル底から検出窓までの高さが 8 mm 程度あるため高さのある攪拌子を用いることで液量の節約になる)。溶液が蒸発しないようにセル蓋をしてパラフィルムで固定する。
B-2)ThT 蛍光測定
蛍光測定は時間変化モードにし、励起波長と蛍光波長はそれぞれ 445 nm と 485 nm を用いる。溶液を攪拌する場合は、スターラー機能付き恒温セルホルダーを用いて 500~1500 rpm(溶液が飛び散らない程度)で溶液を撹拌する。循環恒温槽をセルホルダーにつなぎ、温度を37℃一定に保つ。測定間隔は全体の反応時間を考慮して設定する。測定結果の一例を図2a に示す。
シーディング反応も in situ で反応を追跡することができる(図2b)。シードを溶液中に加えるとすぐに反応が始まるので手際よく作業をする必要がある。蛍光セルにシード溶液以外の溶液を入れた状態で光度計セルホルダーにセルをセットする。この時にベースラインを測定しておくとよい。この状態でシードを添加し、素早く蓋をして測定を開始する。
C)アミロイド線維形成反応の in situ 測定(蛍光マイクロプレートリーダー)
蛍光プレートリーダーを使用することで様々な溶液条件(pH、塩濃度、添加物の有無など)の実験を一度に少量のサンプル溶液でおこなうことができる。
反応溶液組成
サンプル溶液:25 μM β2m、100 mM NaCl、10 mM HCl、5 μM ThT(1ウェルあたり約 200 μL)
装置
超音波照射装置 ELESTEIN(エレコン科学):温度37℃、超音波照射サイクル1分照射9分休み
測定方法
蛍光プレートリーダー MTP-810(コロナ電気):多点モード(9点)、励起波長 450 nm、蛍光波長 490 nm、半値幅 5 nm、フォトマル高圧 高、フラッシュ回数20回
10分に1回プレートを超音波照射装置から取り出し測定する。
C-1)溶液調製
マイクロプレート(ハーフウェル)の場合は1ウェルに約 200 μL 加え、気泡が混入しないように慎重にマイクロプレート用シールで蓋をする(通常の96ウェルプレートは1ウェル 400 μL であるが、本プロトコルでは液量を節約するため穴径が半分のハーフウェルを使用している)。プレートリーダーの機種や設定によって蛍光測定は上方検出と下方検出に分かれるが、上方検出の場合は気泡の混入や結露が蛍光測定に影響を与える場合があるので気泡がなるべく入らないように注意する。著者が主に使用しているグライナーの圧着式フィルム(670670)は貼り付け強度が高く反応への影響が少ないため、問題なく上方検出による蛍光測定ができる。サンプル溶液を隣のウェルに混入させない程度多めに入れ、少しあふれさせながらシールすると気泡が入りにくい。本稿で使用しているプレートシールは圧着式であるため、定規や爪等でしっかり圧着させる。また、測定中に空気の膨張でシールが外れないようにウェル外の領域に注射針等で数カ所穴をあけておく。
C-2)ThT 蛍光測定
マイクロプレートリーダーには撹拌機能が付いたものが多いが、強度は弱く反応時間がかかる。ウェル内にビーズ等を入れることにより攪拌を促進することができる(文献18)。ビーズは素材やサイズによって反応への影響が出やすいので実験前に十分検討する必要がある。詳細は文献18等を参考にしていただきたい。ここでは短時間で実験をおこなうために水槽型の超音波照射装置 ELESTEIN を用いて溶液を撹拌する例を紹介する(文献19)。マイクロプレートを ELESTEIN の水槽水面に固定し、超音波を照射する。超音波照射(1分)後の待ち時間(9分)の間にプレートリーダーで蛍光を測定する。マイクロプレートリーダー MTP-810 はウェル内数カ所の蛍光値を平均化できる多点モードがある。96ウェルすべてを測定するには5分程度要する。測定例を図2c に示す。
シーディング反応では、シードを添加したサンプル溶液を素早くウェルに注入し、フィルムを貼って測定を開始する(図2d)。シードを加えないサンプルのウェルを作り、ベースラインとして同時に測定をしておくとよい。
D)アミロイド線維とアモルファス凝集形成反応の同時測定
ここまでアミロイド線維のみに着目し、その測定を紹介してきた。しかし、アミロイド線維原性蛋白質やペプチドはしばしばアミロイドではない不定形の凝集(アモルファス凝集)やオリゴマーを形成することがある。神経変性疾患の治療や線維構造解析のサンプル作製等にはこれらアミロイド以外の凝集形成を理解し、制御することが重要である。ここでは、蛍光光度計を用いたアミロイド線維とアモルファス凝集の同時測定方法を紹介する(文献4, 5)。ほとんどの蛍光光度計は励起光の光源に対して垂直方向に検出器が設置されているため、垂直方向の光散乱を測定することができる。光散乱は粒子サイズの大きなものが増えてくると強度が大きくなるため、簡便に蛋白質凝集量を評価することができる(なお、粒子サイズや形状を測定できる動的光散乱や静的光散乱とは異なる。これらはいずれも特別な装置が必要となる)。光散乱と ThT 蛍光が同時に測定できれば、アミロイド線維とアモルファス凝集を同時に検出することが可能である。また、異なる蛍光プローブを用いることでそれぞれのプローブに対応した反応を同時に測定できる。実際に、蛍光光度計を用いることで、ThT の励起波長 445 nm に対して 445–485 nm の領域を含む波長領域の蛍光スペクトルを測定することで、光散乱と ThT 蛍光を同時測定できる。
ここでは、さらに、8-Anilinonaphthalene-1-sulfonic acid(ANS)を用いた2波長測定について紹介する。ANS は蛋白質フォールディングの研究で使用されてきた疎水性プローブであるが、蛋白質凝集の検出にも用いることができる。蛋白質が凝集すると一般的に疎水性コアが露出するため、ANS が結合し 380 nm 付近の励起光に対して 485 nm 付近の蛍光を発する(蛍光極大波長は若干ブルーシフトする)。ANS と ThT は、励起波長は大きく異なるが、蛍光波長が近いため、異なる励起波長に対し一つの蛍光波長を追跡することで両者を同時に測定できる。
反応溶液組成
サンプル溶液:25 μM β2m、300 mM NaCl、10 mM HCl、5 μM ThT、50 μM ANS(液量 1.5 mL)
装置
蛍光光度計 F-4500(日立):温度37℃(循環恒温槽)、スターラー撹拌速度 800 rpm
測定方法
蛍光光度計 F-4500(日立):波長スキャンモード、励起波長 330–450 nm、蛍光波長 485 nm、励起スリット 5 nm、蛍光スリット 5 nm、フォトマル電圧 700 V、測定間隔5分毎
測定は自動でおこなう。
D-1)溶液調製
サンプル溶液 1.5 mL を光路長 1 cm の蛍光ガラスセルに入れる。必要に応じて、攪拌子を入れる。溶液が蒸発しないようにセル蓋をしてパラフィルムで固定する。
D-2)蛍光測定
蛍光セルをセルホルダーにセットし、スペクトル測定モードで測定をおこなう。測定スペクトルは蛍光スペクトルではなく励起スペクトルを測定する。励起波長は 330–450 nm、蛍光波長は 485 nm にセットする。測定速度と測定間隔は全体の反応時間に対して適当に決める。
ThT 蛍光と光散乱の同時測定の場合は蛍光スペクトルモードに設定し、励起波長を 445 nm、蛍光波長を 430–550 nm に設定する。溶液の攪拌が必要な場合は、目的の回転速度に設定して攪拌子で溶液を攪拌する(図3では、800 rpm)。
測定したスペクトル(図3a)の ThT(445 nm)と ANS(375 nm)に対応する波長を取り出し、時間に対してプロットする(図3b)。光散乱を測定した場合は ThT(485 nm)、光散乱(445 nm)をプロットする。条件によってはアモルファス凝集とアミロイド線維が時間差でできてくる過程が観察できる。
光散乱を測定した場合にしばしば起こるが、強度が非常に高く測定限界に達してしまったときは適宜波長をずらしてピークの裾の時間変化がみられる波長でプロットする。ThT 蛍光の影響を受けにくい短波長側の裾をプロットするとよい。
工夫とコツ
サンプル溶液調製の注意点
アミロイド線維形成反応は蛋白質濃度や溶質濃度に非常に敏感であり、構造多型も多く複雑な反応であるため再現性の良い実験をおこなうためには注意点がいくつかある。サンプル調製は基本的には試薬を目的の条件になるように混合するだけであるが、手順によっては予期せぬ反応がおこる。そういった反応が重要な発見につながることもあるが、やはり、きれいで再現性のあるデータを取得するためには細心の注意を払うべきである。
蛋白質のストック溶液の準備においては、高濃度のストック溶液や等電点付近のバッファーでの溶解は凝集形成を引き起こす可能性がある。筆者は標準的な実験条件(数十 μM 程度)の際は、常に 100 μM 程度になるように蛋白質を溶かしている。
また、溶液の混合順序によっては局所濃度の変化により予期せぬ反応が引き起こされるため混合順序は常に同じにしておく。筆者は蛋白質溶液以外の溶液を先に混合し最後に蛋白質溶液を添加し、ピペッティングにより静かに溶液を混合している。 pH の急激な変化も実験結果を変化させてしまうことがある。溶液を混合する際には pH 変化を考慮して調製するとよい。筆者は、すべてのストック溶液を目的の pH のバッファー等で調製している。今回の酸性 β2m の場合はすべて 10 mM HCl を含むストック溶液を準備した。蛋白質の溶解により若干の pH 変動が起こりうるが、この程度の濃度範囲では影響はなく、むしろ pH 調整のための HCl の添加は塩濃度を変化させてしまう(文献20)。
ThT について(誤ったデータ解釈をしないための注意点)
ThT の濃度に関しては多くの論文が 5–25 μM 程度を採用している。通常の希薄な蛋白質濃度(数 μM~数十 μM)であれば、アミロイド線維量に比例して ThT 蛍光を発する(文献21)。著しく濃い蛋白質濃度での測定では ThT 濃度にも注意が必要であるが、場合によっては反応への影響(後述)もあるため注意が必要である。また、大過剰の ThT が存在すると自己消光により蛍光強度が減少する可能性が示唆されている(文献22)。これらのことから、ThT 濃度は 25 μM 以下にするのがよいと著者は考える。ただし、イントロダクションで既述したように、ThT 蛍光強度はアミロイド線維の絶対量を示すものではなく、蛋白質の種類や溶液条件に依存する。
酸性条件では ThT 蛍光強度は低下するが、本稿で示すように in situ 測定は可能である。その一方で、アルカリ条件下(pH 9以上)では時間の経過と共に ThT のヒドロキシル化が進行するため、経時的な ThT 蛍光の減少がみられる(文献16, 17)。実際にアミロイド線維が脱重合しているかどうかは、ThT 蛍光の ex situ 測定や他の測定手法などを組み合わせて総合的に判断する必要がある。
本プロトコルでは、ThT 蛍光の ex situ 測定における ThT 溶液は pH 8.5 に調整している(文献11)。酸性条件下で形成されたアミロイド線維が pH の変化により脱重合する可能性がある(時間変化モードで脱重合の有無を確認できる)。脱重合により ThT 蛍光がうまく測定できない場合は、サンプルと同じ溶媒組成の ThT 溶液を用いるとよい。
溶液の撹拌方法
アミロイド線維の自発形成に時間を要する場合、溶液を撹拌することで反応が促進される。撹拌方法はスターラーによる撹拌、振とう器による撹拌など様々なものがある。反応の早い遅いはあるが、特別な装置である必要はなく、培養シェーカーやボルテックスミキサーなど身近にあるものを代用してもよい。撹拌の中でも超音波の音圧キャビテーションや溶液のずりによるせん断応力を利用したものは非常によく線維形成を促進できる(文献12, 23–26)。スターラーやビーズをサンプルに入れる場合はそれらの形状や素材にも強く影響される(文献18)。こういったことから溶液の撹拌によるアミロイド線維形成の促進は単に分子衝突頻度を上げているだけではないため、それぞれの撹拌の特徴を認識して使用するとよい。また、溶液を均質化する目的としての撹拌においても自発線維形成の促進効果が出てしまうため、それを念頭に置いて実験をおこなうとよい。
in situ 測定と ex situ 測定の比較
ex situ 蛍光測定によるアミロイド線維形成のモニタリングでは、サンプリングの際の測定誤差が生じやすい(サンプル溶液の不均一性によるところが大きい)。同じサンプルを継続的に観察する in situ 測定では、都度のサンプリングに起因する誤差が抑制される。一方で、上述のように in situ 測定では ThT 蛍光測定の障害となる化合物の存在(文献15)や酸性溶液で蛍光強度が低くなるなどの影響を受ける。また、ThT がアミロイド線維形成を変化(促進または抑制)させてしまう場合もあるため、注意が必要である(文献14)(酸変性 β2m の場合は、ThT 結合によるアミロイド線維形成過程の違いはみられない(文献21))。したがって、データ解釈を誤らないためには、ThT 蛍光の ex situ 測定を組み合わせて総合的に判断する必要がある。
反応モデルを用いたデータのフィッティング
アミロイド線維の自発形成実験では、測定開始直後は蛍光強度が上昇しない期間がある。この期間をラグタイム(潜伏期間)と呼び、反応の速さや抑制機構などを議論する際にしばしば用いられる。ラグタイムの明確な定義はなく、反応モデルにフィッティングして得られたパラメータを用いる場合や生データからある閾値に達する時間を読み取る場合などがある。
アミロイド線維形成反応のモデルは様々なモデルが提唱されている。最も簡易的かつ有用な反応モデルは Finke-Watzky の2ステップモデルで、可溶性のモノマー分子がアミロイド線維核構造へ変換する過程(M → F)とアミロイド線維へモノマー分子が付加する過程(F + M → 2F)の2つのステップからなる(文献27)。それぞれの反応速度定数を \(k_{1}\)、\(k_{2}\) としてアミロイド線維形成の時間変化を記述すると以下のようになる。
\[\begin{align*} \dfrac{\mathrm{dF}}{\mathrm{d}t}\ &= k_{1}\mathrm{M} + k_{2}\mathrm{MF} \\ \mathrm{M}_{0} &= \mathrm{M} + \mathrm{F} \end{align*}\]この式を解析的に解くと、
\[\mathrm{F} = \dfrac{\mathrm{M}_{0} \left( 1 - e^{-(k_{1} + k_{2}\mathrm{M}_{0}) t} \right)}{1 + \dfrac{k_{2}}{k_{1}}\mathrm{M}_{0}e^{-(k_{1} + k_{2}\mathrm{M}_{0})t}}\]となり、ThT 蛍光強度の経時変化をよく再現している(\(\mathrm{M}_{0}\) は蛋白質のモノマー換算濃度)。アミロイド線維形成のモデルは二次核形成などを考慮したより複雑なモデル等様々なモデルが提唱されている(文献28)。
実験の再現性を確認するために繰り返し実験をおこなう場合、データの取り扱いには注意を要する。図4では、5回の繰り返し実験で核形成速度にバラツキが生じた場合を模擬している(線維伸長速度は同じ値で固定)。すべてのデータをまとめて反応モデルにフィッティングすると、得られる伸長カーブはなだらかになり、それぞれの測定データから得られる伸長速度より遅い値になってしまう。このような問題を避けるためには、それぞれの測定データで反応モデルにあてはめる必要がある。その一方で、異なる蛋白質濃度で得られるアミロイド線維形成データをより複雑なモデルにあてはめてグローバルパラメータを得たい場合など、状況に応じて適切にデータ解析する必要がある。
あとがき
本稿では ThT による β2m アミロイド線維形成反応の実験方法について述べてきた。蛋白質や溶液条件が異なっていても基本的には同様の条件で測定が可能であり、蛍光検出のための機器さえあれば容易にできる実験であるが、凝集物の検出であることや複雑な反応機構のためにきれいなデータや再現性のよいデータを得るために経験やコツを積んでいただきたい。また、ThT 測定はアミロイド線維検出のゴールドスタンダードであるが、絶対ではない。ThT 蛍光は基本的にはアミロイド線維量を反映するが、ThT 蛍光が測定できるかどうかはアミロイド線維表面構造やアミロイドコア領域の大きさ、溶液条件に強く依存し、中には ThT 蛍光を示さないアミロイド線維も存在する。これとは逆に、結合によって ThT 蛍光が増大する蛋白質も存在するため、注意を要する(文献29, 30)。得られた結果を正しく判断するには、円二色性スペクトル(萩原義久, 蛋白質科学会アーカイブ, 1, e002 (2008))などの分光法や、透過型電子顕微鏡(TEM)や原子間力顕微鏡(AFM)といった顕微鏡法による追加の情報を提示するのが好ましい。また、ThTは全反射蛍光顕微鏡によるアミロイド線維形成の直接観察(文献31)においても蛍光プローブとして使用されている(伴匡人ら, 蛋白質科学会アーカイブ, 1, e042 (2008))。
文献
- Chiti, F., Dobson, C.M., Annu. Rev. Biochem., 86, 27–68 (2017)
- Eisenberg, D., Jucker, M., Cell, 148, 1188–1203 (2012)
- Iadanza, M.G., Jackson, M.P., et al., Nat. Rev. Mol. Cell Biol., 19, 755–773 (2018)
- Yoshimura, Y., Lin, Y., et al., Proc. Natl. Acad. Sci. U. S. A., 109, 14446–14451 (2012)
- Adachi, M., So, M., et al., J. Biol. Chem., 290, 18134–18145 (2015)
- So, M., Hall, D., et al., Curr. Opin. Struct. Biol., 36, 32–39 (2016)
- Naiki, H., Higuchi, K., et al., Anal. Biochem., 177, 244–249 (1989)
- Xue, C., Lin, T.Y., et al., R. Soc. Open Sci., 4, 160696 (2017)
- Biancalana, M., Koide, S., Biochim. Biophys. Acta, 1804, 1405–1412 (2010)
- Namioka, S., Yoshida, N., et al., Biochemistry, 59, 2782–2787 (2020)
- LeVine, H., Quantification of β-sheet amyloid fibril structures with thioflavin T. In Methods Enzymol, 309, 274–284, Academic Press (1999)
- Ohhashi, Y., Kihara, M., et al., J. Biol. Chem., 280, 32843–32848 (2005)
- Chatani, E., Lee, Y.-H., et al., Proc. Natl. Acad. Sci. U. S. A., 106, 11119–11124 (2009)
- D’Amico, M., Di Carlo, M.G., et al., J. Phys. Chem. Lett., 3, 1596–1601 (2012)
- Hudson, S.A., Ecroyd, H., et al., FEBS J., 276, 5960–5972 (2009)
- Hackl, E.V., Darkwah, J., et al., Eur. Biophys. J., 44, 249–261 (2015)
- Foderà, V., Groenning, M., et al., J. Phys. Chem. B, 112, 15174–15181 (2008)
- Abdolvahabi, A., Shi, Y., et al., Biophys. J., 112, 250–264 (2017)
- So, M., Yagi, H., et al., J. Mol. Biol., 412, 568–577 (2011)
- Goto, Y., Fink, A.L., J. Mol. Biol., 214, 803–805 (1990)
- Xue, W.-F., Homans, S.W., et al., Proc. Natl. Acad. Sci. U. S. A., 105, 8926–8931 (2008)
- Younan, N.D., Viles, J.H., Biochemistry, 54, 4297–4306 (2015)
- Yoshimura, Y., So, M., et al., Jpn. J. Appl. Phys., 52, 07HA01 (2013)
- Nakajima, K., Ogi, H., et al., Sci. Rep., 6, 22015 (2016)
- Morimoto, D., Walinda, E., et al., Anal. Chem., 89, 7286–7290 (2017)
- Dobson, J., Kumar, A., et al., Proc. Natl. Acad. Sci. U. S. A., 114, 4673–4678 (2017)
- Watzky, M.A., Finke, R.G., J. Am. Chem. Soc., 119, 10382–10400 (1997)
- Dear, A.J., Michaels, T.C.T., et al., Proceedings of the National Academy of Sciences, 117, 12087–12094 (2020)
- De Ferrari, G.V., Mallender, W.D., et al., J. Biol. Chem., 276, 23282-23287 (2001)
- Groenning, M., Olsen, L., et al., J. Struct. Biol., 158, 358–369 (2007)
- Ban, T., Yamaguchi, K., et al., Acc. Chem. Res., 39, 663–670 (2006)
謝辞
本記事は、著者が大阪大学蛋白質研究所・後藤祐児教授(現所属、大阪大学国際医工情報センター)の指導の下で遂行した研究内容をまとめたものです。研究遂行にあたり、内木宏延教授(福井大学)、荻博次教授(大阪大学)、後藤研究室(大阪大学蛋白質研究所 蛋白質構造形成研究室)の構成員の皆様をはじめとする多くの方々にご協力をいただきました。
最後に、2020年3月に定年退職を迎えられた後藤先生に於かれましては、長年にわたり無事勤めあげられましたことを心よりお祝い申し上げます。
修正履歴
「工夫とコツ」の「溶液の撹拌方法」の「文献12, 23–16」を「文献12, 23–26」に訂正
<a href=”/archives/files/articles/.pdf”
修正前の PDF </a>
-
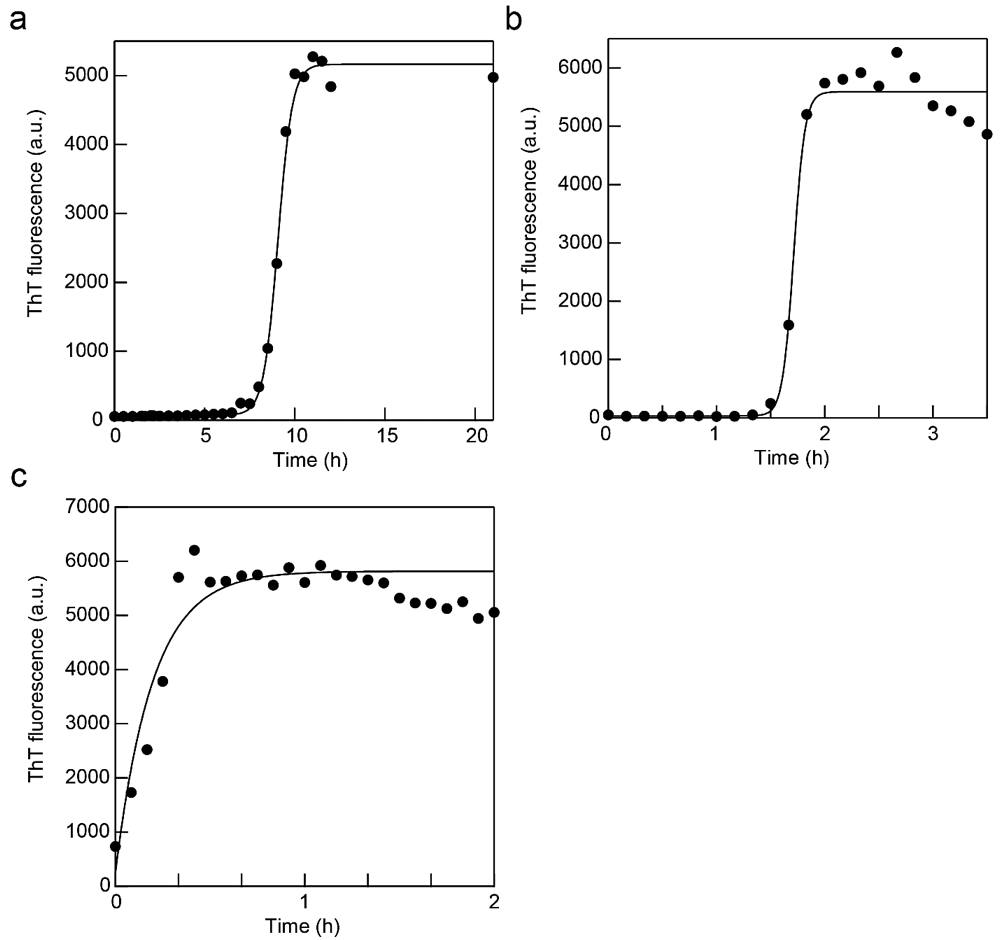
図1:β2m アミロイド線維の ex situ 測定。(a、b)振とう(a)と超音波(b)による β2m アミロイド線維の自発形成を ThT で追跡した時の蛍光強度の時間変化。実線は Finke-Watzkey の2ステップモデルによるフィッティング曲線。(c)シーディング反応。実線は指数関数でのフィッティング曲線。 -
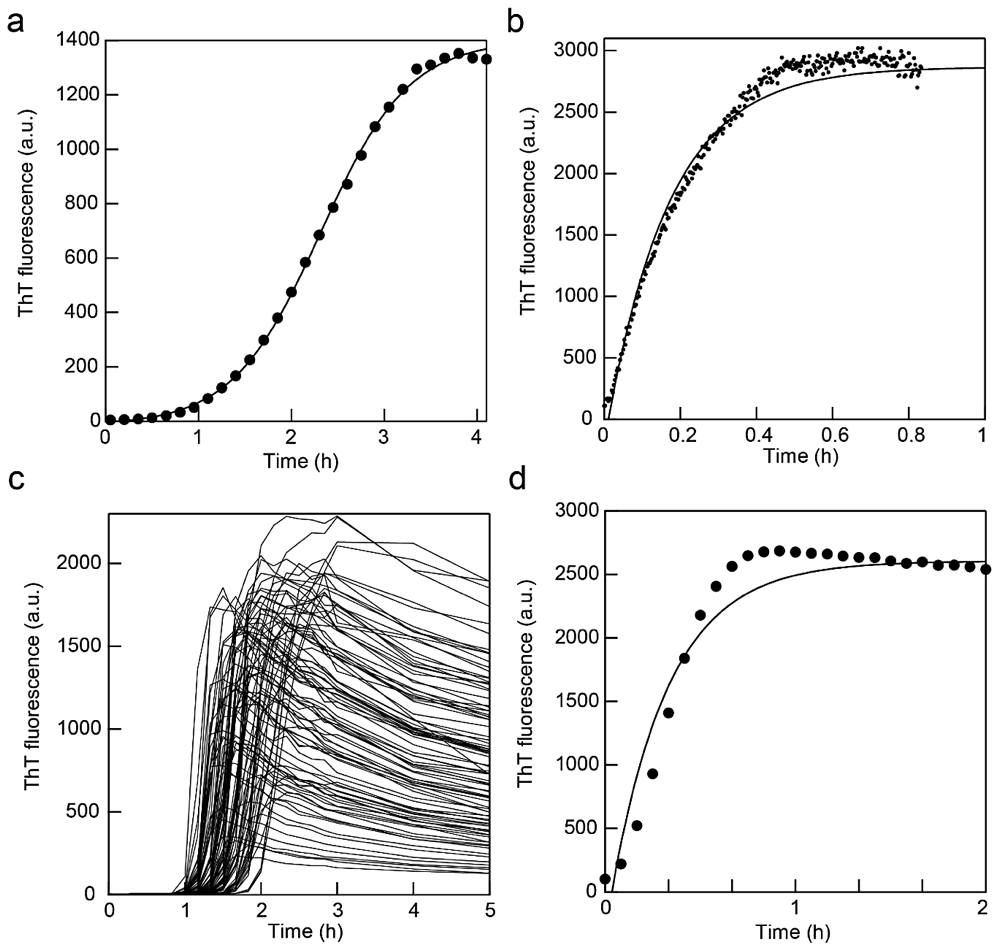
図2:アミロイド線維の in situ 測定。(a)蛍光光度計中でのアミロイド線維形成反応。撹拌子を 800 rpm で回転させた。実線は Finke-Watzkey の2ステップモデルによるフィッティング曲線。文献4を改変。(b)蛍光光度計中でのシーディング反応。撹拌子を 600 rpm で回転させた。実線は指数関数でのフィッティング曲線。(c)超音波と蛍光プレートリーダーによるアミロイド線維形成反応。文献19を改変。(d)蛍光プレートリーダー MTP-810 を用いたシーディング反応。実線は指数関数でのフィッティング曲線。 -
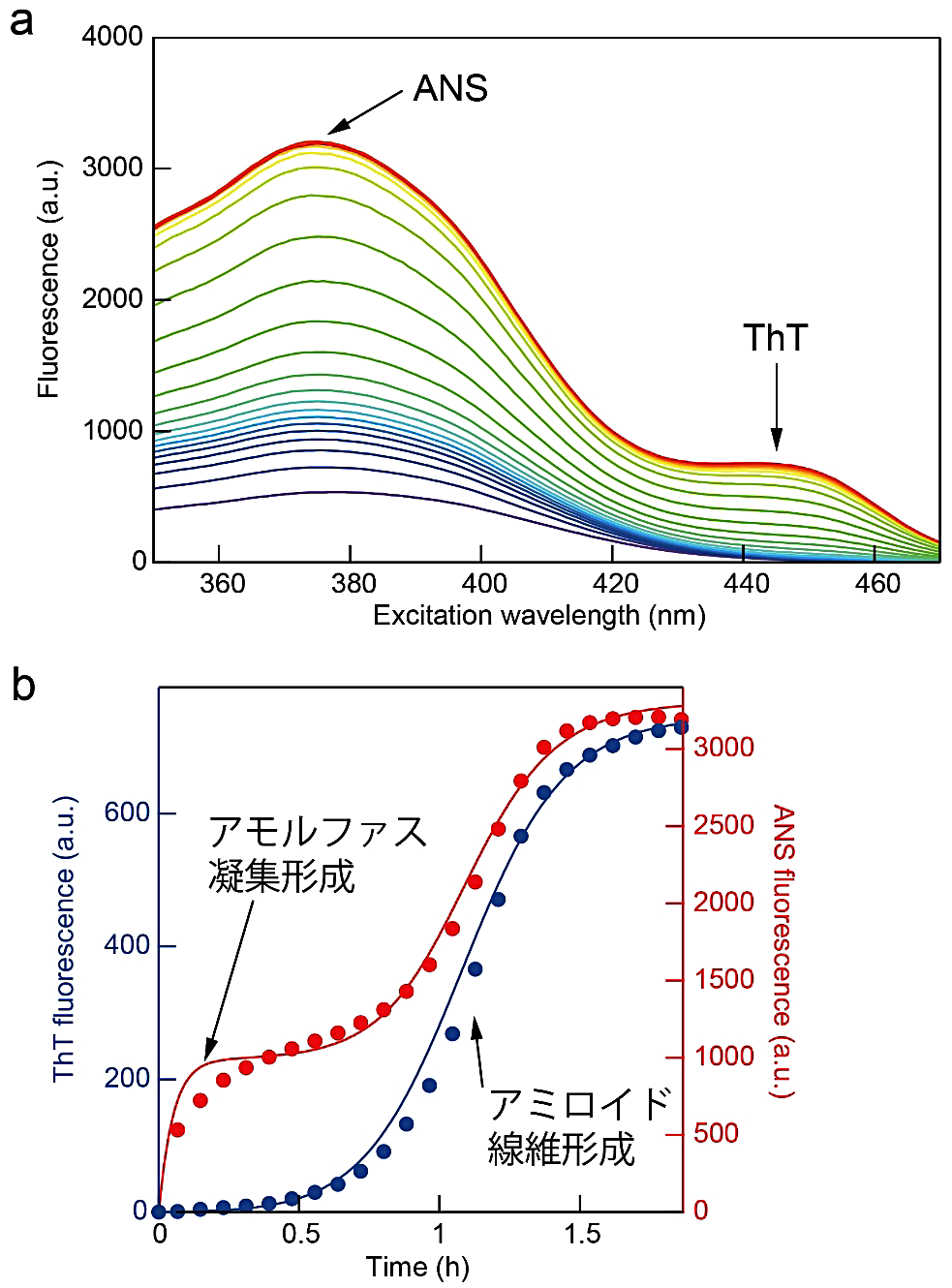
図3:アミロイド線維形成反応とアモルファス凝集形成反応の同時測定。(a)ThT と ANS 存在下での励起スペクトルの時間変化。蛍光波長は 485 nm。445 nm と 375 nm のピークがそれぞれ ThT と ANS の蛍光に相当する。(b)励起波長 445 nm(青)と 375 nm(赤)の時間変化。実線は Finke-Watzkey のモデルを改変したモデル(文献5)でフィッティングした曲線。 -
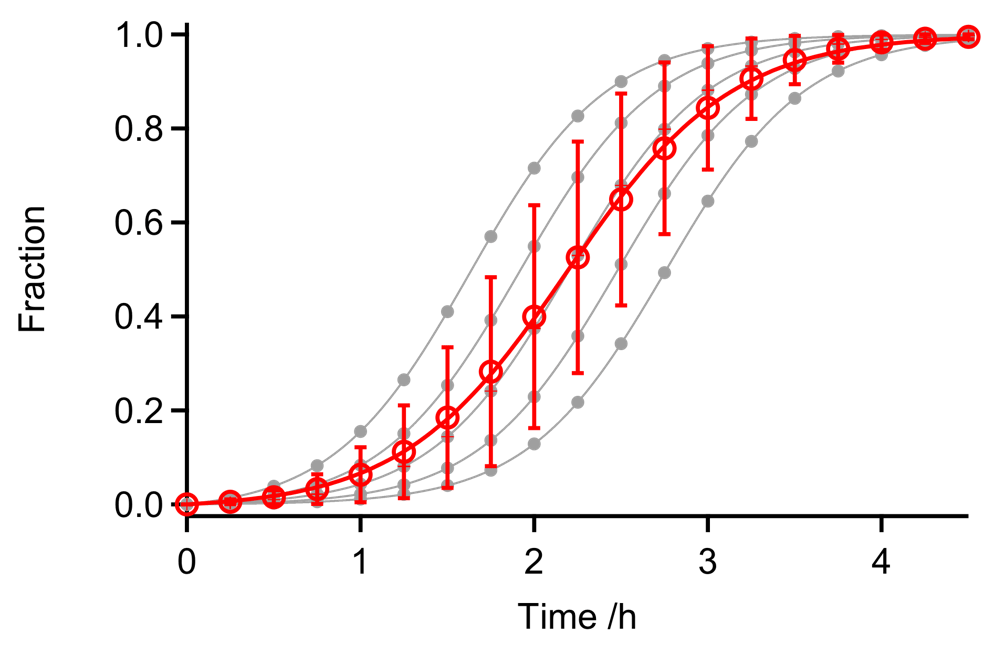
図4:5回の繰り返し実験で核形成速度にバラツキが生じた場合のシミュレーション。Finke-Watzky の2ステップモデルの核形成速度定数(\(k_{1}\))を \(0.0025\)、\(0.005\)、\(0.01\)、\(0.02\)、\(0.04 \ \mathrm{h}^{-1}\) とし、伸長速度定数(\(k_{2}\))は \(0.1 \ \mu \mathrm{M}^{-1} \ \mathrm{h}^{-1}\) で固定している。蛋白質濃度は \(25 \ \mu \mathrm{M}\)。すべてのデータをまとめて反応モデルにフィッティングすると、実際の伸長速度(\(k_{2} = 0.1 \ \mu \mathrm{M}^{-1} \ \mathrm{s}^{-1}\))よりも小さい伸長速度(\(k_{2} = 0.083 \pm 0.006 \ \mu \mathrm{M}^{-1} \ \mathrm{s}^{-1}\))が得られる(赤色の実線)。
概要
アミロイド線維の検出にはアミロイド特異的蛍光色素であるチオフラビン T を用いるのが一般的である。本稿では、アミロイド線維形成反応の経時変化をチオフラビン T を用いて追跡する際の手順や注意点について述べる。
イントロダクション
蛋白質は天然構造を取ることで機能を発揮する。高温で熱したり、酸を加えたりすると、蛋白質は変性し、しばしば凝集体を形成する。蛋白質凝集と一口に言ってもその形態や構造は様々である。アミロイド線維は蛋白質が作る針状の凝集体で、β ストランドが線維軸に垂直に並んだクロス β 構造と呼ばれる構造からなる1次元結晶様の凝集体である(文献1–3)。アミロイド線維が関わる病気を総称してアミロイドーシスと呼び、アルツハイマー病やパーキンソン病など多くの疾患が報告されている。さらに、正常な細胞や組織で機能する機能性アミロイドの存在や、アミロイド線維の剛直性などを利用した産業応用などが試みられていることから、アミロイド線維構造や形成機構を理解することの重要性が増している。
アミロイド線維を形成する蛋白質やペプチドのアミノ酸配列には共通性はなく、様々な配列が皆同じようにクロスβ構造をもったアミロイド線維を形成する。このようなことからもアミロイド線維形成は単なる異常凝集ではなく、蛋白質の持つ一般的な性質だと言える。アミロイド線維形成反応は結晶化によく似ており、鋳型となる核形成とそれに続く伸長反応からなる。蛋白質は固有の溶解度が存在し、溶解度を超えた分だけ析出(凝集)することが著者らの近年の研究から示唆されている。アミロイド線維の核形成は非常に高いエネルギー障壁があるため、溶解度を超えていてもすぐには凝集せず、過飽和状態となる。蛋白質濃度や塩などの溶質濃度が高くなり過飽和度が大きくなるほど核形成頻度は高まり、アミロイド線維が形成しやすくなるが、あまりにも高濃度で核形成頻度の高い条件では、秩序構造ができず不定形凝集になる。詳細は文献4–6を参考にしていただきたいが、このようにアミロイド線維形成とオリゴマーを含む不定形凝集(さらには、近年話題となっている液–液相分離現象も)とは隣り合わせの現象であり、それらをきちんと区別して検出し、包括的な理解をすることが重要である。
アミロイド線維を実験的に検出する手法は数多くあり、コンゴーレッド染色による特徴的な複屈折光を示したり、円二色性スペクトルや赤外分光で特徴的なスペクトルを示したり、X 線線維回折でクロス β 構造に特徴的な回折パターンを示すことなどが挙げられる。その中でもアミロイド線維特異的に結合し蛍光を発するチオフラビン T(ThT)はアミロイド線維の研究においてはゴールドスタンダードとして用いられている(文献7, 8)。ThT はアミロイド線維存在下で 445 nm 付近の光を吸収し 485 nm 付近に非常に大きな蛍光を発する。分子機構は文献9, 10等を参考にしていただきここでは割愛する。得られる ThT 蛍光強度は蛋白質の種類や溶液条件に依存し、アミロイド線維の絶対量を示すものではないため、本プロトコルを参考に条件に適した測定をおこなう必要がある(「工夫とコツ」参照)。本稿では、透析アミロイドーシスの原因蛋白質である β2-ミクログロブリン(β2m)をモデル蛋白質としておこなった ThT によるアミロイド線維形成反応の検出について述べる。酸変性した β2m は、塩存在下(e.g. 10 mM HCl, 100 mM NaCl)でアミロイド線維を形成する(文献4, 5)。本稿では、線維反応溶液を少量取り出し ThT 蛍光測定をおこなう ex situ 測定(A)と線維反応溶液に ThT を加え直接蛍光測定をおこなう in situ 測定(B、C)について紹介する。また、アミロイド線維形成と密接に関わるが ThT には反応しないアモルファス凝集の測定についても紹介する(D)。
主な内容
- (A)アミロイド線維の自発形成反応とシーディング反応の ex situ 測定
- (B)アミロイド線維形成反応の in situ 測定(蛍光光度計)
- (C)アミロイド線維形成反応の in situ 測定(蛍光マイクロプレートリーダー)
- (D)アミロイド線維形成反応とアモルファス凝集形成反応の同時測定
実験器具・装置
(A)アミロイド線維の自発形成反応とシーディング反応の ex situ 測定
- 蛍光光度計(各社、本プロトコルでは日立 F4500 の使用を想定)
- 蛍光光度計用ガラスセル(各社)
- ボルテックスミキサー(各社)
(B)アミロイド線維形成反応の in situ 測定(蛍光光度計)
- 蛍光光度計(各社、本プロトコルでは日立 F4500 の使用を想定)
- スターラー機能付き恒温セルホルダー
- 循環恒温槽(各社)
- 蛍光光度計用ガラスセル(各社)
- (溶液を攪拌する場合)攪拌子
(C)アミロイド線維形成反応の in situ 測定(蛍光マイクロプレートリーダー)
- 蛍光プレートリーダー(各社、本プロトコルではコロナ電気 MTP-810 の使用を想定)
- 96ウェルプレート(各社、本プロトコルではグライナー675076(黒色、ハーフエリア)の使用を想定)
- プレート用シール(各社、本プロトコルではグライナー676070(圧着式透明シート)の使用を想定)
(D)アミロイド線維形成反応とアモルファス凝集形成反応の同時測定
- 蛍光光度計(各社、本プロトコルでは日立 F4500 の使用を想定)
- スターラー機能付き恒温セルホルダー
- 循環恒温槽(各社)
- 蛍光光度計用ガラスセル(各社)
- (溶液を攪拌する場合)攪拌子
試薬
- (A から D 共通)ThT(各社)
- (D)8-Anilinonaphthalene-1-sulfonic acid(ANS)(各社)
その他の必要な試薬等については、「実験の詳細」の各項目に記載
実験手順
- 溶液調製
- ThT 蛍光測定
実験の詳細
A)アミロイド線維の自発形成反応とシーディング反応の ex situ 測定
サンプルを少量取り出して ThT 溶液に混合し、蛍光を測定することでアミロイド線維形成をモニタリングする(ex situ 測定)。蛋白質の種類や実験条件等によっては、アミロイド線維核形成に非常に時間を要する場合がある。溶液の攪拌は、アミロイド線維形成反応を速やかに進める有効な手法である(「工夫とコツ」参照)。実験を効率的に素早くおこなうために様々な攪拌方法が用いられる。また、少量のアミロイド線維核(シード)が存在すると静置条件でも速やかにアミロイド線維形成が起こる。ここでは、酸変性 β2m をモデル蛋白質として、(a)振とうによるアミロイド線維の自発形成、(b)超音波によるアミロイド線維の自発形成、(c)静置条件でのシーディング反応の例を紹介する。
反応溶液組成
- ① サンプル溶液:25 μM β2m、100 mM NaCl、10 mM HCl
- ② ThT溶液:5 μM ThT、50 mM グリシンバッファー(pH 8.5)(1測定あたり1 mLを使用)
装置
恒温振とう培養器 M・BR-022UP(タイテック):温度37℃、撹拌強度 100 rpm
測定方法
蛍光光度計 F-4500(日立):定量演算モード、励起波長 445 nm、蛍光波長 485 nm、励起スリット 5 nm、蛍光スリット 10 nm、フォトマル電圧 700 V、積算時間5秒
10分に1回反応溶液を 5 μL 取り出し ThT 測定をおこなう。
A-1)溶液調製
① サンプル溶液
凍結乾燥 β2m 数 mg を 10 mM HCl に溶かし、マイレクス-GV 0.22 μm 長さ 4 mm(メルクミリポア)などのシリンジフィルターを通し、大きな凝集やごみを取り除く。UV 波長 280 nm(β2m の吸光係数 19,300 L/mol · cm)の吸収を測定し、蛋白質濃度を決定する(蛋白質ストック溶液)。ストック溶液の蛋白質濃度が 100 μM の場合、以下の比率で溶液を混合してサンプル溶液(1 mL)を作製する。
- 蛋白質ストック溶液(100 μM β2m、10 mM HCl):250 μL
- 希釈溶液(10 mM HCl):650 μL
- NaCl溶液(1 M NaCl、10 mM HCl):100 μL
② ThT 溶液
ThT を超純水で 100 μM となるように溶解する(ThT ストック溶液)。ThT ストック溶液は、光褪色を防ぐため遮光保存する。以下の比率で溶液を混合して ThT 溶液(50 mL)を作製する。ここでは、pH 8.5に調整した Glycine-NaOH 緩衝液を用いている(文献11)。
- ThT ストック溶液(100 μM ThT):2.5 mL
- 500 mM グリシンバッファー(NaOH を添加して pH 8.5 に調整):5 mL
- 超純水:42.5 mL
A-2)ThT 蛍光測定
蛍光光度計を定量演算もしくは時間変化モードで起動し、励起波長と蛍光波長をそれぞれ445と 485 nm に合わせる。積算時間は5~30秒。スリット幅とフォトマル電圧は、蛋白質濃度や蛋白質の種類、各光度計によって適切な値を設定する。蛍光強度は蛋白質の種類や濃度、アミロイド線維の構造、溶液条件、装置の状態で変化する。今回は定量演算モードで積算時間を5秒、スリット幅を励起側、蛍光側をそれぞれ 5 nm と 10 nm、フォトマル電圧を 700 V にした。
ThT 溶液 1 mL にサンプル溶液 5 μL を加え軽くボルテックスしてから、光路長 1 cm の4面透過型ガラスセルで蛍光強度を測定する(可視域なので石英セルでなくてよい)。ThT 溶液とサンプル溶液は Eppendorf や Watson の 2 mL チューブで混合するとマイクロピペットを用いなくても液切れよく蛍光ガラスセルに溶液全量を入れられる。測定後は溶液を廃棄し、ガラスセルをキムタオルなどに伏せて置き、溶液を吸わせるだけでよい。測定の都度ガラスセルを洗浄する必要はない。
(a)振とうによるアミロイド線維の自発形成
図1a に示すアミロイド線維形成実験では、恒温振とう培養器 M・BR-022UP(タイテック)を用いている(温度37℃、撹拌強度は 100 rpm に設定)。5~6時間程度のラグタイム(核形成反応)の後に爆発的なアミロイド線維伸長反応がみられる(反応モデルを用いたデータのフィッティングについては後述)。
(b)超音波によるアミロイド線維の自発形成
超音波の照射により、アミロイド線維形成反応は劇的に促進される(文献12, 13)。ELESTEIN(エレコン科学)と Quava mini(カイジョー)はいずれも恒温循環槽を取り付け可能な水槽型の超音波照射装置であり、周波数はそれぞれ約 19 kHz と 25 kHz である(Quava mini は可変)。発振強度はそれぞれ 700 W と 50 W である(Quava mini は可変)。測定の一例を図1b に示す(超音波照射装置はELESTEIN。超音波照射時間は1分照射と9分休みを繰り返すサイクルに設定。恒温槽は37℃に設定。水面は水槽に固定したサンプルチューブの蓋と同じ高さになるように調節)。
(c)静置条件でのシーディング反応
あらかじめ作製されたアミロイド線維を核としてモノマー溶液に少量加えると、ラグタイムのない伸長相のみからなる反応が起こる(シーディング反応)。図1c では、溶液調製は自発線維形成の時と全く同じであり、そこへ蛋白質重量濃度で5%(ここではモノマー換算で 1.25 μM)のアミロイド線維を加えている(1 mL のモノマー溶液を準備し、シードとして超音波照射下で作製したアミロイド線維溶液を 50 μL 加え、即座に ThT 測定を開始。サンプルは37℃、静置で反応)。
B)アミロイド線維形成反応の in situ 測定(蛍光光度計)
ThT 測定を ex situ でおこなうと1点1点手作業でおこなう必要があり、また、測定ごとにサンプルが少しずつ減っていく。サンプル溶液に ThT を混ぜておけばサンプル量を減らすことなく蛍光光度計の中で自動的に反応を追跡することが可能である。ただし、ThT 結合がアミロイド線維形成へ影響を与える場合がある(文献14)。また、誤ったデータ解釈を避けるために、以下の点に注意する必要がある(「工夫とコツ」参照)。
- ポリフェノール等着色のある添加物存在下や ThT の結合を阻害するような物質の存在下では ThT 蛍光測定の障害となり正しい測定ができなくなる場合がある(文献15)。
- 酸性条件下では、ThT蛍光強度が弱くなることが知られている(必要に応じて、測定装置の設定でスリット幅を広げるなどして高感度に検出する工夫をするとよい)。
- アルカリ条件下(pH 9以上)では、経時的に ThT 蛍光強度が減少する(文献16, 17)。
反応溶液組成
サンプル溶液:25 μM β2m、100 mM NaCl、10 mM HCl、5 μM ThT(液量1.5 mL)
装置
蛍光光度計 F-4500(日立):温度37℃(循環恒温槽)、スターラー撹拌速度 800 rpm(自発)、600 rpm(シーディング)
測定方法
蛍光光度計 F-4500(日立):時間変化モード、励起波長 445 nm、蛍光波長 485 nm、励起スリット 5 nm、蛍光スリット 10 nm、フォトマル電圧 700 V、積算時間10秒
測定は自動でおこなう。
B-1)溶液調製
サンプル溶液 1.5 mL を光路長 1 cm の蛍光ガラスセルに入れる。ガラスセル内で溶液を攪拌させる場合は、攪拌子を先に入れておくとよい(アズワン 62-7028-80 セル底から検出窓までの高さが 8 mm 程度あるため高さのある攪拌子を用いることで液量の節約になる)。溶液が蒸発しないようにセル蓋をしてパラフィルムで固定する。
B-2)ThT 蛍光測定
蛍光測定は時間変化モードにし、励起波長と蛍光波長はそれぞれ 445 nm と 485 nm を用いる。溶液を攪拌する場合は、スターラー機能付き恒温セルホルダーを用いて 500~1500 rpm(溶液が飛び散らない程度)で溶液を撹拌する。循環恒温槽をセルホルダーにつなぎ、温度を37℃一定に保つ。測定間隔は全体の反応時間を考慮して設定する。測定結果の一例を図2a に示す。
シーディング反応も in situ で反応を追跡することができる(図2b)。シードを溶液中に加えるとすぐに反応が始まるので手際よく作業をする必要がある。蛍光セルにシード溶液以外の溶液を入れた状態で光度計セルホルダーにセルをセットする。この時にベースラインを測定しておくとよい。この状態でシードを添加し、素早く蓋をして測定を開始する。
C)アミロイド線維形成反応の in situ 測定(蛍光マイクロプレートリーダー)
蛍光プレートリーダーを使用することで様々な溶液条件(pH、塩濃度、添加物の有無など)の実験を一度に少量のサンプル溶液でおこなうことができる。
反応溶液組成
サンプル溶液:25 μM β2m、100 mM NaCl、10 mM HCl、5 μM ThT(1ウェルあたり約 200 μL)
装置
超音波照射装置 ELESTEIN(エレコン科学):温度37℃、超音波照射サイクル1分照射9分休み
測定方法
蛍光プレートリーダー MTP-810(コロナ電気):多点モード(9点)、励起波長 450 nm、蛍光波長 490 nm、半値幅 5 nm、フォトマル高圧 高、フラッシュ回数20回
10分に1回プレートを超音波照射装置から取り出し測定する。
C-1)溶液調製
マイクロプレート(ハーフウェル)の場合は1ウェルに約 200 μL 加え、気泡が混入しないように慎重にマイクロプレート用シールで蓋をする(通常の96ウェルプレートは1ウェル 400 μL であるが、本プロトコルでは液量を節約するため穴径が半分のハーフウェルを使用している)。プレートリーダーの機種や設定によって蛍光測定は上方検出と下方検出に分かれるが、上方検出の場合は気泡の混入や結露が蛍光測定に影響を与える場合があるので気泡がなるべく入らないように注意する。著者が主に使用しているグライナーの圧着式フィルム(670670)は貼り付け強度が高く反応への影響が少ないため、問題なく上方検出による蛍光測定ができる。サンプル溶液を隣のウェルに混入させない程度多めに入れ、少しあふれさせながらシールすると気泡が入りにくい。本稿で使用しているプレートシールは圧着式であるため、定規や爪等でしっかり圧着させる。また、測定中に空気の膨張でシールが外れないようにウェル外の領域に注射針等で数カ所穴をあけておく。
C-2)ThT 蛍光測定
マイクロプレートリーダーには撹拌機能が付いたものが多いが、強度は弱く反応時間がかかる。ウェル内にビーズ等を入れることにより攪拌を促進することができる(文献18)。ビーズは素材やサイズによって反応への影響が出やすいので実験前に十分検討する必要がある。詳細は文献18等を参考にしていただきたい。ここでは短時間で実験をおこなうために水槽型の超音波照射装置 ELESTEIN を用いて溶液を撹拌する例を紹介する(文献19)。マイクロプレートを ELESTEIN の水槽水面に固定し、超音波を照射する。超音波照射(1分)後の待ち時間(9分)の間にプレートリーダーで蛍光を測定する。マイクロプレートリーダー MTP-810 はウェル内数カ所の蛍光値を平均化できる多点モードがある。96ウェルすべてを測定するには5分程度要する。測定例を図2c に示す。
シーディング反応では、シードを添加したサンプル溶液を素早くウェルに注入し、フィルムを貼って測定を開始する(図2d)。シードを加えないサンプルのウェルを作り、ベースラインとして同時に測定をしておくとよい。
D)アミロイド線維とアモルファス凝集形成反応の同時測定
ここまでアミロイド線維のみに着目し、その測定を紹介してきた。しかし、アミロイド線維原性蛋白質やペプチドはしばしばアミロイドではない不定形の凝集(アモルファス凝集)やオリゴマーを形成することがある。神経変性疾患の治療や線維構造解析のサンプル作製等にはこれらアミロイド以外の凝集形成を理解し、制御することが重要である。ここでは、蛍光光度計を用いたアミロイド線維とアモルファス凝集の同時測定方法を紹介する(文献4, 5)。ほとんどの蛍光光度計は励起光の光源に対して垂直方向に検出器が設置されているため、垂直方向の光散乱を測定することができる。光散乱は粒子サイズの大きなものが増えてくると強度が大きくなるため、簡便に蛋白質凝集量を評価することができる(なお、粒子サイズや形状を測定できる動的光散乱や静的光散乱とは異なる。これらはいずれも特別な装置が必要となる)。光散乱と ThT 蛍光が同時に測定できれば、アミロイド線維とアモルファス凝集を同時に検出することが可能である。また、異なる蛍光プローブを用いることでそれぞれのプローブに対応した反応を同時に測定できる。実際に、蛍光光度計を用いることで、ThT の励起波長 445 nm に対して 445–485 nm の領域を含む波長領域の蛍光スペクトルを測定することで、光散乱と ThT 蛍光を同時測定できる。
ここでは、さらに、8-Anilinonaphthalene-1-sulfonic acid(ANS)を用いた2波長測定について紹介する。ANS は蛋白質フォールディングの研究で使用されてきた疎水性プローブであるが、蛋白質凝集の検出にも用いることができる。蛋白質が凝集すると一般的に疎水性コアが露出するため、ANS が結合し 380 nm 付近の励起光に対して 485 nm 付近の蛍光を発する(蛍光極大波長は若干ブルーシフトする)。ANS と ThT は、励起波長は大きく異なるが、蛍光波長が近いため、異なる励起波長に対し一つの蛍光波長を追跡することで両者を同時に測定できる。
反応溶液組成
サンプル溶液:25 μM β2m、300 mM NaCl、10 mM HCl、5 μM ThT、50 μM ANS(液量 1.5 mL)
装置
蛍光光度計 F-4500(日立):温度37℃(循環恒温槽)、スターラー撹拌速度 800 rpm
測定方法
蛍光光度計 F-4500(日立):波長スキャンモード、励起波長 330–450 nm、蛍光波長 485 nm、励起スリット 5 nm、蛍光スリット 5 nm、フォトマル電圧 700 V、測定間隔5分毎
測定は自動でおこなう。
D-1)溶液調製
サンプル溶液 1.5 mL を光路長 1 cm の蛍光ガラスセルに入れる。必要に応じて、攪拌子を入れる。溶液が蒸発しないようにセル蓋をしてパラフィルムで固定する。
D-2)蛍光測定
蛍光セルをセルホルダーにセットし、スペクトル測定モードで測定をおこなう。測定スペクトルは蛍光スペクトルではなく励起スペクトルを測定する。励起波長は 330–450 nm、蛍光波長は 485 nm にセットする。測定速度と測定間隔は全体の反応時間に対して適当に決める。
ThT 蛍光と光散乱の同時測定の場合は蛍光スペクトルモードに設定し、励起波長を 445 nm、蛍光波長を 430–550 nm に設定する。溶液の攪拌が必要な場合は、目的の回転速度に設定して攪拌子で溶液を攪拌する(図3では、800 rpm)。
測定したスペクトル(図3a)の ThT(445 nm)と ANS(375 nm)に対応する波長を取り出し、時間に対してプロットする(図3b)。光散乱を測定した場合は ThT(485 nm)、光散乱(445 nm)をプロットする。条件によってはアモルファス凝集とアミロイド線維が時間差でできてくる過程が観察できる。
光散乱を測定した場合にしばしば起こるが、強度が非常に高く測定限界に達してしまったときは適宜波長をずらしてピークの裾の時間変化がみられる波長でプロットする。ThT 蛍光の影響を受けにくい短波長側の裾をプロットするとよい。
工夫とコツ
サンプル溶液調製の注意点
アミロイド線維形成反応は蛋白質濃度や溶質濃度に非常に敏感であり、構造多型も多く複雑な反応であるため再現性の良い実験をおこなうためには注意点がいくつかある。サンプル調製は基本的には試薬を目的の条件になるように混合するだけであるが、手順によっては予期せぬ反応がおこる。そういった反応が重要な発見につながることもあるが、やはり、きれいで再現性のあるデータを取得するためには細心の注意を払うべきである。
蛋白質のストック溶液の準備においては、高濃度のストック溶液や等電点付近のバッファーでの溶解は凝集形成を引き起こす可能性がある。筆者は標準的な実験条件(数十 μM 程度)の際は、常に 100 μM 程度になるように蛋白質を溶かしている。
また、溶液の混合順序によっては局所濃度の変化により予期せぬ反応が引き起こされるため混合順序は常に同じにしておく。筆者は蛋白質溶液以外の溶液を先に混合し最後に蛋白質溶液を添加し、ピペッティングにより静かに溶液を混合している。 pH の急激な変化も実験結果を変化させてしまうことがある。溶液を混合する際には pH 変化を考慮して調製するとよい。筆者は、すべてのストック溶液を目的の pH のバッファー等で調製している。今回の酸性 β2m の場合はすべて 10 mM HCl を含むストック溶液を準備した。蛋白質の溶解により若干の pH 変動が起こりうるが、この程度の濃度範囲では影響はなく、むしろ pH 調整のための HCl の添加は塩濃度を変化させてしまう(文献20)。
ThT について(誤ったデータ解釈をしないための注意点)
ThT の濃度に関しては多くの論文が 5–25 μM 程度を採用している。通常の希薄な蛋白質濃度(数 μM~数十 μM)であれば、アミロイド線維量に比例して ThT 蛍光を発する(文献21)。著しく濃い蛋白質濃度での測定では ThT 濃度にも注意が必要であるが、場合によっては反応への影響(後述)もあるため注意が必要である。また、大過剰の ThT が存在すると自己消光により蛍光強度が減少する可能性が示唆されている(文献22)。これらのことから、ThT 濃度は 25 μM 以下にするのがよいと著者は考える。ただし、イントロダクションで既述したように、ThT 蛍光強度はアミロイド線維の絶対量を示すものではなく、蛋白質の種類や溶液条件に依存する。
酸性条件では ThT 蛍光強度は低下するが、本稿で示すように in situ 測定は可能である。その一方で、アルカリ条件下(pH 9以上)では時間の経過と共に ThT のヒドロキシル化が進行するため、経時的な ThT 蛍光の減少がみられる(文献16, 17)。実際にアミロイド線維が脱重合しているかどうかは、ThT 蛍光の ex situ 測定や他の測定手法などを組み合わせて総合的に判断する必要がある。
本プロトコルでは、ThT 蛍光の ex situ 測定における ThT 溶液は pH 8.5 に調整している(文献11)。酸性条件下で形成されたアミロイド線維が pH の変化により脱重合する可能性がある(時間変化モードで脱重合の有無を確認できる)。脱重合により ThT 蛍光がうまく測定できない場合は、サンプルと同じ溶媒組成の ThT 溶液を用いるとよい。
溶液の撹拌方法
アミロイド線維の自発形成に時間を要する場合、溶液を撹拌することで反応が促進される。撹拌方法はスターラーによる撹拌、振とう器による撹拌など様々なものがある。反応の早い遅いはあるが、特別な装置である必要はなく、培養シェーカーやボルテックスミキサーなど身近にあるものを代用してもよい。撹拌の中でも超音波の音圧キャビテーションや溶液のずりによるせん断応力を利用したものは非常によく線維形成を促進できる(文献12, 23–26)。スターラーやビーズをサンプルに入れる場合はそれらの形状や素材にも強く影響される(文献18)。こういったことから溶液の撹拌によるアミロイド線維形成の促進は単に分子衝突頻度を上げているだけではないため、それぞれの撹拌の特徴を認識して使用するとよい。また、溶液を均質化する目的としての撹拌においても自発線維形成の促進効果が出てしまうため、それを念頭に置いて実験をおこなうとよい。
in situ 測定と ex situ 測定の比較
ex situ 蛍光測定によるアミロイド線維形成のモニタリングでは、サンプリングの際の測定誤差が生じやすい(サンプル溶液の不均一性によるところが大きい)。同じサンプルを継続的に観察する in situ 測定では、都度のサンプリングに起因する誤差が抑制される。一方で、上述のように in situ 測定では ThT 蛍光測定の障害となる化合物の存在(文献15)や酸性溶液で蛍光強度が低くなるなどの影響を受ける。また、ThT がアミロイド線維形成を変化(促進または抑制)させてしまう場合もあるため、注意が必要である(文献14)(酸変性 β2m の場合は、ThT 結合によるアミロイド線維形成過程の違いはみられない(文献21))。したがって、データ解釈を誤らないためには、ThT 蛍光の ex situ 測定を組み合わせて総合的に判断する必要がある。
反応モデルを用いたデータのフィッティング
アミロイド線維の自発形成実験では、測定開始直後は蛍光強度が上昇しない期間がある。この期間をラグタイム(潜伏期間)と呼び、反応の速さや抑制機構などを議論する際にしばしば用いられる。ラグタイムの明確な定義はなく、反応モデルにフィッティングして得られたパラメータを用いる場合や生データからある閾値に達する時間を読み取る場合などがある。
アミロイド線維形成反応のモデルは様々なモデルが提唱されている。最も簡易的かつ有用な反応モデルは Finke-Watzky の2ステップモデルで、可溶性のモノマー分子がアミロイド線維核構造へ変換する過程(M → F)とアミロイド線維へモノマー分子が付加する過程(F + M → 2F)の2つのステップからなる(文献27)。それぞれの反応速度定数を \(k_{1}\)、\(k_{2}\) としてアミロイド線維形成の時間変化を記述すると以下のようになる。
\[\begin{align*} \dfrac{\mathrm{dF}}{\mathrm{d}t}\ &= k_{1}\mathrm{M} + k_{2}\mathrm{MF} \\ \mathrm{M}_{0} &= \mathrm{M} + \mathrm{F} \end{align*}\]この式を解析的に解くと、
\[\mathrm{F} = \dfrac{\mathrm{M}_{0} \left( 1 - e^{-(k_{1} + k_{2}\mathrm{M}_{0}) t} \right)}{1 + \dfrac{k_{2}}{k_{1}}\mathrm{M}_{0}e^{-(k_{1} + k_{2}\mathrm{M}_{0})t}}\]となり、ThT 蛍光強度の経時変化をよく再現している(\(\mathrm{M}_{0}\) は蛋白質のモノマー換算濃度)。アミロイド線維形成のモデルは二次核形成などを考慮したより複雑なモデル等様々なモデルが提唱されている(文献28)。
実験の再現性を確認するために繰り返し実験をおこなう場合、データの取り扱いには注意を要する。図4では、5回の繰り返し実験で核形成速度にバラツキが生じた場合を模擬している(線維伸長速度は同じ値で固定)。すべてのデータをまとめて反応モデルにフィッティングすると、得られる伸長カーブはなだらかになり、それぞれの測定データから得られる伸長速度より遅い値になってしまう。このような問題を避けるためには、それぞれの測定データで反応モデルにあてはめる必要がある。その一方で、異なる蛋白質濃度で得られるアミロイド線維形成データをより複雑なモデルにあてはめてグローバルパラメータを得たい場合など、状況に応じて適切にデータ解析する必要がある。
あとがき
本稿では ThT による β2m アミロイド線維形成反応の実験方法について述べてきた。蛋白質や溶液条件が異なっていても基本的には同様の条件で測定が可能であり、蛍光検出のための機器さえあれば容易にできる実験であるが、凝集物の検出であることや複雑な反応機構のためにきれいなデータや再現性のよいデータを得るために経験やコツを積んでいただきたい。また、ThT 測定はアミロイド線維検出のゴールドスタンダードであるが、絶対ではない。ThT 蛍光は基本的にはアミロイド線維量を反映するが、ThT 蛍光が測定できるかどうかはアミロイド線維表面構造やアミロイドコア領域の大きさ、溶液条件に強く依存し、中には ThT 蛍光を示さないアミロイド線維も存在する。これとは逆に、結合によって ThT 蛍光が増大する蛋白質も存在するため、注意を要する(文献29, 30)。得られた結果を正しく判断するには、円二色性スペクトル(萩原義久, 蛋白質科学会アーカイブ, 1, e002 (2008))などの分光法や、透過型電子顕微鏡(TEM)や原子間力顕微鏡(AFM)といった顕微鏡法による追加の情報を提示するのが好ましい。また、ThTは全反射蛍光顕微鏡によるアミロイド線維形成の直接観察(文献31)においても蛍光プローブとして使用されている(伴匡人ら, 蛋白質科学会アーカイブ, 1, e042 (2008))。
文献
- Chiti, F., Dobson, C.M., Annu. Rev. Biochem., 86, 27–68 (2017)
- Eisenberg, D., Jucker, M., Cell, 148, 1188–1203 (2012)
- Iadanza, M.G., Jackson, M.P., et al., Nat. Rev. Mol. Cell Biol., 19, 755–773 (2018)
- Yoshimura, Y., Lin, Y., et al., Proc. Natl. Acad. Sci. U. S. A., 109, 14446–14451 (2012)
- Adachi, M., So, M., et al., J. Biol. Chem., 290, 18134–18145 (2015)
- So, M., Hall, D., et al., Curr. Opin. Struct. Biol., 36, 32–39 (2016)
- Naiki, H., Higuchi, K., et al., Anal. Biochem., 177, 244–249 (1989)
- Xue, C., Lin, T.Y., et al., R. Soc. Open Sci., 4, 160696 (2017)
- Biancalana, M., Koide, S., Biochim. Biophys. Acta, 1804, 1405–1412 (2010)
- Namioka, S., Yoshida, N., et al., Biochemistry, 59, 2782–2787 (2020)
- LeVine, H., Quantification of β-sheet amyloid fibril structures with thioflavin T. In Methods Enzymol, 309, 274–284, Academic Press (1999)
- Ohhashi, Y., Kihara, M., et al., J. Biol. Chem., 280, 32843–32848 (2005)
- Chatani, E., Lee, Y.-H., et al., Proc. Natl. Acad. Sci. U. S. A., 106, 11119–11124 (2009)
- D’Amico, M., Di Carlo, M.G., et al., J. Phys. Chem. Lett., 3, 1596–1601 (2012)
- Hudson, S.A., Ecroyd, H., et al., FEBS J., 276, 5960–5972 (2009)
- Hackl, E.V., Darkwah, J., et al., Eur. Biophys. J., 44, 249–261 (2015)
- Foderà, V., Groenning, M., et al., J. Phys. Chem. B, 112, 15174–15181 (2008)
- Abdolvahabi, A., Shi, Y., et al., Biophys. J., 112, 250–264 (2017)
- So, M., Yagi, H., et al., J. Mol. Biol., 412, 568–577 (2011)
- Goto, Y., Fink, A.L., J. Mol. Biol., 214, 803–805 (1990)
- Xue, W.-F., Homans, S.W., et al., Proc. Natl. Acad. Sci. U. S. A., 105, 8926–8931 (2008)
- Younan, N.D., Viles, J.H., Biochemistry, 54, 4297–4306 (2015)
- Yoshimura, Y., So, M., et al., Jpn. J. Appl. Phys., 52, 07HA01 (2013)
- Nakajima, K., Ogi, H., et al., Sci. Rep., 6, 22015 (2016)
- Morimoto, D., Walinda, E., et al., Anal. Chem., 89, 7286–7290 (2017)
- Dobson, J., Kumar, A., et al., Proc. Natl. Acad. Sci. U. S. A., 114, 4673–4678 (2017)
- Watzky, M.A., Finke, R.G., J. Am. Chem. Soc., 119, 10382–10400 (1997)
- Dear, A.J., Michaels, T.C.T., et al., Proceedings of the National Academy of Sciences, 117, 12087–12094 (2020)
- De Ferrari, G.V., Mallender, W.D., et al., J. Biol. Chem., 276, 23282-23287 (2001)
- Groenning, M., Olsen, L., et al., J. Struct. Biol., 158, 358–369 (2007)
- Ban, T., Yamaguchi, K., et al., Acc. Chem. Res., 39, 663–670 (2006)
謝辞
本記事は、著者が大阪大学蛋白質研究所・後藤祐児教授(現所属、大阪大学国際医工情報センター)の指導の下で遂行した研究内容をまとめたものです。研究遂行にあたり、内木宏延教授(福井大学)、荻博次教授(大阪大学)、後藤研究室(大阪大学蛋白質研究所 蛋白質構造形成研究室)の構成員の皆様をはじめとする多くの方々にご協力をいただきました。
最後に、2020年3月に定年退職を迎えられた後藤先生に於かれましては、長年にわたり無事勤めあげられましたことを心よりお祝い申し上げます。
修正履歴
「工夫とコツ」の「溶液の撹拌方法」の「文献12, 23–16」を「文献12, 23–26」に訂正
<a href=”/archives/files/articles/.pdf”
修正前の PDF </a>


