概要
本稿では比較的安価で入手可能なディスポーザブル式のポリプロピレン製カルチャーバッグを利用して、2.5 L~5 L規模の実験室レベルでの培養により、メタノールを発現誘導剤とした組換え蛋白質の分泌生産を行う際の手順について紹介する。通常のピキア酵母を宿主とする小スケールでの発現実験に用いられる一般的な培地を使用することができるため、準備にかかる時間や実験に必要な日数等はバッフル付フラスコを利用した場合と同じく、発現に使用する組換えピキア酵母株のコロニーが得られてから通常一週間程度である。
イントロダクション
メタノール資化性酵母の一種であるPichia pastoris(以下、ピキア酵母)はアルコールオキシダーゼ1(AOX1)プロモーターに代表される強力なプロモーターに由来する発現生産レベルの高さや大腸菌発現系では正常なフォールディングが起こりにくく生物活性を有する可溶性蛋白質の大量生産が困難なものにも適用可能な場合があることなどの理由から、近年各種の組換え蛋白質の発現生産用の宿主として多用されるようになってきている。とりわけパンや酒類の製造に用いられる酵母である出芽酵母Saccharomyces cerevisiae(S. cerevisiae由来のα-ファクターのプレプロ配列などの高効率の分泌用シグナル配列が利用可能であり、自らの分泌性蛋白質の生産量が少ないことから、S. cerevisiaeの場合 (1) と同様に学術的にあるいは産業上有用な異種蛋白質の分泌生産における発現用宿主として使用されている。また、最近ではヒト由来の糖タンパク質の発現生産に用いる場合に起こりうる修飾糖鎖構造の相違に関する欠点を克服するべく各種の “glycoengineered strains” の開発も進み、ヒトIgG抗体を始めとする各種のバイオ医薬用組換え蛋白質の発現生産用の宿主としても注目を集めるようになってきた (2)。
ピキア酵母はメタノールを唯一の炭素源として含む培養条件下ではメタノール資化性を示す。そのメタノール代謝の第一段階は分子状酸素を利用したメタノールの酸化によるホルムアルデヒドへの変換である。しかしながら、この変換過程に関わる酵素であるアルコールオキシダーゼと分子状酸素の親和性は必ずしも高くなく、それを補うために多量のアルコールオキシダーゼが必要となる。ピキア酵母での組換え蛋白質の大量発現生産を行う際に頻用されるメタノールを用いた誘導的発現の手法は、このアルコールオキシダーゼ遺伝子を制御するプロモーター遺伝子の一つであるAOX1プロモーターのメタノールを唯一の炭素源とした条件下での活性の高さを利用したものである (3)。
しかし上述の通り、代謝の第一段階のメタノール酸化には大量の酸素が必要であるため、メタノールを発現用誘導剤として用いる場合、充分な通気量を確保することは極めて重要であり、発現誘導時に通気が不十分な場合には目的とする組換え蛋白質の生産量が大きく低下することが予想される。この点において強制通気型の培養方法はフラスコを用いる自然換気型の培養方法と比較して優位性がある。
ピキア酵母の形質転換体では同一培養条件にも関わらずしばしばシングルコロニー間で発現レベルに有意な差が認められる。試験管や小容量のバッフル付フラスコを用いて行ったスクリーニング試験により選択された最高の発現レベルを示す形質転換体クローンのシングルコロニーを用いて培養スケールの増大化を図る場合には、通常バッフル付フラスコの容量のより大きなものを用いて培養量を稼ぐか、ジャーファメンター装置を利用した培養への移行が考えられる。これらのうちバッフル付フラスコを用いる場合には比較的実験を開始する上で必要な初期費用は少なくて済むが、小規模な実験室で用いられている回転振とう型の恒温培養装置に架かるものは大きくても3 L容量のものが2本あるいは5 L容量のものを1本使用するのが限度であろう。インビトロジェン社のマニュアルによれば、充分な通気量を確保する観点から「ピキア酵母を用いた組換え蛋白質の発現実験において培養量はフラスコ容量の10–30%を決して超えないこと」との旨の指示がある (3) ので、一度に可能な培養量は最大限に見積もっても1.8 Lとなる。一方、市販のジャーファメンターを用いるpH電極や溶存酸素(DO)電極等を備えた実験室用の卓上型培養装置では、通気量は充分に確保され、培養条件の精密な設定が可能である。量的にも例えば10 L容量の培養槽を用いれば最大6.5 L程度の培養が可能である (4) が、少なくとも数百万円単位の初期費用と装置本体ならびに各種付属機器類の比較的煩雑かつ継続的なメンテナンスが不可欠となる。また、既存のオートクレーブ装置で滅菌可能な1~2 L容量程度の培養槽で問題ない場合であれば導入コストは150万円程度で済む可能性があるが、DO、pHセンサー、制御システム、通気システム等が一体となったオールイン型ファーメンターの場合には、1~2 L容量クラスのものでも、概ね200万円以上の初期費用が必要となるようである (4)。ここでは両者の利点をそれぞれ部分的に兼ね備えたポリプロピレン製のディスポーザブルカルチャーバッグを利用した2.5 L~5 Lスケールでの培養の実際について記述する。
装置・器具・試薬
装置
- 振とう型恒温エアインキュベーター:30℃以下に温度調節可能で、カルチャーバッグに給排気用のチューブを差し入れることが可能なもの(例、タイテック(株)製バイオシェーカーBR-32FL)
- 小型ダイアフラム式給気用ポンプ(チューブ接続用継ぎ手付属):培養スケールに応じて培養液1 L当り1 L/minの送気能力を有するもの(例、アルバック(株)製DAP-12S)
- 簡易型空気流量計(例、コフロック(株)製RK1710)
- ステンレス製バット:振とう時に使用する容量のカルチャーバッグを安定に支持可能なサイズのもの(例、藤森工業(株)製バックホルダー10)
- 遠心分離機:前培養からの種菌体の回収ならびに本培養後の培養上清の回収に使用可能なもの(各社)
- オートクレーブ:使用するサイズのカルチャーバッグが入る大きさのもの(各社)
- クリーンベンチ(各社)
器具
- バッフル付三角フラスコ:BMGY培地での前培養用(例、各社、ガラス製3 L)
- フラスコ用培養栓:振とう培養に適した通気性のよいもの(例、信越ポリマー(株)製、C-65)
- ディスポーザブルカルチャーバッグ:ポリプロピレン製バッグ、給気用多孔チューブ、給排気、培地成分添加ならびに培養液サンプリングを行なうためのノズルキャップ等がセットになっているもの(例、藤森工業(株)製、CB-5(~2.5 L培養用)またはCB-10(~5 L培養用))
- シリコンチューブ:構成装置間の接続に使用(オートクレーブ滅菌可能で、ある程度肉厚のあるもの、例、内径6 mm , 外径9 mm)
- チューブクランプ(オートクレーブ滅菌可能で、使用するシリコンチューブに適合したサイズのもの、例、(株)アイシス製、HR340MB)
- エアベントフィルター(孔径:0.20 μm、オートクレーブ滅菌可能なもの、例、アドバンテック(株)製、LABODISK-50JP)
- ガス洗浄ビン:活性炭懸濁液を入れ排気の脱臭に使用(例、アズワン(株)製、容量2 L広口タイプ、三角フラスコに穴あきゴム栓とガラス管を適宜組み合わせて自作も可能)
- 排気受け用最終トラップビン:ガス洗浄ビンからの水分を含んだ排気を受け止めるために使用
試薬
- BMGY培地*1(組成:2%バクトペプトン、1%イーストエキストラクト、1%グリセリン、1.34%アミノ酸不含イーストニトロゲンベース、100 mMリン酸カリウム緩衝液(pH6.0)、4×10−5%D-ビオチン)
- BMMY培地*1(組成:BMGY培地のグリセリンのかわりに0.5%メタノールを含むもの)
- 活性炭:排気脱臭用(例、(株)ユー・イー・エス、KD-PW100)
*1調製方法の詳細については蛋白質科学会アーカイブ#018 (5) やインビトロジェン社のマニュアル (3) に詳述されているため本稿では省略する。
実験の手順
準備
- 目的蛋白質に関するピキア酵母形質転換体高発現クローンを選択する。
- 発現に用いるシングルコロニーを選択用培地プレート上で増殖させる。
- 必要量のBMGY培地およびBMMY培地作成用の各構成成分の溶液を調製する。
前培養(非発現誘導条件下での菌体量の増大化のための培養)
- 第1日 発現用のピキア酵母のシングルコロニーをBMGY培地に植菌する。
- 第2日 BMGY培地中で増殖した菌体を回収する。
本培養(発現誘導条件下での組換え蛋白質の分泌生産のための培養)
- 第2日 カルチャーバッグ中でBMMY培地を調合する。前培養で増殖後、回収した菌体をカルチャーバッグ内のBMMY培地に植菌し、培養を開始する。
- 第3日~第6日 24時間おきにメタノールを添加して培養を継続し、発現を誘導する。
- 第7日以降 培養液を遠心分離し、培養上清から大部分の菌体を分離後、フィルターろ過により上清試料中の菌体を完全に除去する。限外ろ過デバイスを用いた上清試料の濃縮と精製のためのバッファー置換を行なう。
実験の詳細
準備
一般的なピキア酵母の形質転換法ならびに発現クローンのチェック法に関しては前述した蛋白質科学会アーカイブ#018 (5) ならびにインビトロジェン社のマニュアル (3) に詳しく記述されているため本稿では省略するが、筆者は発現用ベクターとしてインビトロジェン社より市販されているpPICZαAベクターを用い、形質転換体の選択用培地プレートとしてゼオシン(100 μg/mL~)ならびに2%アガロースを含むYPD培地プレートを使用している。以下は一例としてpPICZαAベクター中のS. cerevisiae由来のα-ファクタープレプロ配列のKex2切断配列部位の直下にSte13切断配列を介さずに酵母用にコドンを最適化したヒトFasリガンド細胞外ドメイン誘導体の人工遺伝子を接続して2.5 Lレベルでの分泌発現生産を行った際の実験操作に基づいて記述する (6)。
前培養
第1日 あらかじめ適切な選択用培地プレート上で増殖させておいた発現に用いるピキア酵母の形質転換体のシングルコロニー(直径3 mmのニクロム線ループを用いて数ループ分)を側面に3箇所のバッフルが付いた3 L容量のガラス製三角フラスコ中に入れた500 mLのBMGY培地に植菌する。これを29.5℃に設定したエアインキュベーターの架台に固定し、回転速度300 rpmで20時間の振とう培養を行ない、菌体を増殖させる。
第2日 上述の前培養液を滅菌済の50 mLコニカルチューブ8本に25 mLずつ分注する。室温の遠心分離機を用いて5800Gの条件で2分間の遠心を行ない、菌体をペレット化する。上清はデカンテーションにより注意深く除く。この操作を繰返して全ての菌体をペレット状に集める。得られた各チューブ内の菌体ペレットにオートクレーブ滅菌済の10 mL程度の滅菌水を加えて懸濁し、再度室温、5800G、2分間の遠心分離を行ない、上清をデカンテーションにより注意深く除く。
カルチャーバッグに付属している取扱説明書 (7) に記載の手順に従って、ポリプロピレン製バッグへのノズルキャップならびにチューブの接続を行なうと共に必要な箇所へのチューブクランプの設置、アルミホイルによるエアベントフィルターや各チューブ先端部分の保護などのオートクレーブ滅菌処理のための準備を行なう。滅菌済みのカルチャーバッグをクリーンベンチ内に移し、バッグ内であらかじめ準備しておいたBMMY培地の構成成分を調合する。滅菌水で洗浄後の菌体ペレットをチューブ当り10 mL程度のBMMY培地に懸濁後、全量を2.5 LのBMMY培地に植菌し、給排気ならびにサンプリング用のチューブを接続したノズルキャップを閉める。
本培養
第2日 植菌済のBMMY培地が入ったカルチャーバッグをエアインキュベーターの振とう台に固定したステンレス製バット内に設置し、給気用ポンプの空気吐出口からのシリコンチューブをカルチャーバッグに付属させたエアベントフィルターに接続する。また、排気の脱臭の目的で、カルチャーバッグからの排気用シリコンチューブを小さじ2~3杯の活性炭を懸濁した1.5 L程度の水の入ったガス洗浄ビンの給気口に接続する。全体的な接続経路ならびにカルチャーバッグに関する物質の出入りについての概略図を図1に示す。オートクレーブ滅菌処理の際にエアベントフィルターとカルチャーバッグのノズルキャップとの間で閉じておいたチューブクランプを開放し、給気用ポンプの電源を入れカルチャーバッグ内への通気を開始する。振とう速度を適宜調整し、培養を続ける。図2に実際の培養中の様子を写真で示す。
第3日~第6日 24時間おきに給気ならびに振とうを停止し、給気用ポンプならびにガス洗浄ビンからカルチャーバッグを切り離す。クリーンベンチ内でメタノールを最終濃度0.5%になるように添加すると共に、必要に応じて滅菌済ピペットを用いてSDS-PAGE分析等による目的蛋白質の発現量をチェックするためのサンプリングを行なう。図3に培養上清試料のSDS-PAGE分析により、同一の培地を用いて3 L容量のバッフル付フラスコ内で500 mLのBMMY培地を用いて行なった場合との発現レベルの比較を行なった例を示す。
第7日以降 培養を終了し、カルチャーバッグ内の培養液をポリカーボネート製遠心分離用ボトルに均等に分注する。2~4℃に設定した冷却遠心分離機を用いて遠心(例、5500 rpm, 20分間、使用する機器によって異なる)を行い上清と菌体を分離する。目的の蛋白質を含む培養上清を、滅菌済のピペット等を用いて、できる限り沈殿した菌体を巻き込まないように注意しながら滅菌済のポリプロピレン製ボトル等に移す。さらに完全に菌体を除去する目的で、0.20 μm口径のフィルターでろ過後、各種クロマトグラフィー等による精製のための前処理として目的蛋白質の分子量に応じた適切な分画分子量の限外ろ過膜を用いた濃縮ならびに緩衝液の交換を行なう。
工夫とコツ
ディスポーザブル式カルチャーバッグの入手
近年、微生物の培養に適したディスポーザブル式プラスチックバッグならびにそれが使用可能なバイオリアクターシステムは海外メーカー製のものも含めて複数社からの市販品が入手可能であるが、本稿で示した藤森工業(株)製のものは比較的安価で手に入り、専用の装置を必要とせず通常のフラスコ培養に用いられている小型のエアインキュベーター中での強制通気が簡便に行えるため、特に小規模な実験室レベルでのピキア酵母の培養に有用であると思われる。手持ちのカタログ記載のデータによれば、5 L容積のバッグ(最大培養量:2.5 L)ならびに10 L容積のバッグ(最大培養量:5 L)は、いずれも5枚入のものが2万円弱で入手可能である。今後他社製のものも含めてさらに使い勝手の良い改良品が開発されることが期待される。カルチャーバッグを設置するためのステンレス製バットのエアインキュベーターの振とう台への固定には耐震用ゲルマットなどを使用するのが便利である。また振とう培養時にカルチャーバッグが暴れないように、使用するエアインキュベーターに応じて適宜振とう速度を調節し、大きめのバットを用いる場合には周囲の空隙に適宜詰め物をするとよい。
BMMY培地の調製
市販カルチャーバッグに付属している取扱説明書 (7) では、YPD培地など構成成分全てをまとめてオートクレーブ処理可能な場合を想定して培地をあらかじめ当該バッグ内に入れた状態で滅菌する手順が示されているが、BMMY培地の場合には構成成分のうち、アミノ酸不含イーストニトロゲンベース、D-ビオチン、メタノールについてはフィルター滅菌処理したものを用いる必要があるため、それぞれに適した方法で個別に滅菌処理したものを準備しておき、クリーンベンチ内で別途オートクレーブ滅菌したカルチャーバッグを用いて調合するとよい。市販のカルチャーバッグは乾いた状態で供給されているため、滅菌効率を高めるために最終的な培地の組成に大きな影響を与えない範囲で滅菌水を入れ内側を十分に濡らした状態でオートクレーブ処理をした方がよいと思われる。
発現誘導時の初期菌体密度
本稿では前培養がフルグロースであると仮定し、比較のためにバッフル付フラスコを用いた場合と同一の初期菌体密度での発現誘導を行なった際の本培養について記述した(図3)。しかしながら、初期菌体密度が最終的な分泌生産量に影響を与える可能性は無視できないと考えられるため、最大収量の目的蛋白質を得るためには、この点に関する至適条件の探索も重要と思われる。
培養液のpH変化
BMGY培地ならびにBMMY培地には培養中のピキア酵母の増殖に伴う代謝産物の産生によるpHの変化を抑えるため最終濃度100 mMのリン酸カリウム緩衝液(pH 6.0)が加えられている。それでも経験上BMGY培地を用いる前培養の際には菌体量の増加が著しいため、0.5単位程のpHの酸性側へのシフトが認められる。一方BMMY培地を用いる発現誘導期には特に調整は行なわなくてもほとんどpHの変化は認められない。
サンプリングとメタノールの添加
市販カルチャーバッグのノズルキャップには内径3mmのシリコンチューブを用いたサンプリングに対応したプラスチック継手があらかじめ存在しているが、筆者はバッフル付フラスコを用いる場合と同様に、24時間ごとのメタノールの添加を兼ねて一旦培養途中のカルチャーバッグをクリーンベンチ内に移しサンプリングを行っている。その際給気用ポンプおよび排気洗浄ビンと接続されていた箇所をパラフィルムなどで保護することにより外界からの雑菌の混入の可能性を低減させている。
培養時間、培養温度と目的蛋白質の収量との関係
ピキア酵母による蛋白質の分泌発現生産においては、培養条件下での安定性との関係で最大収量が得られる培養時間や培養温度は目的蛋白質ごとに異なるものと予想される。これまでの経験上、少なくとも前者については本稿で使用したカルチャーバッグを用いる系の場合と小培養量のバッフル付フラスコを用いる場合の間で大差は無い。そのため、事前に可能な限りバッフル付フラスコを用いた実験で最適な発現条件を検討しておくことが重要であると思われる。また、筆者の経験では、同様な条件で行ったバッフル付フラスコの場合に比べて良好な生産量(数倍程度)が得られている(図3)(6)。
培養液からの菌体の除去
カルチャーバッグを用いた数Lスケールでの培養では菌体量が多いため直接に培養液を0.20 μmあるいは0.22 μm孔径等の膜を用いてろ過しようとすると目詰まりが激しく操作の続行が困難になりやすい。そのため、まず事前に冷却遠心分離機を用いて大部分の菌体を除くのがよい。その際にはできるだけ大容量の遠心用ボトルを装着可能なローターを使用できることが効率的な操作を行なう上で望ましい。この培養液中の微細粒子の除去は培養液から目的蛋白質を回収する上で面倒な工程の一つである。ストリームライン(GEヘルスケア社製)などのような培養液を直接添加できる流動相吸着体を用いた装置が使用できる環境にあればこの問題を回避できる可能性がある (8)。
分泌された目的蛋白質の濃縮と緩衝液の置換
数Lの培養液中に分泌された目的蛋白質を精製する場合には、各種のカラムクロマトグラフイーを用いた操作の前処理の目的で、培養上清を効率的に濃縮するとともに緩衝液の置換を行うことがしばしば有用である。この目的には、市販されている小型のタンジェンシャルフロー式の限外濾過用デバイス(ポール社製Minimateシリーズ、ミリポア社製Pellicon XLシリーズ、ザルトリウス社製Vivaflowシリーズなど)の利用が大変有効である。工業的製造用の大型のものは高価であるため、実験室用のペリスタポンプが使用可能な小型のカセット型デバイスを複数並列または直列に連結することで比較的安価に処理速度を上げることが可能である。
実験の安全
メタノールは引火性物質であり、急性毒性を有する劇物である。取扱いの際には火気に注意し吸入を避けること。また、ピキア酵母自体はP1レベルの宿主であるが、発現させる蛋白質の種類に応じて必要な遺伝子組換え実験関連の法律や省令に従って実験を行わなければならないことは言うまでも無い。
謝辞
本稿で示した実験系の構築に当たっては藤森工業(株)の川畠裕司様にカルチャーバッグの基本的な取扱いに関して多くの有益なご助言をいただきました。深く感謝致します。
文献
- 正木和夫, 蛋白質科学会アーカイブ, 1, e006 (2008)
- Damasceno LM et al., Appl. Microbiol. Biotechnol., 93, 31–39 (2012)
- Invitrogen社, EasySelect Pichia Expression Kit. Catalog no. K1740-01
- ㈱丸菱バイオエンジ, 卓上型培養装置 Bioneer seriesカタログ
- 櫻井一正, 蛋白質科学会アーカイブ, 1, e018 (2008)
- Muraki, M, BMC Biotechnol., 14, 19 (2014)
- 藤森工業㈱, CULTURE BAG -取り扱い説明書‐
- 村杉章, 生物工学会誌, 89, 570-83 (2011)
-
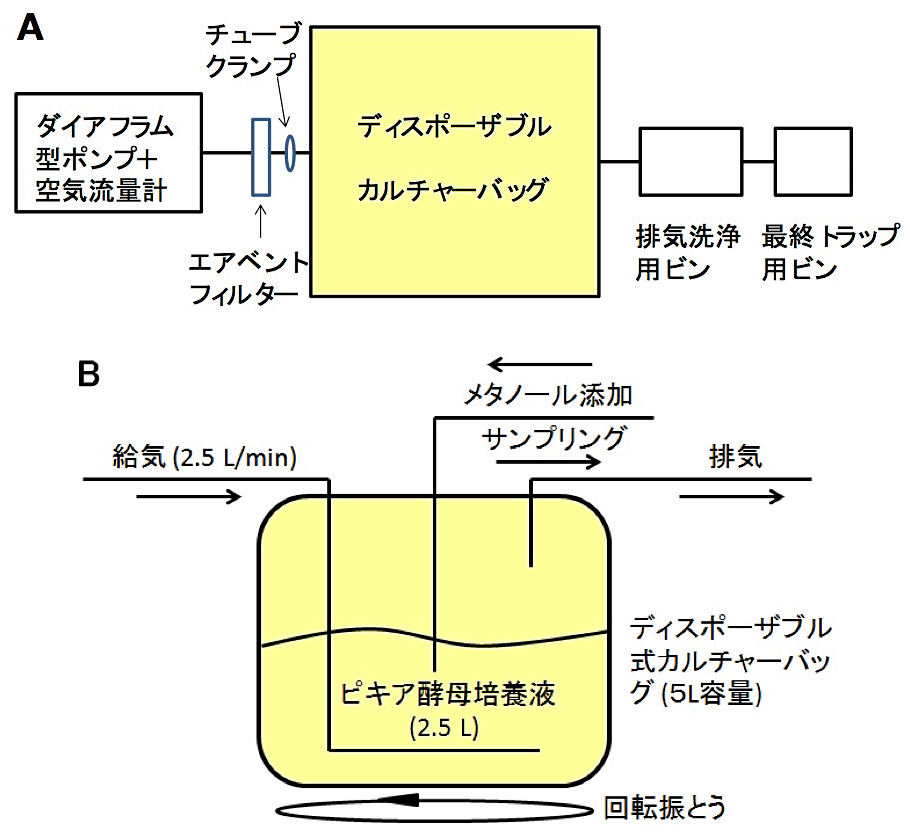
図1:ディスポーザブルカルチャーバッグを用いたピキア酵母を用いた培養の概略図
A. 全体経路図、B. カルチャーバッグのみ(文献6のFig. 1bを改変)。 -

図2:実際の培養の様子
A. エアインキュベーター内に設置したカルチャーバッグ(写真撮影のため振とうを停止し、エアインキュベーターの前扉を開放)、B. 排気洗浄用ビンと最終トラップ用ビン。 -
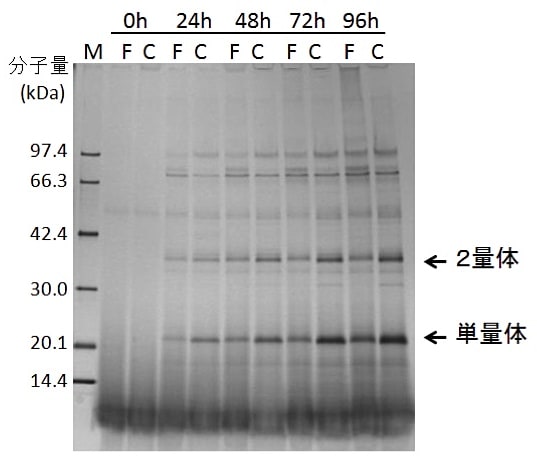
図3:各培養時間経過後におけるデイスポーザブルカルチャーバッグとバッフル付フラスコでの組換えタンパク質の分泌生産量の比較(SDS-PAGE,文献6のFig. 5aを改変)
F:500 mL BMMY培地/3 L容量ガラス製バッフル付フラスコ、C:2.5 L BMMY培地/5 L容量ポリプロピレン製カルチャーバッグ、この実験では目的のタンパク質が単量体と分子間のジスルフィド結合を形成した 2量体の両方の形態で分泌生産されている。


