天然蛋白質の対称性と幾何学的性質に基づく単一構造蛋白質超分子の設計
慶應義塾大学・理工学部- 川上了史, 蛋白質科学会アーカイブ, 10, Essay 06 (2017)
- https://www.pssj.jp/archives/essay/Es_06/Es_06.html
初めて参加しました第17回日本蛋白質科学会年会の場におきまして、若手奨励賞優秀賞をいただき、大変うれしく、また光栄に思っております。まだ、論文での発表ができていませんので、ややぼかした状態でお話せざるを得ないのは、申し訳ありませんが、せっかく機会をいただきましたので、分子設計を始めるまでの背景などを含めてご紹介できればと思います。
本会では、私は新規蛋白質超分子の設計とその超分子がさらに集積して形成される薄片形成の研究について発表しました。人工蛋白質超分子の設計に関する報告は多数あり、様々な手法が報告されています。複数の蛋白質を融合する蛋白質超分子設計(1-3)、計算科学的な相互作用の設計(4-6)、天然蛋白質超分子を参考にするペプチド設計(7)、円順列変異やドメインスワップによる高次複合化(8-10)や金属イオンを介した超分子化アプローチ(11)など、国内外の多数の報告例があります。その形状も、球状やキューブ状構造、二次元シート状(12)から、ダイヤモンド様の構造体形成例(13)が報告されており、また、一部については、特徴的な物性・機能を有する超分子の構築が報告されています(14, 15)。
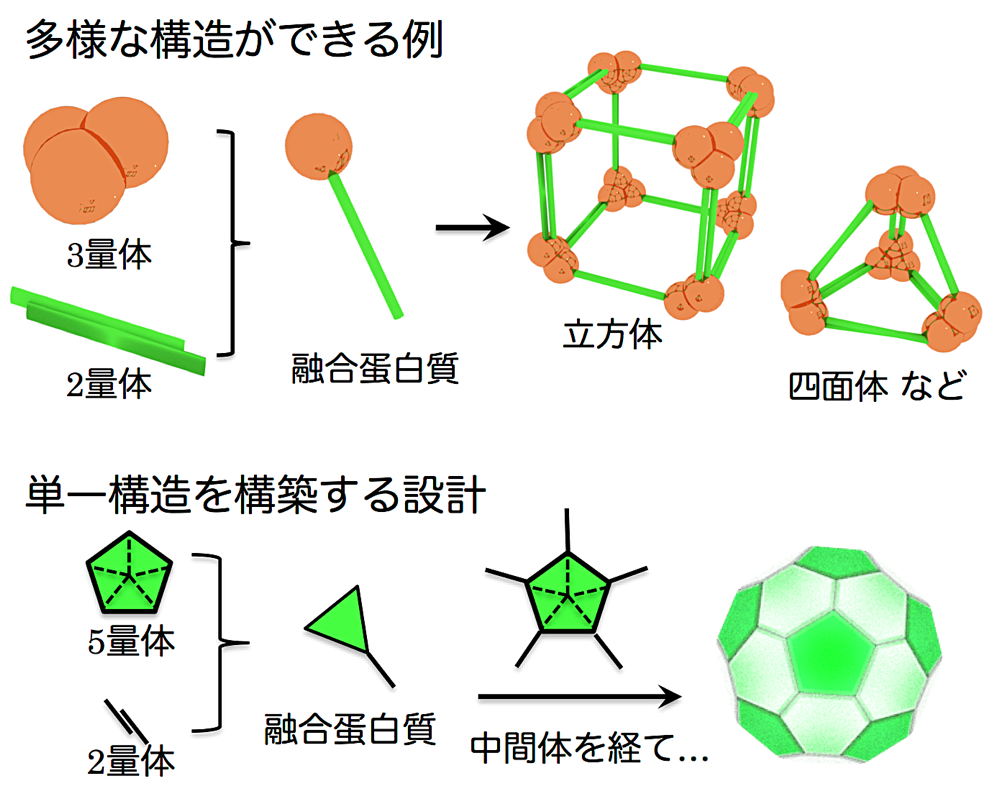
多くの論文が、この数年に集中して発表されているように、設計関連の研究の進展は目覚ましいものがあります。とりわけ、私が興味を惹かれたのは、分子対称性から構築する融合蛋白質ベースの超分子設計でした。具体例を挙げると、上記のキューブ状超分子の例(2)では、2量体形成蛋白質と3量体形成蛋白質の二種類を融合した融合蛋白質モノマーを構築しています。したがって、このモノマーには、2量体化ドメインと3量体化ドメインがあります。各ドメインでの2量体、3量体化が自発的に進行することで超分子が形成されます(図1上段)。これはちょうど、立方体の頂点に3量体が、辺の部分に2量体が配置することになるためです。この多量体形成能を利用した分子設計は、直感的に理解可能な手法であり、鋳型に用いる蛋白質にも制限は少なく見え、そのため、機能化も容易にできるメリットが期待されます。しかし、この融合蛋白質を用いた分子設計には、対称性を利用したために生じる、「同時に複数の超分子構造が形成されてしまう」という課題が残されていました。すなわち、上記の例では、立方体型構造以外にも、四面体構造などが同じメカニズムで形成されてしまうわけです。
私が今回発表したのは、この同時に多様な構造が形成される問題を克服する、単一の超分子を得るための分子設計とその実現でした。着目したのは、出来上がる超分子の形状です。上記の例でも明らかですが、対称性を利用して設計した融合蛋白質ベースの超分子形成では多面体構造を作り出すことができます。そして多面体には、オイラーの多面体定理という幾何学に関する規則があります。分子設計の世界では、多くの方がご存知かもしれませんが、
\[頂点数 - 辺数 + 面数 = 2\]という、単純な定理です。この定理を、「五角形と六角形で構成される多面体の場合」という前提条件をいれて連立方程式を解いていくと、その五角形の枚数は、六角形の枚数によらず、12枚で一定であるという特徴を導くことができます。本当にそうなるかは、サイズの異なるフラーレンなどを比較しながらご確認いただくと実感できると思います。
そこで、五角形の形状をした分子を鋳型にして融合蛋白質を設計すれば、単一の超分子構造が形成されるようになるのではないかと考えたわけです(図1下段)。結果的には、この設計は機能したようで、五角形蛋白質とそれを接続するための蛋白質を融合したところ、想定通りの分子サイズの多面体が形成されている可能性が高いという結果を得るに至りました。まだ、結晶構造レベルの解析には至っていませんが、設計どおりであれば、サッカーボール型の多面体である切頂二十面体型と推定されます。
とはいえ、上記の分子設計は幾何学の話であり、蛋白質分子がきちんと想定通りの相互作用しかしない、という保証はなく、当然凝集が生じることが考えられます。そのため、この分子設計の際には、多量体の表面電荷が大きく負に偏っている鋳型を選択し、不適切な分子間相互作用による凝集を避ける仕組みも組み込みました。これは、等電点が低いものが多い、天然の蛋白質超分子ともいえるウイルスキャプシドやフェリチンの性質から得られた着想です(16)。ただし、結果論ですので、本当にこの設計が有効であったか?ということについては未解明です。
いずれにせよ、結果として、出来上がった超分子も大きく負電荷に偏ったものになります。これを利用すれば、人工蛋白質超分子をさらに巨大な構造体に集合させる系を構築できるのではないかと考えました。そこで実際に、正電荷を有する物質を添加すると、確かに予想通りに、目視で観察できるレベルの沈殿形成を確認できました。この沈殿を顕微鏡で観察すると、興味深いことに、薄い多角形状の沈殿物を複数発見することができました。残念ながら、結晶レベルのシャープな形状ではありませんが、多角形形状であることは、沈殿物の内部で分子がまったく無秩序に並んでいるとは考えにくく、何らかの規則性があるのではないかと予想されます。これにつきましては、本会では蛋白質チップと仮称をつけて紹介いたしました。
現在では、設計した超分子単独での分子カプセル素材としての応用や、蛋白質チップ内部での触媒反応系の開発に着手しています。今後も、これらの様々な切り口から評価を継続することで、既存のマテリアルにはない蛋白質分子の性質を最大限に利用した新たな機能や価値を生み出したいと考えています。
文献
- Padilla, J. E. et al., Proc. Natl. Acad. Sci., 98, 2217–2221 (2001)
- Lai, Y. T. et al., Nat. Chem., 6, 1065–1071 (2014)
- Kobayashi, N. et al. J. Am. Chem. Soc., 137, 11285–11293 (2015)
- Hsia, Y. et al. Nature, 535, 136–139 (2016)
- Bale, J. B. et al. Science, 353, 389–394 (2016)
- King, N. P. et al. Science, 336, 1171–1174 (2012)
- Matsuura, K. et al., Angew. Chem. Int. Ed. Engl., 49, 9662–9665 (2010)
- Lin, Y. W. et al., Angew. Chem. Int. Ed. Engl., 54, 511–515 (2015)
- Qian, Z. et al., J. Mol. Biol., 393, 191–201 (2009)
- Ogihara, N. L. et al., Proc. Natl. Acad. Sci., 98, 1404–1409 (2001)
- Brodin, J. D. et al. Nat. Chem., 4, 375–382 (2012)
- Sinclair, J. C. et al. Nat. Nanotechnol., 6, 558–562 (2011)
- Sakai, F. et al., Nat. Commun., 5, 4634 (2014)
- Suzuki, Y. et al., Nature, 533, 369–373 (2016)
- Phippen, S. W. et al., Biochemistry, 55, 6811–6820 (2016)
- Michen, B. et al., J. Appl. Microbial., 109, 388–397 (2010)