概要
X線結晶構造解析において初期位相を決定する際、セレン原子による異常散乱を利用することが広く行われている。その時に必要になるのがセレノメチオニン(SeMet)標識蛋白質である。SeMet標識蛋白質の調製はメチオニン要求大腸菌株を用いることが一般的であり、蛋白質科学会アーカイブでもそのプロトコールが紹介されている(1)。筆者が2008年1月~8月のProteins: Structure, Function, and Bioinformatics 70 (1) - 72 (3)内にあるStructure Notesを調査したところ、SeMet標識蛋白質の調製法が論文中に明記されていた17報のうち、12報でメチオニン要求株を用いていた。
X線結晶解析においてSeMet標識蛋白質が必要となる時には、すでにネイティブ蛋白質の発現・精製・結晶化の方法が確立されていることが多い。そのため、ネイティブ蛋白質の発現系で用いた宿主大腸菌株(一般にメチオニン非要求株)をそのままSeMet標識蛋白質の発現に流用できれば、実験の簡便性の面でメリットがある。本稿では、メチオニン要求株を使わないSeMet標識蛋白質の調製法のうち、Doublieによるメチオニン生合成阻害剤を利用した方法(2)に筆者らの工夫を加えたプロトコールを紹介する。
装置・器具・試薬
- ネイティブ蛋白質の培養・発現に用いる材料一般
- セレノメチオニン(SeMet)
- 最少培地の材料(Na2HPO4, NaH2PO4, NaCl, Glucose, Thiamine, Biotin, Adenosine, Guanosine, Cytidine, Thyimidine, FeCl3, MgSO4, MnCl2, CaCl2)
- メチオニン生合成阻害剤(Lys, Phe, Thr, Ile, Leu, Val)
実験手順
第1日
1) 発現プラスミドによる大腸菌の形質転換および寒天培地による前培養
2) 液体培地の材料の調製
第2日
3) 植菌および本培養
4) 発現誘導およびSeMetの添加
第3日
5) 集菌
実験の詳細
ここでは、筆者が実際に用いたpET系発現プラスミド(アンピシリン耐性)とRosetta (DE3)株の組み合わせを例として実験方法を紹介する。
第1日
1) 発現プラスミドによる大腸菌の形質転換
ヒートショック法により、宿主大腸菌に発現プラスミドを導入する。適量を0.1 mg/mLアンピシリンを含むLB寒天培地にまく。
2) 液体培地の材料の調製
(1)10 x 最少培地バッファーを調製し、オートクレーブする(1 Literあたり)
| Na2HPO4 | 70 g |
| KH2PO4 | 30 g |
| NaCl | 5 g |
(2)20% (w/v) Glucoseをフィルター滅菌する
(3)最少培地栄養を調製し、オートクレーブする(1.76 Literあたり)
| Thiamine | 40 mg |
| Biotin | 40 mg |
| Adenosine | 40 mg |
| Guanosine | 40 mg |
| Cytidine | 40 mg |
| Thymidine | 40 mg |
| 10 mM FeCl3 | 0.66 mL |
| 1 M MgSO4 | 2 mL |
| 50 mM MnCl2 | 2 mL |
(4)以下のものを混ぜて最少培地を調製する(この操作は第2日でもよい)
| 10 x 最少培地バッファー(1) | 200 mL |
| 20% (w/v) Glucose(2) | 40 mL |
| 最少培地栄養(3) | 1.76 L |
| 50 mg/mLアンピシリン | 2 mL |
| 20% NH4Cl | 10 mL |
| 1 M CaCl2 | 0.2 mL |
第2日
3) 植菌および本培養
第1日1)の操作により得られた寒天培地上のコロニーに滅菌済みの150 mM NaCl(シャーレ1枚あたり約5 mL)を直接投入し、コンラージ棒で表面をなでて、コロニーを懸濁する(「工夫とコツ」欄参照)。それを第1日2)の操作で得られた最少培地に添加し、37℃で培養する。OD600が0.3になるまで待つ。
4) 発現誘導およびSeMetの添加
本培養3)によりOD600が0.3になったら、以下のものを添加する。添加する溶液はすべてあらかじめフィルター滅菌しておく。
| 100 mg/mL Lys | 2 mL |
| 10 mg/mL Phe | 20 mL |
| 50 mg/mL Thr | 4 mL |
| 10 mg/mL Ile | 10 mL |
| 10 mg/mL Leu | 10 mL |
| 10 mg/mL Val | 10 mL |
| 10 mg/mL SeMet | 12 mL |
引き続き培養し、OD600が0.7となったところで1 mM IPTG (final)を添加する。そこから先の条件(温度・時間など)は、ネイティブ蛋白質と同様。
工夫とコツ
寒天培地から直接大腸菌を液体本培養に移す
筆者らのグループでは、形質転換直後の寒天培地での培養を前培養ととらえ、そこからすべてのコロニーを液体培地で懸濁して直接本培養に移行している(文献3参照)。一般にはシングルコロニーから少量の液体培地で前培養する方法が主流であろう。その方法では前培養の時間が余計にかかるため、プラスミドを欠失した大腸菌が増加して蛋白質の発現量が低下することがある。一方、寒天培地上のすべてのコロニーを本培養に移行する方法では、時間の節約になる上、偶然ハズレのコロニーを拾ってしまうリスクを回避することができる。
本プロトコールではコロニーをサスペンドするために150 mM NaClを用いているが、それは浸透圧を調整するための最低限のモノを含ませるためである。前培養で少量のLB液体培地を用いた場合、本培養へのLB培地の持ち込みを最小限にするために、大腸菌ペレットを洗浄するステップが必要である。しかし本プロトコールの場合、LB培地由来の栄養は寒天部分に存在するため、洗浄操作なしに余分な栄養の持ち込みをほぼゼロにしたまま大腸菌のみを採取することができる。
実施例
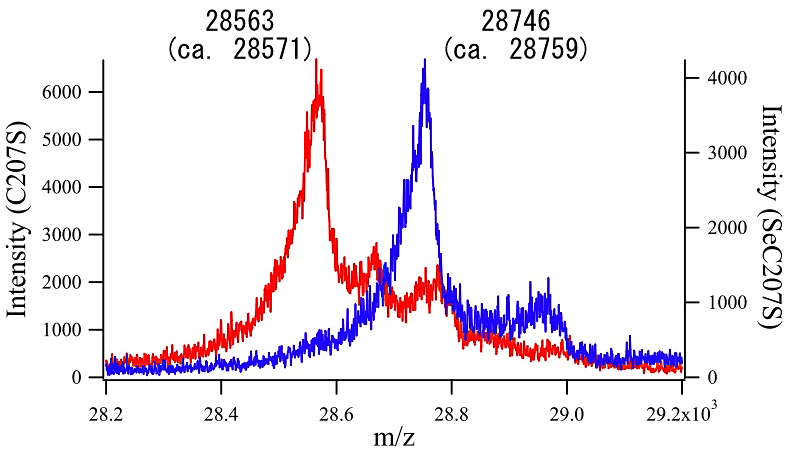
筆者らは、本プロトコールにより Aeropyrum pernix K1 由来Peroxiredoxin (Thioredoxin Peroxidase)にSeMetを導入し、MAD法により構造決定した(4)。結晶化に用いた蛋白質を質量分析に供したところ、配列上ポリペプチドあたり5箇所あるMetのうち、プロセシングされたN末端Metを除く4箇所のMetがすべてSeMetに置換されていることが確認された(図1)。また筆者らは Pyrococcus furiosus 由来Chitinase (Catalytic Domain) (5)や Pyrococcus horikoshii 由来Threonine Dehydrogenase (6)にも本プロトコールによりSeMetを導入し、それぞれMAD法およびSAD法により構造解析に成功している。
実験の安全
SeMetは毒物として規制されている。各研究機関にも内規があるはずなので、取扱いについては法令および内規を遵守されたい。
SeMetの扱いで特に注意を要するところは、秤量時に粉を撒き散らさないことである。割高になるが、少量のパッケージを購入することで秤量のリスクを避けることができる。例えばナカライテスクのセレノ-L-メチオニンには5 g入り(50,000円)と500 mg入り(9,000円)がある。500 mg入りを購入してその量を信用し、50 mLプラスティックチューブの目盛りを信用すれば、天秤やスパチュラの使用を省略し、粉の飛散を最小限にして10 mg/mL溶液を50 mL調製することができる。
文献
- 坂根勲, 蛋白質科学会アーカイブ, 1, e004 (2008)
- Doublie, S., Methods Enzymol., 276, 523-530 (1997)
- 萩原義久, 蛋白質科学会アーカイブ, 1, e001 (2008)
- Nakamura, T. et al., Proteins, 62, 822-826 (2006)
- Nakamura, T. et al., Acta Crystallogr. F, 63, 7-11 (2007)
- Ishikawa, K. et al., J. Mol. Biol., 366, 857-867 (2007)
2013/11/29 著者よりリン酸塩を含むバッファー組成、バッファー名、用語を修正
・リン酸塩を含むバッファー組成の修正
第1日 2)(1)
(誤)KH2PO4 70 g
(正)KH2PO4 30 g
(誤)NaCl 70 g
(正)NaCl 5 g
・バッファー名の修正
第1日 2)
(誤)(1)最小培地バッファーを・・・
(正)(1)10x最少培地バッファーを・・・
第1日 2)(4)以下のものを混ぜて・・・の下
(誤)最小培地バッファー(1) 200 mL
(正)10x最少培地バッファー(1) 200 mL
・『最小培地』を『最少培地』に修正