まえがき
本稿は、私たちがレチナール蛋白質研究の中で経験してきた発現・可溶化の実際について、蛋白質科学に関わる知見を広く知ってもらうことを念頭に、原著論文では示さないようなことや現在問題となっている点などについて記した。そのため、思い込みや科学的に間違っている点があるかもしれないが、一つの私見として参考にして頂ければ幸いである。また、百聞は一見にしかずの言葉通り、レチナール蛋白質の色を指標に、発現、可溶化、精製、結晶化を行うことで、実際に膜蛋白質が標品となっていく過程を目で追うことができる。このような用途において、レチナール蛋白質は、SDS-PAGE のゲルを CBB で染めてみることより有用である。また、出前授業やオープンキャンパスなどのアウトリーチ活動でも、見た目の美しさだけでなく、簡単な操作(塩の添加、pH の変化、温度の変化など)で色を変えることができ、好評を博している。このような観点を含めて、レチナール蛋白質の遺伝子や蛋白質そのものを欲する方はご相談頂ければ幸いである。
概要
ここでは、膜貫通型蛋白質の発現および可溶化について、7本のαヘリックスを持ち、ほぼ中央部に発色団レチナールを内包するレチナール蛋白質の例を紹介する。本稿は2008年の本アーカイブスの記事 #009「膜蛋白質の抽出(可溶化)」(1)の増補・改訂版であり、前稿発表後に新たに得た知見を中心に加筆している。そのため、実験プロトコールの詳細については、前稿 #009「膜蛋白質の抽出(可溶化)」を参照していただきたい。
目的・イントロダクション
膜蛋白質は、全蛋白質の25~30%を占め、エネルギー、情報、物質などを外界とやり取りすることで、様々な生物機能を司る蛋白質群である。この特性から、現在市販されている60%以上の薬が膜蛋白質を直接のターゲットとしている。膜蛋白質の研究者なら一度はこのような書き出しをした、あるいは目にした経験があるだろう。一方で、蛋白質研究の一つの指標となる PDB 登録数のうち、膜蛋白質が占める割合は数%に過ぎない。その理由には天然存在量の少なさや取り扱いの難しさ、さらには膜蛋白質解析における固有の操作である『可溶化』の存在にある。私たちは、7回膜貫通型レチナール蛋白質と、その情報伝達分子である2回膜貫通型蛋白質の、発現、可溶化・精製と機能・構造解析に取り組んでいる (2)。レチナール蛋白質は、その名の通りビタミン A の誘導体であるレチナールを膜貫通部に保持する蛋白質群で、橙色から紫色まで様々な色を呈する。その見た目の美しさとともに、変性すると黄色に変化する特徴から、機能確認が容易であり、発現および可溶化の条件検討にも適した蛋白質である (3)。ここでは、著者らの長年に渡るレチナール蛋白質との格闘について、科学的裏付けが弱い経験的なことや、普段論文では述べない失敗談も交えて提示する。今後、レチナール蛋白質が可溶化や機能確認の入門分子として使われることで、一人でも多くの方が膜蛋白質研究に参画してくれることを願っている。
装置・器具・試薬
- 遠心機(各社)
- 超遠心機(各社)
- ホモジェナイザー
- 全トランスレチナール(Sigma)
- イソプロピル-β-D-ガラクトピラノシド(IPTG)(WAKO)
- L-(+)-アラビノース(WAKO)
- n-dodecyl-β-D-maltoside(DOJINDO, Anatrace)
- n-octyl-β-D-glucoside(DOJINDO)
- コール酸(各社)
- Bio-Beads(BioRad 社)
実験手順
- 膜蛋白質の発現
- 細胞の破砕と膜画分の調製
- 膜蛋白質の可溶化と機能(活性)確認
実験の詳細
1. 膜蛋白質の発現
レチナール蛋白質の代表格であるロドプシンは、視覚の光受容体として機能する。動物を中心に分布するこれらレチナール蛋白質は、Tyep-2 型と呼ばれている (4)。一方、1971年に高度好塩性古細菌より見出されたバクテリオロドプシン(BR)は、光駆動のプロトンポンプとして機能し、同一古細菌から見出されたハロロドプシン(HR)、センサリーロドプシン I(SRI)、センサリーロドプシン II(SRII、フォボロドプシン:pR とも呼ばれる)などとともに Type-1 型レチナール蛋白質と呼ばれている (4)。
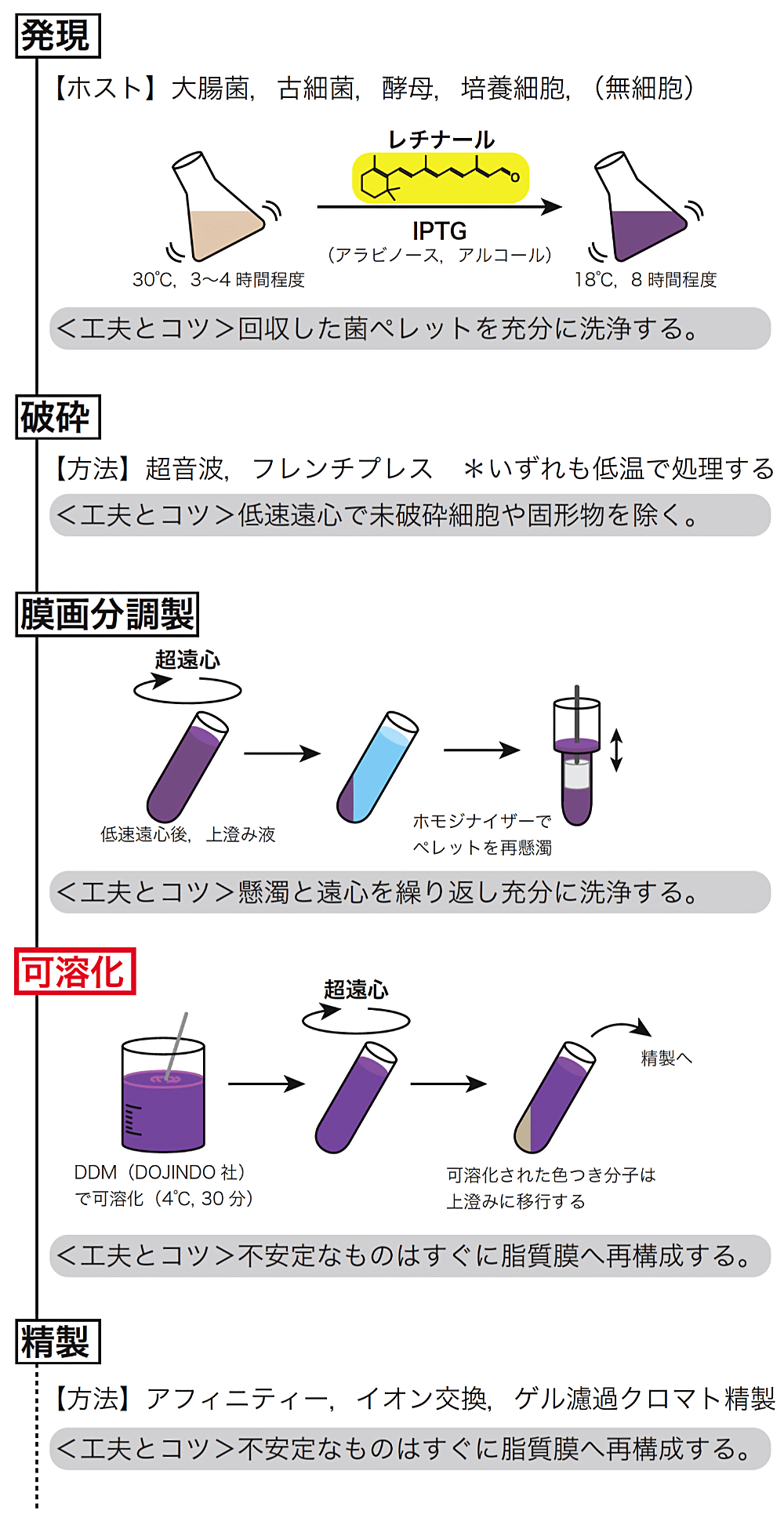
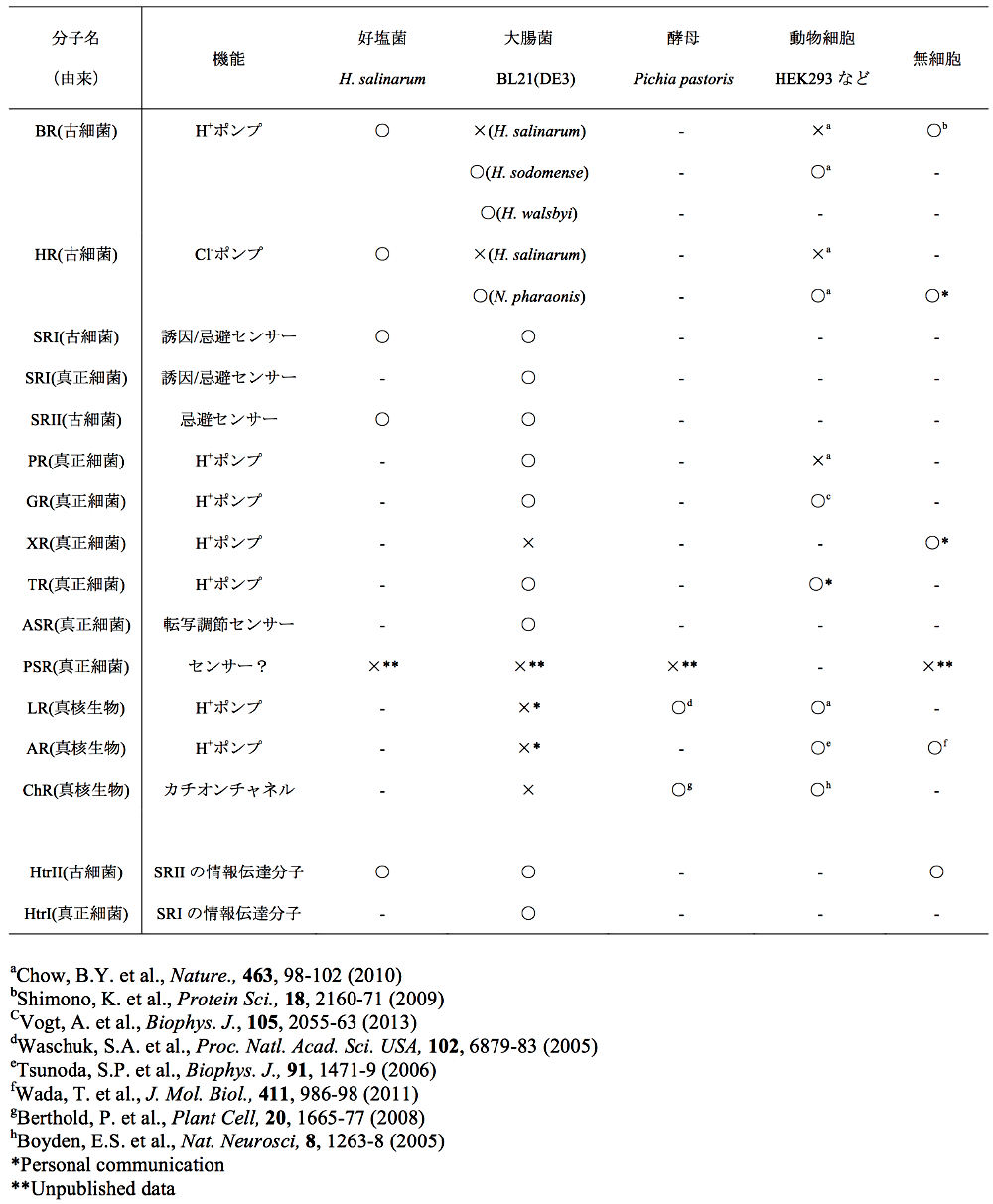
当初、好塩性古細菌のみに存在すると考えられてきた Type-1 型レチナール蛋白質は、ゲノム科学の進展により、真正細菌、真核生物からも見つかり、生物の三大ドメイン全てに存在することが明らかになってきた (2)。これら蛋白質の発現は、古細菌の一種である Halobacterium salinarum や、大腸菌、酵母、動物細胞、無細胞蛋白質合成系などを用いて試みられている。表1には、私たちが扱ってきた Type-1 型蛋白質を中心に、発現系と発現結果について記載した (5–17)。当初、古細菌を中心に発現系の構築 (5,8) が試みられたが、1997年に高度好塩好アルカリ性古細菌である Natronomonas pharaonis 由来の SRII(NpSRII)が、大腸菌膜に機能的に発現することが明らかになって以降 (18)、遺伝子操作が容易である、安価であるなどの点から、大腸菌における発現系が第一選択肢として用いられている (6,7,9,11,13,14)。また、酵母や動物細胞 (16)、さらには、大腸菌や小麦胚芽の抽出液を用いた無細胞蛋白質合成系による発現系の構築 (12) も行われている。表1を詳しくみると、大まかには、古細菌および真正細菌由来のレチナール蛋白質は大腸菌と、真核生物由来のレチナール蛋白質は酵母、動物細胞と相性が良いことがわかる。一方、光遺伝学のツールとして動物細胞に発現させる場合、真核生物由来のものより、古細菌由来のものの成功例が多い (19)。このように、由来蛋白質が属する生物種を第一選択肢としながら、他の生物種も試みるというスタンスが良いと私たちは考えている。それぞれの細かな発現方法は、前稿 (1) や他の解説・総説 (2,3,20,21) などをご参照頂きたい。また、併せて図1に示した発現から精製までの大まかな模式図もご参考にして頂きたい。発現について簡単に述べると、試薬(IPTG,アラビノース,アルコール)による発現誘導を行い、その際に補因子(発色団・レチナール)を添加する。経験的に、発現誘導後、低温(18℃)で長時間(~8時間程度)培養すると、正常に折りたたまれた機能性蛋白質が得られる割合が高い。動物細胞や無細胞系の場合は、培養や合成のはじめから補因子を添加し、翻訳後速やかにホロ蛋白質として膜に挿入されるようにしている。
前稿 #009「膜蛋白質の抽出(可溶化)」からの加筆として、末端配列の発現量に与える影響について述べておきたい。古細菌の誘因・忌避センサーである SRI や真正細菌・アナベナ PCC7120 の光(転写調節)センサーである ASR において、細胞内側のカルボキシ末端20残基程度を切断すると、発現量が10倍程度上昇する (15)。また、真核生物のカチオンチャネルである ChR の場合、全長では大腸菌膜への機能的な発現が見られないが、カルボキシ末端に加え、アミノ末端の数十残基を切断すると、折りたたまれたホロ蛋白質として発現することがわかっている(未発表)。このように、膜貫通部位を残して、水溶性部位を切断することが発現に効果的である場合も多い。一方で、細胞外や細胞内に面するヘリックス間のループ部分の短縮や延長は、発現量を大きく低下させる。コドンの最適化については、これまでの経験上、ほとんど発現量に影響を与えない。
【用語の説明: 光遺伝学】
2005年からレチナール蛋白質を中心に用いられている技術 (22)。神経細胞に光開閉型イオンチャネルを発現させ、光刺激による脱分極を引き金に、神経細胞を興奮させることができる (23)。また、光駆動のイオンポンプを発現させ、光による過分極により神経細胞を抑制させることができる (23)。現在では、細胞内シグナル伝達系の制御などにも応用されている。このような光で細胞や動物個体の機能を操作する技術は、総称して光遺伝学(Optogenetics)と呼ばれている。
2. 細胞の破砕と膜画分の調製
細かな手順や方法は前稿 (1) や他の解説・総説 (2,3,20,21)などをご参照頂きたい。変更点・加筆点について以下に述べる。可能な限り低温で破砕と膜画分の調製を行うことが望ましく、可溶化までは特に遮光下で行う必要は無い。また、経験的に、プロテアーゼインヒビターの添加は、長期保存の場合においてもほとんど安定化に寄与しない。古細菌や真正細菌の誘因・忌避センサーである SRI には、Cl- の結合部位があり、その親和性(~300 mM)より低濃度では、著しく蛋白質の安定性が低下するため (24)、破砕と膜画分の調製中、さらには可溶化後にも 1 M 以上の NaCl を添加しておく必要がある。ハライドポンプである HR や忌避センサーである SRII にも、Cl-結合部位が存在する (25)。SRI に比べて脱塩下でも大きく安定性を損なうことはないが、300 mM 程度の NaCl 存在下で試料調製を行っている。他の蛋白質で安定化剤として用いられるアジ化ナトリウム(アザイド)は、低濃度(μM)でもレチナール蛋白質の光反応に影響を与えるため (26,27) 加えない。
3. 膜蛋白質の可溶化と機能(活性)確認
私たちは、様々なレチナール蛋白質の発現・可溶化・精製・機能解析を行ってきた(表1)。その中で、可溶化には親水基に糖鎖を持つ非イオン性の界面活性剤、DDM(n-dodecyl-β-D-maltoside)を最も良く用いている。他の界面活性剤中でも可溶化でき、かつ安定である場合もあるが、その場合においても、DDM で可溶化した場合の方が安定であることが多い。DDM は、臨界ミセル濃度(CMC:critical micelle concentration)が低い(0.2 mM)ため、可溶化後透析などで除きづらい欠点がある。そのため、実験の都合上、例えば結晶化や NMR 測定において、CMC が高いものや分子量の小さいものなどを探索する場合も、類似の界面活性剤である Octyl-glucoside(OG)や Nonyl-glucoside(NG)などを次の選択肢としている。私たちは、レチナール蛋白質以外の膜蛋白質として、2回膜貫通型αヘリックスを持つ、光センサーの相互作用蛋白質・Htr に関しても研究を行っている (8,10,28,29)。Htr は、DDM だけでなく、OG、NG、コール酸など幅広い界面活性剤中で光センサーと相互作用できるため、それらのミセル中でも構造や機能を保持していると考えられる。それ以外の条件では、光センサーが不安定であるため相互作用の確認はできないが、CD スペクトルからは、CHAPS や Cymal などの界面活性剤中でも二次構造は維持されていることが確かめられている(未発表)。
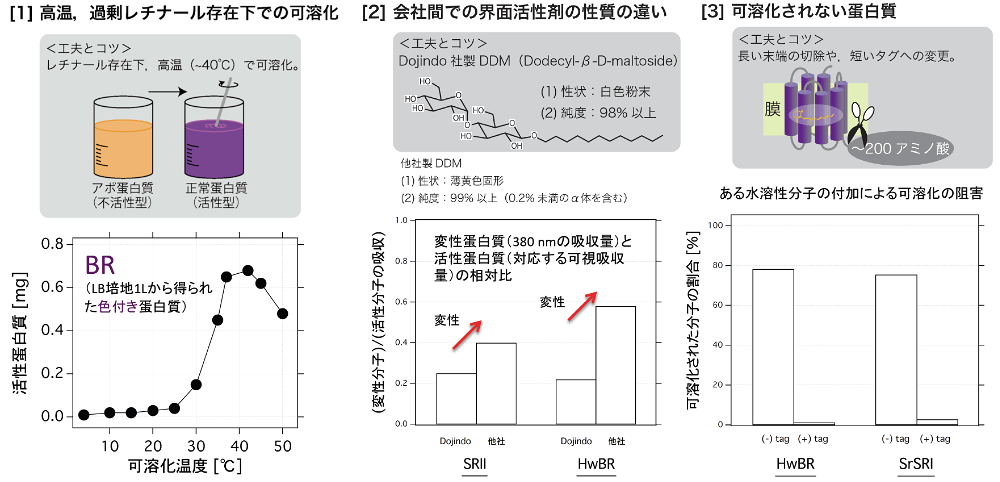
前稿を執筆してから、さらに幅広いレチナール蛋白質を扱うようになり、以下および図2に記す幾つかの新しい知見が得られている。[1] 高い温度中(~40℃)で可溶化し、その際に大量の補因子レチナールを入れておくことで、機能性蛋白質が得られる場合がある。[2] 同じ界面活性剤でも販売する会社によって性質が異なる。[3] CMC を大きく上回る濃度でも可溶化されない場合がある。それぞれについて以下に詳しく述べる。
1. 温度と補因子添加の影響(図2 [1])
大腸菌膜に発色した状態で発現しない BR や HR について、高い温度中(~40℃)かつアポ蛋白質に対して等量以上の補因子レチナールを添加した状態で可溶化することで、正常に折りたたまれた蛋白質と同様の紫色を呈し、かつ、その他の性質も古細菌で発現させた場合とほとんど同一であることが確かめられている (7,30)。温度に関しては、BR において、25℃以下では変性状態と同様の黄色のままであるが、30℃付近を境に紫色に色づいた蛋白質の割合が大きくなることがわかっている(図2 [1])。このことは、補因子が蛋白質内部に取り込まれる際に、アポ蛋白質もしくはミセルの運動性がある一定以上、必要であることを示唆している。このように、大腸菌膜にはホロ蛋白質として発現しない分子であっても、高温下での可溶化という摂動を加える事で、機能性蛋白質として巻き戻ることがある。一度色を回復した蛋白質は、その後再度膜に再構成しても正常に働き、変性操作を加えない限り、様々な条件で安定である。このように、発現させた細胞膜で機能を失っている膜蛋白質でも、諦めずに(例えば、リガンド存在下かつ高温下で)可溶化と再構成を行えば、機能性蛋白質が得られるかもしれない。
2. 界面活性剤の性質(図2 [2])
SRII をはじめとした幾つかのレチナール蛋白質において、DOJINDO 社の DDM と、他社の DDM のそれぞれで可溶化した場合、様々な性質が異なる。具体的には、変性蛋白質の割合の違い、極大吸収波長(色)の違い、光反応の違いなどである。ロットでの違いは感じないため、製造方法及び含まれる不純物による影響であると考えている。純度はDOJINDO 社が98%以上、他社は、β体+α体で99%以上となっている。また、本来白色粉末であるが、他社の製品はやや黄色がかっており、固形に近い形状をしている。他社の DDM で可溶化した場合、変性を示す黄色い成分の割合が高く(図2 [2])、光反応の戻りの速度も速くかつ二相性を示す(未発表)。DOJINDO 社のものは変性の割合が少なく、光反応は生体膜中のものに近い。これらのことから、私たちは DOJINDO 社の DDM を用いている (1–3,5–18,20,21,23–30) が、大事なことは、同じ製品名でも販売元によっては性質が異なる可能性があることであり、データの再現性という観点からも、購入先は統一すべきであると考えられる。可溶化条件や結晶化条件の探索に、様々な界面活性剤のカクテルを購入して試す場合も多いと思うが、このことを念頭においておくべきかもしれない。
3. 可溶化されない蛋白質(図2 [3])
レチナール蛋白質は、天然のプローブであるレチナールを内包している。そのため、内包されたレチナールの光応答性を指標に、機能や構造を明らかにする試みがなされてきたが、近年、蛍光分子をはじめとした様々な分子との融合体を作成し、分子イメージング技術と組み合わせた解析が盛んになってきた。私たちもこれら研究に取り組んでおり、誘因・忌避光センサーである SRI やプロトンポンプ HwBR などのカルボキシ末端に100~200アミノ酸程度の水溶性蛋白質(タグ)を融合したことがある。その際に、発現自体は、封入体にならず、正常な色つき蛋白質として細胞膜に発現するものの、CMC の50倍量の DDM でもほとんど可溶化されない現象に遭遇した(図2 [3])。他の糖系の界面活性剤でも同様の結果となり、SDS やイオン性の界面活性剤では可溶化自体は起こるものの、速やかに変性することがわかった。融合した水溶性蛋白質(タグ)の多量体化が原因とも考え、単量体化するものへの変更も行ったが、結果は同じであった。また、融合蛋白質(タグ)が無い場合は、そのような現象は起こらなかった(図2 [3])。正直なところ、この原因はよくわからないが、6個のヒスチジンからなる短いタグ(ヒスタグ)ではそのような現象が起こらないことや、末端の可溶性部位が長いレチナール蛋白質では、界面活性剤による可溶化効率が低い経験則から、末端部位が可溶化の阻害要因として働くのではないかと考えている。他の膜蛋白質でも可溶化効率が低い場合は、末端の切除や短いタグへの変更などを行った方が良いかも知れない。
工夫とコツ
ここでは、前稿 (1) や他の解説・総説 (2,3,20,21) では述べていない点を中心に記す。
細胞と破砕後の膜画分の洗浄操作
細胞を低速遠心で回収した際に、緩衝液に懸濁する。その後、同様もしくは一部組成の異なる緩衝液で洗浄操作を行う。その際に、膜に非特異的に吸着した補因子レチナールの黄色が洗い流されてくるため、その黄色を指標に、何度洗浄操作を行うかを決める。経験的には、遠心後、きちんと上澄みを除けば、おおよそ3回の操作で、上澄みが透明になるため、3回以上の洗浄をした後、−80℃で保存している。また、細胞破砕後に膜画分を調製する際は、低速遠心にて未破砕細胞や固形物を除いた後、上澄みを超遠心にかけ、ペレットを回収する。ペレットは、ホモジェナイザーを用いて入念に再懸濁する。こちらも3回程度懸濁操作と超遠心を繰り返すことで、上澄みが透明となるまで処理し、膜画分とする。
可溶化
一部前稿にも記載したが、可溶化操作の際は、あらかじめ界面活性剤を懸濁した高濃度水溶液を添加して可溶化すると、可溶化効率が低いため、粉末そのものを直に試料溶液に加えるようにしている。また、可溶化操作より後の作業は、特に低温(4℃)での操作を徹底している。可溶化時間は、全ての粉末が溶液に溶けてから30分以内を目安としている。大腸菌膜の場合、長時間の可溶化により、上澄みに現れる色つきレチナール蛋白質の割合が低下し、ペレットに色つき蛋白質が残る傾向がある。そのため、最終的に回収できる試料の量が減少する。また、この種の蛋白質特有の性質であるが、可溶化後はできる限り暗状態に維持することが推奨される(蛍光灯下程度なら問題にならない場合も多い)。精製度が高まるとより不安定になる蛋白質も多く、その場合は、できるだけ速やかに脂質膜へ再構成することが求められる。そのため、再構成においては、時間を要する透析法を用いることは避け、界面活性剤の吸着剤である Bio-Beads(BioRad 社)を用いた方法か、希釈法により、できる限り迅速に再構成を行う。
実験の安全
レチナールは、溶液中において光で分解もしくは異性化するため、発現誘導中は暗状態で培養する。また、人体に毒性があるため、取り扱いの際は手袋を用いる。
文献
- 須藤 雄気, 蛋白質科学会アーカイブ, 1, e009 (2008)
- Sudo, Y., CRC Handbook of Organic Photohem. Photobiol. the 3rd edition, 1173-93, CRC Press, Boca Raton (2012)
- 須藤 雄気, 薬学雑誌, 132, 407–416 (2012)
- Spudich, J.L. et al., Annu. Rev. Cell Dev. Biol., 16, 365–92 (2000)
- Sudo, Y. et al., Biophys. J., 80, 916–22 (2001)
- Sudo, Y. et al., Photochem. Photobiiol., 74, 489–94 (2001)
- Sudo, Y. et al., J. Mol. Biol., 357, 1274–82 (2006)
- Sudo, Y. & Spudich, J.L., Proc. Natl. Acad. Sci. USA, 103, 16129–34 (2006)
- Kitajima-Ihara, T. et al., J. Biol. Chem., 283, 23533–41 (2008)
- Sudo, Y. et al., Biochemistry, 48, 10136–45 (2009)
- Yagasaki, J. et al., Biochemistry, 49, 1183–90 (2010)
- Sudo, Y. et al., Biophysics, 7, 51–8 (2011)
- Sudo, Y. et al., J. Biol. Chem., 286, 5967–76 (2011a)
- Sudo, Y. et al., J. Biol. Chem., 286, 11328–36 (2011b)
- Irieda, H. et al., J. Biol. Chem., 287, 32485–93 (2012)
- Sudo, Y. et al., J. Biol. Chem., 288, 20624–32 (2013)
- Tsukamoto, T. et al., J. Biol. Chem., 288, 21581–92 (2013)
- Shimono, K. et al., FEBS Lett., 420, 54–6 (1997)
- Chow, B.Y. et al., Nature, 463, 98–102 (2010)
- 須藤 雄気ら, 実験医学, 23, 1933–1937 (2005)
- 須藤 雄気ら, 遺伝子医学 MOCK 別冊「図・写真で観るタンパク質構造・機能解析実験実践ガイド」, 41–46 (2005)
- Boyden, E.S. et al., Nat. Neurosci., 8, 1263–8 (2005)
- Tsukamoto, T. & Sudo, Y., In: eLS. John Wiley & Sons, Ltd: Chichester. DOI: 10.1002/9780470015902.a0022838 (2014)
- Suzuki, D. et al., J. Mol. Biol., 392, 48–62 (2009)
- 須藤 雄気ら, 極限環境微生物学会誌, 10, 23–9 (2011)
- Sudo, Y. et al., Biochim. Biophys. Acta, 1558, 63–9 (2002)
- Irieda, H. et al., Biochemistry, 50, 4912–22 (2011)
- Sudo, Y. et al., J. Biol. Chem., 281, 34239–45 (2006)
- Sudo, Y. et al., J. Biol. Chem., 282, 15550–8 (2007)
- Yamashita, Y. et al., Biochim. Biophys. Acta, 1808, 2905–12 (2011)